химия. 200 химия сессия 2. 1. атынасы бойынша есептейді еріген затты массалы лесін эквивалентті молярлы концентрациясын молярлы концентрацияны моляльды концентрацияны молдік лесті 2
 Скачать 154.79 Kb. Скачать 154.79 Kb.
|
|
1). 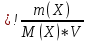 қатынасы бойынша есептейді қатынасы бойынша есептейді* еріген заттың массалық үлесін * эквиваленттің молярлық концентрациясын * молярлық концентрацияны * моляльдық концентрацияны * молдік үлесті 2). Эквиваленттік факторлары бірдей топ * Ca(OH)2, HCl, AlCl3 * H3PO4, CrCl3, Fe(OH)3 *H2SO4, HCl, NaNO3 *HCl, NaCl, Ca3(PO4)2 * H2SO4, Fe2(SO4)3, MgCl2 3). Ерітіндінің молярлық концентрациясын есепте, егер 400 мл ерітіндіде 4г натрий гидроксиді еріген (моль/л) * 0,5 * 0,05 * 0,125 * 0,025 * 0,25 4). 300 мл молярлық концентрациясы 0,5 моль/л ерітіндіні дайындауға неше грамм кұкірт қышқылы керек ( г) * 29,4 *14,7 * 2,94 * 1,47 *4,41 5). Ерітіндінің титрін есепте, егер 2 г MgCl2 2 л ерітіндіде еріген *1,0 * 0,1 * 0,01 * 0,02 * 0,001 6). 500мл ерітіндіде тұз қышқылының массасын(г) есепте егер ерітіндінің титрі 0,00365 г/мл болса *1,825 * 3,65 * 0,003656 * 0,01825 * 0,00182 7). Кальций гидроксидінің молярлық эквиваленттік массасы тең (г/моль) * 57 * 37 * 91 * 97 *74 8). Қышқылдық-негіздік реакцияларда бір сутек ионына, тотығу-тотықсыздану реакцияларында бір электронға эквивалентті шын немесе шартты бөлігі аталады * эквивалент * эквиваленттік факторы * молярлық эквиваленттік массасы * заттың эквивалент мөлшері *мольдік үлес 9). Эквиваленттік фактор көрсетеді берілген қышқылдық-негіздік реацияларында заттын қай бөлшегі эквивалентті *реакцияға қатысқан барлық электрондарға *бір электронға * реакцияға қатысқан барлық сутек иондарына *бір сутек ионына * электрондар мен иондардың қосындысына 10). қатынысымен есептейді * қышқылдың эквиваленттік факторын * негіздің эквиваленттік факторын * тұздың эквиваленттік факторын * оксидтердің эквиваленттік факторын *тотығу-тотықсыздану реакциясына қатысқан заттың эквиваленттік факторын 11). Моль/л - өлшем бірлігімен өлшенеді *мольдік үлес *молярлық концентрация *моляльдық концентрациия *массалық үлес * мольдік үлес 12). Эквиваленттік факторы f э = 1 тең қосылыс * Na2SO4 *NaNO3 * CaCI2 * Na2CO3 * Na3PO4 13). Эквиваленттің молярлық концентрациясын есептейтін теңдік *  *  *  *  *  14). Массалық саны 208-ге тең Pb атомы ядросындағы нейтрон саны * 82 * 125 * 207 * 289 *126 15). Қорғасынның қосылыстарындағы ең жоғары валенттілігі * 1 * 2 * 3 *4 * 6 16). Атомдарының сыртқы электрондық орбиталы ns2np1-мен сипатталатын элементтер * Na және Mg * K және Ca * Са және Sr * Al және B * Mg және Ca 17). NH3молекуласының пішіні *тең қабырғалы үшбұрыш *бұрыштық *тетраэдр *дұрыс пирамида * ромб 18). Орталық атомы sр3-гибридті түрде болатын молекуланың құрылысы *тетраэдр *тең қабырғалы үшбұрыш *пирамида * шаршы * тікбұрышты 19). Электрон жұптарының екі атомның ядро арасында бірдей қашықтықта орналасуынан түзілетін химиялық баайланыс түрі * иондық *ковалентті полюсті *ковалентті полюссіз * сутектік * металдық 20). Бір молекуланың протоны мен басқа молекуланың электртерістігі жоғары элемент атомының әрекеттесуінен пайда болатын байланыс * иондық *ковалентті полюсті *ковалентті полюссіз *сутектік * металдық 21). Атомдардың ядро арасын қосатын түзу бойында электрон бұлттарының қаптасуынан түзілген молекулалық орбиталь *атомдық *молекулалық *  – орбиталь – орбиталь *π – орбиталь *φ-орбиталь 22). Атомы sр2 -гибридті түрде болатын молекуланың геометриялық пішіні *үшбұрыш *тетраэдр *бұрыштық *октаэдрлі * шаршы 23). Валенттік бұрышы 109028/ болатын СН4 молекуласының гибридтену түрі * sp *sp2 *sp3 *sp3d2 *sp3d4 24). Қоршаған ортамен энергиясымен де, массасымен де алмасатын термодинамикалық жүйе *ашық * жабық * оқшау * гомогенді * гетерогенді 25). Изобаралық-изотермиялық жағдайдағы жүйенің энергия қорын сипаттайтын күй функциясы * температура * қысым * энтальпия * энтропия * Гиббс энергиясы 26). Изобаралық-изотермиялық жағдайда химиялық реакция нәтижесінде бөлінетін немесе сіңірілетін жылу мөлшері * температуралық коэффициент * реакцияның жылу эффектісі * стандартты ыдырау жылуы * стандартты түзілу жылуы * стандартты бейтараптану жылуы 27). Қоршаған ортамен энергиясымен алмасатын, массасымен алмаспайатын термодинамикалық жүйе * ашық *жабық * оқшау * гомогенді * гетерогенді 28). Термодинамикалық жүйеде өтетін процестегі энтропиясы артатын реакция * 2N2O + 4O2- 2N2O5 * 3Н2 + N2- 2NН3 * 4НСl + O2 - 2Сl2 + 2Н2O * N2 + О2- 2NO *2Н2O2- 2H2O + O2 29). Изобаралық процестегі жылу эффектісін Qp есептейтін өрнек * Qp = ∆G -T∆S *Qp = ∆U *Qp = ∆H * Qp = p∆V * Qp = U + p∆V 30). Термодинамикалық жүйеде өтетін процестегі энтропиясы өзгермейтін реакция * HCl + NH3® NH4Cl * C2H5OH + 3O2® 2CO2 + 3H2O * NI3NH3® N2 + ЗНI * H2 + Сl2® 2НСl * 2CO + O2® 2CO2 31). Иондар - бұл… *бір ядро зарядымен сипатталатын атомдар *электрлік заряды бар біратомдық немесе көпатомдық бөлшектер * барлық байланыстар молекулалық –ковалентті жағдайындағы молекуладағы атомдардың шартты зарядтары *электрлік сымдарды жасауда қолданылатын заттар * барлық байланыстар молекулалық –металдық жағдайындағы молекуладағы атомдардың шартты зарядтары 32). Диссоциацияны сипаттайтын және ерітінді концентрациясына тәуелді емес бірлік… * гидролизконстантасы *суды иондарға бөлінуі *диссоциация константасы *еріген электролиттердің ерітіндінің жалпы массасына қатынасы *ерітуді жүргізу 33). К w бірлігін ... деп атайды: *сутектік көрсеткіш *судың ерігіштік көбейткіші *судың иондық көбейткіші *дистилляция көбейткіші *ерітіндінің қышқылдану көрсеткіші 34). Барий карбонатының тұз қышқылымен әрекеттесуін сипаттайтын қысқартылған иондық теңдеу: * Ba2+ + 2CI- = BaCI! * Ba2+ + CO32- + 2H+ + CI- = Ba2+ + CO32 + 2HCI↑. * BaCO3 + 2H+ = Ba2+ + CO2↑ +H2О * 2H++ CO32 = H2CO3 *Ba2+ + CO32 = BaCO3↓ 35). Барий хлориді қандай затпен алмасу реакциясына түседі * HNO3 *CuSO4 *CuCI2 * LiOH * HNO2 36). Көптеген тұздардың сулы ерітіндісі сілтілік немесе қышқылдық орта болуы мүмкін. Оның себебі … *тұздардың электролизі *тұздардың диспропорциялануы *тұздардың гидролизі *тұздардың гидратталуы *тұздардың ассоциациясы 37). Қай зат суда толық гидролизденеді *+Al2S3 *мұндай заттар болмайды *KCI * H2SO4 * NaNO3 38). Таза судың 250С температурадағы иондық көбейтіндісінің мәні: * 10-14 * 10-7 * 10+7 * 1014 * 14 39). Реакция ортасының қышқылдық жаққа ығысуы: *ацидоз *алкалоз *гидролиз * бейтараптану * алмасу 40). Молярлық концентрациясы 0,1 моль/л HCI ерітіндісінде: * [H+] = [OH-] * [H+]< [OH-] * pH = 1 * pOH = 1 * [H+] = 10-13 41). СNaOH = 0,001моль/л ерітіндісінің рН-ы: * 10-2 * 2 * 9 * 11 *10-12 42). Химиялық реакцияның жылдамдығы – бұл: * уақыт бірлігінде әрекеттесуші заттардың концентрациясының өзгеруі * химиялық реакцияның элементарлық актысына қатынасатын молекулалар саны * ферменттің бір молекуласының әсерінен өзгеретін субстрат молекуласының саны * реакцияның кинетикалық теңдеуіндегі дәреже көрсеткіштерінің қосындысы *уақыт бірлігінде катализатор концентрациясының өзгеруі 43). aA + bB ↔ dD+eE түріндегі жалпы кері реакцияға тепе-теңдік константасы К жазылады: *  *  *  *  *  Тік жақшалар тепе-теңдік концентрациясын білдіреді; a,b,d,e – стехиометриялық коэффициенттер. 44). Химиялық реакция жылдамдығының әрекеттесуші заттардың концентрациясына тәуелділігін сандық түрде сипаттайды: * Вант-Гофф ережесі * әрекеттесуші массалар заңы * Гиббс теңдеуі * Михаэлис-Ментен теңдеуі. * Гендерсон-Гассельбах теңдеуі. 45). w = k·c2 кинетикалықтеңдеугесәйкескелетін реакция реті: * нөлдік * біріншілік * үшіншілік *екіншілік * бөлшектік 46). Ферменттердің каталитикалық әсерінің ерекшелігі: * өтетөменкаталитикалықактивтіліккөрсетеді * каталитиклықәсердіңтемпературағатәуелсіздігі * каталитиклықәсердің рН-қатәуелсіздігі *жоғарытаңдамалылықәсері * әсердіңтемпературалықоптимумыныңболмауы 47). Реакция жылдамдығынакатализатордыңәсері: * тура реакцияныңжылдамдығынтөмендетеді * керіреакцияныңжылдамдығынтөмендетеді *реакцияныактивтендіруэнергиясытөменреакцияныңбағытынабағыттайды * актвтендіруэнергиясыжоғарыреакцияныңбағытынабағыттайды * тепе-теңдіктіығыстырады 48). Бимолекулалықреакцияныкөрсетіңіз * + H2 + J2® 2HJ * J2® 2J * H2® 2H * NH4Cl ® NH3 + HCl * NH4CNS ® (NH2)2CS 49). Жүйеніңқысымын 5 есеарттырғанда СаСО3(т) = СаО(т) + CO2(г)тура реакцияның жылдамдығы: * 5 есеөседі * 25 есекемиді * 5 есекемиді * 25 есеартады *өзгермейді 50).γ = (Kt + 10) / Кtтеңдеуіндегі γ шамасы: * изотондық коэффициент * координациялық сан *реакция жылдамдылығыныңтемпературалықкоэффициенті * эквиваленттік фактор * ионданудәрежесі 51). Химиялықреакцияныңэлементарлықактысынақатысатынмолекулалар саны: * реакцияныңмолекулалығы * реакция реті * реакция жылдамдығы * реакцияныңжылдамдықконстантасы * реакцияныңтемпературалықкоэффициенті 52). Қан плазмасына гипертонды болатын ерітінді * 0,1 % NaCl-ніңерітіндісі *B) 10,0 % NaCl-ніңерітіндісі * 0,15М NaCl-діерітіндісі * 0,9 % NaCl-ніңерітіндісі * 0,01М NaCl-діерітіндісі 53). Гипотондыерітіндідегіжасушаныңісініп, содансоңжарылуқұбылысы *диализ *тургор *гемолиз * плазмолиз * деплазмолиз 54). Қантамырынаегуүшінқолданатынерітінді *аса қаныққан *гипертонды *изотонды * гипотонды * қаныққан 55). Вант-Гофф заңыбойыншаерітіндіконцентрациясытәуелді * еріткіштіңерітіндібетіндегіқаныққанбуқысымыныңөзгеруіне *ерітіндініңқатутемпературасыныңтөмендеуіне * ерітіндініңқайнаутемпературасыныңжоғарылауына * ерітіндініңосмостыққысымына * диффузия құбылысына 56). Ерітіндідежоғарымолекулалыққосылыстардыңболуынантуындайтыносмостыққысымның бірбөлігі * ерітіндібетіндегіеріткіштіңқаныққанбуқысымы *онкотикалыққысым * осмостыққысым * ерітіндініизотондау * тургор 57). Вант-Гофф заңы:  RT + RT +* а = fC  қайнау қайнау  *  қату қату * i=  58). [Co(CN)4(H2O)2] – комплекстіиондағыкомплекстүзушініңтотығудәрежесі * +4 * +5 * +3 * +6 * +2 59). Калий монобромопентанитроплатинат (IV) қосылысыныңформуласы * K[PtBr(NO2)5] *[PtBr(NO2)5]K *+K2[Pt(NO2)5Br] * [Pt(NO2)5]KBr * [KBr][Pt(NO2)5] 60). Нитрокомплекстіқосылыс * [Cd(NH3)4]CI2 *K[Al(OH)3H2O] *+K2 Na[Co(NO2)6] * [Pt(NH3)4][PtCI6] * [CoBr(NH3)5]SO4 61). Ацидокомплекстіқосылыс *K[Al(OH)3H2O] * [CoBr][(NH3)5] ∙SO4] *[PtCI(NH3)3]CI * Ca[Al(OH)5H2O] *+ К3[Fe(СN)6] 62). [Co(NH3)5СI]CI2 комплекстіқосылыстағылиганда * Со2+ *+ [Co(NH3)5СI]2+ *Co3+ * 5NH3 және CI- * 2CI- . 63). Комплекстіқосылыстағыорталық атом өзінқоршайорналасқанлигандалармен … құрайды * сыртқыкоординациялықсфераны *комплектіқсылысты *ішкікоординациялықсфераны *қостұзды * орта тұзды 64). Әрекеттесетінзаттарқұрамындағы элемент атомдарныңтотығудәрежесіөзгережүретін реакцияларды ... депатайды *кинетикалық *стехиометриялық * тотығу-тотықсыздану *иондық *тотығу 65). Берілгендердендиспропорциялықреакциянытаңдаңыз * S + 2HNO3(конц) = H2SO4 + 2NO↑ *Mg + S = MgS *2H2O2 = 2H2O+ O2↑ *+ 6KOH + 3S = K2SO3+ 2K2S +3H2O * Cu + 4HNO3= Cu(NO3)2 + 2NO2+ 2H2O 66). CrCI3 + H2O2 + NaOH→Na2CrO4 + H2O + NaCI реакциясындағы Н2О2 –тіңкөрсететінқасиеті *еріткіш *орта түзеді * тотықтырғыш *тотықсыздандырғыш *катализатор 67). Этиленнің калий перманганатыменбейтарапортадатотығуынантүзілетінөнімдер * HOCH2CH2OH + MnO2↓+ KOH *CH3CH2OH + K2MnO4 *CH3CH2OH + MnO2↓+ KOH * CH3COOK + Mn(CH3COO)2 * HOH2C- CHOH-CH2OH + MnO2+ KOH 68). Төменгі схема бойынша 2МеNO3 →600 M2O + 2NO2 + ½O2 қайэлементтің нитраты ыдырайды * Li * Na * K * Rb * Cs 69). Натрий ионынашуғақолданатын калий дигидроантимонатынқосқандақандайзатпайда болады * K2HSbO4 * K2Na2SbO4 * Na3SbO4 * NaH2SbO4 * Na2HSbO4 70). Калий иондарыжалындықайтүскебояйды * сары * ақ *көк * жасыл * күлгін 71). Қорғасын, барий тұздарыменуланғандаберетінжәнеішайдағышглаубертұзының формуласы * CaSO4•2H2O * CuSO4•5 H2O * MgSO4•7 H2O * FeSO4•7 H2O *Na2SO4•10H2O 72). Калий хроматы барий- ионыменсарытүстікристалдықтұңба, ал аммоний сульфаты –ақ түстітүңбабереді . Осы тұңбалардыңформулалары *BaCrO4, BaSO4 * BaCrO4, BaCO3 * BaSO4, BaCO3 * BaCrO4, Ba3(CrO3)2 * BaCO3 , Ba(CrO2)2 73). Ca(OH)2ериді * H2O * NaOH * HCl * KNO3 * KOH 74). Стенокардия ауруындатамырдыкеңітуүшіннатрийдіңқайтұзынқолданады * NaCl * NaNO2 *NaNO3 * Na2SO4 * Na3PO4 75). Суда аз еритінжәнеортакүштінегізқайэлементтіңгидроксиді * Na * Са * Mg * Sr * K 76). Сүйекте кальций иондарыныңсіңіруінежәнешығуынаәсерететіндәрумен * С *А *Д *В1 *В6 77). Қайметалдыңоксидіасқазанқышқылдығынтөмендетеді,қышықлдарменуланғанда ем ретіндепайдаланады , тісұнтағыныңқұрамынакіреді *Na2O *K2O *MgO *CaO *SiO2 78). Реакция орталығысілтілікжаққаығысуыаталады *ацидоз *алколоз *гидролиз *гомеостаз *нейтрализация 79). Сіркеқышқылыныңерітіндісіндесутекиондарыныңконцентрациясыныңесептеуге боладыформуламен 80). Кв = Сн+ . Сон- қалайаталады *жылдамдықконстантасы * диссоциацияланудәрежесі *тепе-теңдікконстантасы * диссоциациялануконстантасы *судыңиондықкөбейтіндісі 81). Кобальт атомыныңэлектрондықконфигурациясы *….3d74s2 82). Магниттітеміртасминералыныңформуласы * Fe3O4 * Fe2O3 * Fe2O3 ·n H2O * FeCO3 * FeS2 83). Сидерит минералыныңформуласы * Fe3O4 * Fe2O3 * Fe2O3 ·nH2O *FeCO3 * FeS2 84). Лимонит минералыныңформуласы * Fe3O4 * Fe2O3 *Fe2O3 ·nH2O * FeCO3 * FeS2 85). Темірпассивтенеді * Cl2 * O2 * HClсүйық * H2SO4 сүйық * H2SO4 конц 86). Темірконцентрлі H2SO4 ерігендетүзіледі * FeSO4 *Fe2(SO4)3 * FeS * Fe2S3 * H2S 87). Темір (II) иондарынқандаашуғақолданатын реагент * K3[Fe(CN)6] * H2SbO4 * Na3[Co(NO2)6] * NaOH * K4[Fe(CN)6] 88) . “Берлин көгі”-ніңформуласы *Сu2[Fe(CN)6] *Сa2[Fe(CN)6] *Fe4[Fe(CN)6]3 *K2Na[Co(NO2)6] *NaH2SbO4 89!“Турнбуль көгі ”-нің формуласы *Сu2[Fe(CN)6] *Сa2[Fe(CN)6] *K2Na[Co(NO2)6] *K4[Fe(CN)6] *+Fe3[Fe(CN)6]2 90!Темір (II) қосылысының қайсысы ауаға тұрақты *Fe(OH)2 *FeSO4 •7H2O *+(NH4)2SO4 •FeSO4 •6 H2O *K4[Fe(CN)6] *FeCl2 91!Темір (III) хлориді ерітіндісінен H2S жібергенде түзіледі * Fe2S3 *+FeS * SО2 *FeOHCl2 *FeOHCl 92FeCl3 тұзының гидролизін үлғайту үшін қосады * НCl *+NH4Cl * HBr * NaOH *HCN 93!Ең күшті гидролизденетін тұз *FeCl2 *FeCl3 *+NaFeO2 *Fe2(SO4)3 *Fe(NO3)3 94!Fe2O3 калий карбонатымен балқытқанда түзіледі *+KFeO2 *FeO *KOH *Fe(OH)3 *Fe(OH)2 95!Дезинфициялау және қан тоқтатқыш темір тұзы *FeSO4 •7H2O *феркован *фербитол *+FeCl3 • 6H2O *FeCO3 96!Витамина В12қай элементтіңкомплексі *Fe *Cu *Mg *+Co *Na 97!Кобальт (II) гидроксиді неде ерімейді *HCl *NH3 (eр) *NH4Cl(eр) *H2SO4 *+NaOH(cүйық) 98!Ең тұрақты комплексті ион * [Fe(CN)6]4- Kн=1*10-24 *[Co(NH3)6]2+ Kн=7*10-6 *[Co(NH3)6]3+ Kн=3*10-33 *+[Co(CN)6]3- Kн=1*10-64 *[Ni(CN)4]2- Kн=1*10-16 99Малахит минералының формуласы *+ CuCO3·Cu(OH)2 * Cu2O *Cu2S * CuFeS2 * СuCO3 100Неде мыс ерімейді * NaCN * HNO3 конц * NaOHконц * + NaOHразб * HNO3 разб 101). *! HNO3 (ω =65%) мыспен әрекеттескенде түзіледі * CuO * Cu2О * NO * NH3 *+ NO2 102) *! Күміс ауада қарайғанда қай зат түзіледі * Ag2S *+ Ag2O *AgO * Ag2CO3 * AgNO3 103) *!Аммиактың артық мөлшерін CuSO4 қосқанда түзіледі * (NH4)2SO4 * (NH4)2SO4•CuSO4 * Cu(OH)2 *+ [Cu(NH3)4]SO4 * NH4OH 104) *!Медицинада қолданатын антисептикалық және қуырғыш қасиеттері бар мыс тұзы *CuO * Cu(OH)2 *+ СuSO4 •5H2O * CuCO3 * CuCl2 105) *! Ең тұрақты комплексті ион * [Ag(NH3)2]+ * [AgCl2]- *+ [Ag(S2O3)2]3- * [AgBr2]- * [Ag(CN)2]- 106) *! Комплексті ионың[Cu(NH3)4]2+ кеңістіктегі пішіні * төрт бұрышты пирамида * + тетраэдр * октаэдр * квадрат * үшбұрышты призма 107) *!Қышқылдық қасиеті бар гидроксид * Cu(OH)2 * [CuOH] * [AgOH] *+Au(OH)3 * [Ag(NH3)2]OH 108) *!Металдық хром немен әрекеттеседі * H2O * HNO3 (конц) *+ HCl сүйық * H2SO4(конц) *NaСI 109) Натрийдің гексанитрокобальтаты (III) калий ионымен әрекеттескенде қандай тұңба түзіледі* Co(NO2)3* Na3[Co(NO2)6]* K3[Co(NO2)6]* + K2Na[Co(NO2)6] * KNO3 110) *!Аммоний оксалатын кальций тұзына қосқанда қандай тұңба түзіледі* CaCO3*+CaC2O4 * K3[Fe(CN)6]* Ca2[Fe(CN)6]* (NH4)2C2O4111). Барий мен қорғасыныңтұздарыменуланғанда «глаубертұзы» қолданылады, осы тұздыңформуласы * CaSO4·2H2O * CuSO4·5 H2O * MgSO4·7 H2O * FeSO4·7 H2O * Na2SO4·10H2O 112). Кальций хлоридінқабынуға, аллергияғажәнеіссіккеқарсызатретінде қолданады, оныңқандайқасиетіненегізделген * ішектесудыңсіңіруінтоқтатады * капилляр қабығыныңөткізгіштігінтөмендетеді * капилляр қабығыныңөткізгіштігінөсіреді * ішектенсудыңсіңіруінөсіреді * капилляр қабығыныңөткізгіштігінреттейді 113). Судыңтұрақтыкермектілігінберетінтұздар * KCl, NaCl * Ca(HCO3)2, Mg(HCO3)2 * CaSO4, MgSO4 , MgCl2 , CaCl2 * KNO3, NaNO3 CaCl2, MgCl2 114). “+3” тотығудәрежесіқайэлементкетән *хром *молибден *вольфрам *марганец *қорғасын 115). Металдық хром неменәрекеттеседі * H2O * HNO3 (конц) *HClсүйық * H2SO4(конц) * фосформен 116). Қышқылдыққасиеті бар оксиді * CrO * Cr2O3 * CrO3 * MnO2 * MnO 117). VIВ топ элементіқыздырғандахлорменәрекеттесіпқандайқосылыстытүзеді * CrCl2 *СrСl3 * СrCl5 * MoCl6 * WСl2 118). СrCl3 пен (NH4)2S ерітінділеріәрекеттескендетүзілетінқосылыс * Cr2S3 * CrOHCl2 * CrS * Сr2(SO4)3 * Сr(OH)3 119). Реакция схема бойыншажұреді : К2Cr2O7 + (NH)2S + H2O Реакция нәтижесіндетүзілетін хром қосылысы * CrO * Cr(OH)2 * Cr(OH)3 * Cr2O3 Н2CrO4 120). Таза марганецтіоксидтеріненалуүшінқолданатынтотықсыздандырғыш * Н2 * K * Si * H2S *HBr 121). Марганец қайқышқылдапассивтенеді * HCl * H2SO4 * HNO3 (холод) * CH3COOH * H2S 122). Марганец силициді *MnO *MnS * MnHal2 *Mn2P * Mn2Si 123). Суда жақсыеритін марганец(ІІ) тұзы *MnS *MnCO3 * Mn3(PO4)2 * MnSO4 *MnS2 124). KMnO4 қыздырғандатүзіледі * MnO *MnO2 * Mn2O3 * KMnO4 * Mn3O4 125). MnO2 мен K2CO3 пен KClO3 қоспаларынбалқытқандатүзілетін марганец қосылысы * K2MnO4 *MnO * K2MnO3 * KMnO4 * MnCO3 126). Жасылтүстімарганц ионы * [Mn(H2O)6] 2+ * [Mn(H2O)6] 3+ * MnO4 - * MnO4- * [Mn(CN)6]4- 127). Тек тотықсыздандырғышқасиеті бар марганец қосылысы * KMnO4 *K2MnO4 * MnO2 * Mn3O4 * MnO 128). Сілтілікортада KMnO4 тотықсызданғандамарганецтіңтотығудәрежесі * +2 * +3 * +4 *+6 * +7 129). Сутектотықсыздандырғышқасиетінкөрсететін реакция *Н2+Сl2 * Na+H2 * Ca+H2 * К+Н2 * Pt+H2 130). Қайреакцияда су молекуласытотықтырғышқасиеткөрсетеді * SO3 + H2O = H2SO4 * CaO + H2O = Ca(OH)2 * NH3 + H20 = NH4OH * NaH + H2O = NaOH + O2↑ * P2O5 + 3H2O = 2H3PO4 131). Түрлімикроорганизмдердентазартқан су қалайаталады * апирогенді * көмірқышқылды *темірлі * кұкіртті * избестасты 132). Сутекпероксидітотықсыздандырғышқасиеткөрсететін реакция * KMnO4+H2O2+H2SO4 суйық→ * KJ+H2O2+H2SO4 суйық→ * PbS+ H2O2→ * FeSO4 + H2O2+H2SO4суйық → * CoCl2+ H2O2+ NaOH → 133). Ағзадасутекпероксидініңыдырауынтездететін фермент * пероксидаза * цитохром * пепсин * гемоглобин *каталаза 134). Карбин мен графиттекөміртекатомдарықандайжағдайдаболады *sp - гибридизация мен sp2- гибридизация * sp2- гибридизацияменsp - гибридизация * sp3- гибридизация *sp2- гибридизация мен sp3- гибридизация *sp3– гибридизация менsp4- гибридизация 135). Кремнийдіңтолықеруіүшін ... қолдануғаболады * концентрлібалқытқышқышқылын * концентрлікүкіртқышқылын *патшаарағын *концентрлі азот және балқытқыш қышқылдарының қоспасын *хлорсутекқышқылын 136). Қыздырғанкездекөміртек (II) оксидікөптегенметаллдарменұшқышсұйықтықтүзеді, олар аталады * карбен * карбокатион * карбоанион *карбонил * карбид 137). Көміртекқышқылы – екінегізді; ол ... аталатын орта жәнеқышқылдытұздартүзеді карбид жәнегидрокарбид *карбонат және гидрокарбонат * карбонилжәнегидрокарбонил * карборунд жәнегидрокарборунд * карбид жәнегидрокарбид 138). Көміртекқышқылыныңтұздарынасапалықреакциялар *күштіқышқылдардыңәсері *сілтілерәсері *күміснитратыменәрекеттесуі * озонменәрекеттесуі *күмісайнареакциясы 139). Карбонаттарішіндесуғаеритін карбонат… *активтілікқатарындасутектенкейінгітұрғанметалдар *активтілікқатарындасутеккедейінгітұрғанметалдар *сілтілікметалдар мен аммоний *сілтілікжерметалдар * теміртопшасыныңметалдары 140). Сілтілікметалдардың гидрокарбонаты қыздырғанкезде *карбонаттар, көмірқышқыл газы мен суғаыдырайды *сілтілікметалдыңоксидіне, көміртек (II) оксиді мен суғаыдырайды * диспропорциялайды * балқыпсұйықкүйгеөтеді *көмірқышқыл газ бен суғаыдырайды 141). Көміртекқышқылдарыныңішіндегіпрактикалықмаңызызоры * глаубертұзы * бертолеттұзы *мыс (II)гидроксокарбонаты *сода * Мор тұзы 142). Кремний (IV)оксиді *түсі мен иісіжоқ газ тәріздізат *негіздік оксид *кремний қышқылыныңангидриді *қатты, өтеқиынбалқитынзат * амфотерлі оксид 143). Кремнезем ериді *тұзқышқылында *патшаарағында *суда *балқытқышқышқылда * азот қышқылында 144). Натрий мен калийдіңсиликаттарыныңконцентрліерітінділері … аталады *сұйықкристалдар * кристаллогидраттар *сұйықшыны *сұйықсабын *қаттысабын 145). Сілтілерсиланменқай реакция теңдеуіарқылыәрекеттеседі * SiH4 + 2KOH = SiO2 + 2KH + 2H2↑ *SiH4 + 2KOH +H2O = K2SiO3 + 4H2↑ *SiH4 + 4KOH = K4Si + 4H2↑+ 2O2↑ * SiH4 + 3KOH =K2SiO3 + KH + 2O2↑ * SiH4 + 3KOH =H2SiO3 + 3KH + H2↑ 146). Карбид пен силицидтерарасында карборунд SiCерекшеорыналады, себебі *жоғарытемпературадаериді *қаттылығы бойынша алмазға жақын * химиялықреакцияғақабілеттілігіөтежоғары *суда жақсыериді *тотықтырғышқасиеттергеие 147). Сілтілікметалдарыныңгидрокарбонаттарынқыздырғанда *карбонаттарға , көміртекгазына , суғаыдырайды *сілтілікметалдыңоксидіне, көміртек (II) газына , суғаыдырайды *диспропорцияланады *балқидысүйықзаттарға * көміртекгазынажәнесуғаыдырайды 148). Молярлықконцентрациясы 1моль/кГерітіндісініңқайнаутемпературасынесепте , егер судыңэбуллиоскопиялықтұрақтысы 0,52о тең *100оС *100,52оС *101,04оС *99,48оС *98,96оС 149). Рауль заңы * π = CRT *  *  *∆ Ткип=Е∙в * a = f∙C 150). Еріткіштіңқаныққанбукысымыныңерітіндібетіндегібуқысымыменсалыстырмалы төмендеуітәуәлді *ерігензаттыңтабиғатына * еріткіштіңтабиғатына * температураға * ерігензаттыңмольдікүлесіне * ерігензаттыңмолярлықконцентрациясына 151). Рауль заңыбойынша * Р (ерітінді) < Р (еріткіш) * Р (ерітінді ) > Р (еріткіш) * Р (ерітінді ) = Р (еріткіш) * Р (ерітінді ) / Р (еріткіш) * Р (ерітінді ) ∙ Р (еріткіш) 152). Электролиттерге қолданатын теңдеу * Ткрис=Кв *  * ∆Ткип=Ев * π= iCRT * a = fC 153). ТеңдеудеТкай=Е∙ b концентрацияныңөлшембірлігі * моль/л * г/100г (еріткіш) * г/1000 мл * г/1000 г (ерітінді) *моль/1000 г (еріткіш) 154). Комплек-ионында [Co(CN)4(H2O)2] - комплекс түзушыныңтотығудәрежесі *+4 *+5 *+3 *+6 +2 155). Нитрокомплекс *[Cd(NH3)4]CI2 *K[Al(OH)3H2O] *K2Na[Co(NO2)6] *[Pt(NH3)4][PtCI6] *[CoBr(NH3)5]SO4 156). Комплекстіңформуласын тап: сульфат пентаамминбромокобальта(III) формула *[CoBr(NH3)5]SO4 *[CoBr][(NH3)5] ∙SO4] *[Co(NH3)5]BrSO4 *(NH3)5[Co BrSO4] *Co[Br(NH3)5SO4] 157). Изохоралықпроцестежылыэффектісінанықтайтынформула * Qv=∆G - T∆S * Qv= U2-U1 * Qv=p∆V * Qv= р∆U+pV * Qp=∆H 158). Әртемпературадареакцияқандайжағдайдажүреді *∆H>0;∆S<0 *∆H>0; ∆S>0 *∆H<0;∆S * ∆G<0 * Qp˃∆H 159). Жабықтермодинамикалықжүйе *адам * өсімдік * суығантас * Әлем *ашықампуладағыерітінді 160). Жүйеніңмөлшерінетәуелсізтермодинамикалықпараметрлер * Т,Р * С,m * V,U * H,G *Р,V 161). Күштіқышқыл мен күштінегізәрекетескендебір моль су молекуласытүзілгенде шығатынжылумөлшеріқалайаталады *бір моль судыңтүзілужылуы * еру жылуы * ыдыраужылуы * жанужылуы *гидролиз жылуы 162). Энтропиясыөзгермейтін реакция (∆s=0) * N2+3Н2=2NНз * СаСОз=СаО+СО2 * Cu(OH)2=CuO+H20 * Сl2+H2= 2HCI *Н2О2→ Н2+1/2О2 163). Барлықберілгенфизикалықшамалартермодинамикалықфункцияларболатынжауаптытап * Т, р, S, G * U, Н, m, Т * S, G, Н, p * G, U, H, F * Т, m, H, G 164). Ионданудәрежесінесептеугеболадыформуламен * КС * СН+/ С *K/C * С / СН+ * СН+ / Сон165). Біріншісатымендиссоцияланады *балқытқышқышқыл * күкіртқышқылы * көміртекқышқылы * кремний қышқылы *фосфор қышқылы 166). СаСО3 тұнбаныңтүзілущарты * KS> [Ca2+][CO32-] * KS = [Ca2+][CO32-] * KS = [Ca2+] / [CO32-] * KS = [CO32-] / [Ca2+] * KS = [Ca2+] + [CO32-] 167).Қаныққан ерітінді *KS < [Ktn+]m[Am-]n; * KS > [Ktn+]m[Am-]n; * KS / [Ktn+]m[Am-]n; * KS = [Ktn+]m / [Am-]n * KS = [Ktn+]m + [Am-]n 168). Молярлықконцентрацияныесептейтінқатынастар *m(x) / m(p-p a)*100% *m(x)/ M(x)*V(p-p a) *  *  *  169).Ішкіинъекцияғақолданатынерітінділер *қаныкқан *гипертонды *гипотонды *физиологиялық * насыщенные 170). Затмөлшерінесептеугеболадықатынаспен *молярлықмассаныңзаттынмассасына *молярлықэквиваленттікмассыныңзаттыңмассасына *заттыңмассасыныңоныңмолярлықэквиваленттікмассасына *заттыңмассасынерітіндініңмассасына * молярной массы вещества к объему 171).Қанплазмасынаизотондыерітінділер *10%- дыNaCIерітіндісі *0,01% -дыNaCIерітіндісі *0,9%- дыNaCIерітіндіс *0,01 М NaCIерітіндісі *0,25%- ный раствор NaCI 172). Суда жақсыеритінзаттар * барии сульфаты * кальций силикаты *мыс сульфиді *натрий карбонаты * гидроксид алюминия 173). Кейбір заттар температура өскенсайынерігіштігінтөмендетеді, оларгажатады *Ca(OH)2 *KCI *NaNO3 *MgSO4∙6H2O *Na2SO4∙10H2O 174). Қатты заттар мен суйықтардан айырмашылығы газдардың еріуіне әсер етеді *температура *катализатор *газ қысымы *газдыңконцентрациясы *электролит 175). Жұйеге катализатор қосқандареакцияныңжылдамдығыныңөсуітүсіндіріледі * көлемніңтөмендеуімен * молекулалардың орта кинетикалықэнергиясыныңөсуімен * соқтығысудынкемуімен * активтімолекулаларсаныныңөсуімен * диссоциацией веществ 176). Пероксидтітобы бар молекула * PbO2 * BaO2 * MnO2 * K2S2O7 * К2О 177). Жасылөсімдіктеркүнніңәсеріненкөмірқышқылгазынжұтады,жүретін реакция * CO2 *6CO2 + 6H2O = C6H12O6 + 6O2↑ *CO2 + C CO2 + H2O = H2CO3 CO2 + H2 = HCOOH 178). Электр тоғынөткізбейтінерітінді [Сu (NH3)2]Cl [Cu(NH3)4]SO4 [Cu(NH2CН2СOO)2] [Cu(NH3)4]SO4 [Cu(NH3)4] (NO3)2 179). Монодентанты лигандалар C1- C2O42- H2N-CH2-CH2-NH2 O2- SO42- 180). Тотығу-тотықсыздану реакциялардыңжіктелуі *алмасу, ыдырау *молекулярлық, иондық, электрондық *молекулааралық *бейтараптану *косылу, орынбасу 181). Қай заттар тотығу да тотықсыздану да қасиеттерді қорсетеді *H2О, Li, HNO3 *F2, HF, HCIO *Na, Ne, O3 *HNO2, NO2, NO * KMnO4 , CO2 ,NaCI 182). VІтоп d-элементтерінің қай оксидтері суда ериді 183). Қышқылдық касиеттерібасымдыоксидтер * CrO Cr2O3 CrO3 MnO2 MnO 184). Сулыерітіндідетолықгидролизденетін хром тұзы СrCl3 CrPO4 Сr2S3 СrBr3 Сr2(SO4)3 185). Cr2O3-тен таза хромды алуғ қолданатын тотықсыздандырғыштар SO2 С H2S НВr SiO2 186). Суықконцентрліазот қышқылыменәрекетеспейтінметаллдар *Cr *Ag *Al *Zn *Cu 187). Концентрліазотқышқылындамысерігендетүзіледі *СuO *Cu(NO3)2 *NO *NH3 *HNO2 188). KMnO4қыздырғандатүзіледі *MnO *Mn2O3 *MnO2 *Mn3O4 *HMnO4 189). Мырышұнтағы өтесүйықазотқышқылындаерігендетүзіледі *NO *NH4NO3 *ZnO *H2 *NH3 190). ЖүЙЕДЕ: 2NO2 = 2NO(R) + O2(R) ТЕПЕ-ТЕҢДІК КЕЛЕСІ КОНЦЕНТРАЦИЯЛАРДА ОРНАДЫ: [NO2] = 0,01МОЛЬ/ЛЖӘНЕ [NO] = [O2]=0,02 МОЛЬ/Л. NO2БАСТАПҚЫКОНЦЕНТРАЦИЯСЫНЕСЕПТЕ *С (NO2) = 0,01 моль/л *Кт=8. *C(NO2) = 0,03 моль/л. *C(NO2) = 0,001 моль/л * Kp=0,4 191). Na2[Zn(OH)4] суда еріткендеқандайиондарға ыдырайды Na+, OH- Na+, Zn2+ Na+, Zn2+, OH- [Zn(OH)4]2- Zn2+, OH- 192). Хромның табиғи қосылыстары FeO NaCrO2 Na2CrO4 Cr2O3 CrO 193). Концентрациясы 0,1моль/л, ионизацияланудәрежесіα =0,001 болатынбірқышқылдыәлсізнегізертіндісініңионизациялануKb(моль/л) неге тең? 10-1 10-3 10-4 10-5 10-7 194). Никель(II) гидроксидіериді *HCI *NH3 ер *NH4CI *NaOHсүйық *NaCI 195). Мыс қандайметалдардытұздарынанығыстырады *Fe *Hg *Sn *Pb *Zn 196). Төмендекелтірілгензаттардыңқайсысыныңсулыерітіндісініңқатутемпературасыминимальдыболады,егер осы ерітінділердіңэквиваленттімолярлыконцентрацияларыбірдейболғанжағдайда? С6Н12О6 КNO3 Mg(NO3)2 Fe(NO3)3 Al2(SO4)3 197). Бейтарап ортаүшіндұрыс *[H+] = [OH-] *[H+] = 14 - [OH-] *[H+] < [OH-] *[H+] * [OH-] = 14 *[H+] >[OH-] 198). Калий хроматы барий ионынерітіндіденсарытүстікристалдықтұңбатүрінде, ал аммоний сульфаты – ақтүстітұңба, осы тұңбалардыңформулалары *BaCrO4, BaSO4 BaCrO4, BaCO3 BaSO4, BaCO3 BaCrO4, Ba3(CrO3)2 BaCO3 ,Ba(CrO2)2 199). Кобальт(II) гидроксидіериді *HCI *NH3 *NH4CI *NaOHсүйық *NaCI 200). * қышқылдыңэквиваленттікфакторын *негіздіңэквиваленттікфакторы *тұздыңэквиваленттікфакторын * қышқылдық-негіздікреакциясынақатысқанзаттыңэквиваленттікфакторын * тотығу-тотықсыздануреакциясынақатысқанзаттыңэквиваленттікфакторын |
