И спектрде жтылу жолаыны болуы
 Скачать 348.05 Kb. Скачать 348.05 Kb.
|
*ерігіштікті арттырады*+ерігіштікті кемітеді*ерігіштік максимум мәнге жетеді*ерігіштік минимум мәнге жетеді*ерігіштік өзгермейді #25*!АmBn жүйесі үшін тұнбаның түзілу жағдайы (I≠0):*[A]m[B]n ≤ KS *+[A]m[B]n ≥ KS *[A]m[B]n = KS *[A]m[B]n жүйесі Кs мәніне тәуелсіз *тәуелділік жоқ #26 *!Ерігіштік көбейтіндісі Кs мәнінің температураға тәуелділігі: *КS мәні температураға тәуелді емес.*температура жоғарылаған сайын Кs мәні артады.*+тұнба қасиеттеріне байланысты Кs мәні артады немесе кемиді. *температура жоғарылаған сайын Кs мәні төмендейді. *температура жоғарылаған сайын Кs мәні артады, соңынан төмендейді. #27 *!0,1 М KNO3 ерітіндісі қосылғаннан кейін барий сульфатының ерігіштігі *+артады *өзгермейді *төмендейді *бастапқы кезде артады содан кейін өзгермейді *бастапқы кезде төмендейді содан кейін өзгермейді #28 *!K2SO4 қосылғаннан кейін барий сульфатының ерігіштігі *артады *өзгермейді *+төмендейді *бастапқы кезде артады содан кейін өзгермейді *бастапқы кезде төмендейді содан кейін өзгермейді #29 *!Көлемдері бірдей 0,01 М PbCl2 мен 0,01 М K2SO4 ерітінділерін араластырғанда (Ks(PbSO4) = 1,6·10-8) *тұнба түзілмейді *+кристалды ақ тұнба түзіледі *аморфты сары тұнба түзіледі *біраз уақытқа қалдырғанда тұнба түзіледі *ыдыс қабырғасын таяқшамен үйкелеген кезде ғана тұнба түзіледі #30 *!Аттас иондардың нашар еритін қосылыстардың ерігіштігіне әсері *әсер етпейді *+ерігіштік төмендейді *ерігіштік артады *тұнба толық ериді *қанықпаған ерітінді түзіледі #31 *!Анықталатын ионды тұнбаға түсіру үшін қосатын тұндырғыш реагенттің көлемі *реакция теңдеуін теңестіргеннен кейінгі қажет мөлшерден кішкене аз алады *реакция теңдеуін теңестіргеннен кейінгі эквивалент мөлшерін *+1,5 есе артық *5 есе артық *өте көп мөлшерде #32 *!Нашар еритін қосылыстардың ерігіштігіне аттас емес иондардың әсері *+ерігіштік ұлғаяды *ерігіштік төмендейді *тұнба толық ериді *әсер етпейді *қаныққан ерітінді түзіледі #33 *!Тұнба түзілу шарты *ИК = Ks *+ИК > Ks *ИК < Ks *белгілі бір заңдылық жоқ *тұнба түзілмейді #34 *!Аса қаныққан ерітіндіде *ИК = Ks *+ИК > Ks *ИК < Ks *спирт қосылғанда *су қосылғанда #35 *!Қанықпаған ерітіндіде *ИК = Ks *+ИК < Ks *ИК > Ks *спирт қосылғанда *қышқыл қосылғанда *!HA + S ↔ HS+ + A-реакцияның нағыз қышқылдық тұрақтысы: *KHAS = [HS+] + [A-]/[HA] + [S] *KHAS = [HS+] [A-]/[H+] +[S-] *+KHAS = [HS+] [A-]/[HA] [S] *KHAS = [H+] [A-]/[HA] [S-] *KHAS = [H+] [A-]/[HA] #2 *!Тепе-тең аналитикалық реакция үшін mA + nB ↔ pC + qD термодинамикалық тепе-теңдік константасының формуласы: *+KT = aCp ∙ aDq / aAm ∙ aBn *KT = aDp ∙ aCq / aAm ∙ aBn *KT = aCp ∙ aDq / aAm + aBn *KT = aAm ∙ aBn / aCp ∙ aDq *KT = aCp + aDq / aAm ∙ aBn #3*!Химиялық реакцияның нақты жылдамдығы*K = K1/K2*+v = dC/dt *α = f ∙ C *α = Cдис / Cобщ * f = α /C #4*!Тепе-теңдік константасын анықтайтын өрнек:*KW = 1.0 ∙ 1014 *+K = K1/K2 *[H2O] = CH2O *a=C *a = f ∙ C #5 *!Активтік коэффициентті есептейтін формула: *I = 1/2∑CiZi2 *K = K1 / K2 *+ f = α / C *α = Cдисс/Cобщ *m = Clim ∙ Vmin ∙ 106 #6 *!0,1н NH4OH ерітіндінің (KNH4OH = 10-5) OH- ионының концетрациясы *10-1 *10-2 *+10-3 *10-4 *10-5 #7 *!0,1н NH4OH ерітіндінің (KNH4OH = 10-5) диссоциация дәрежесі *10-1 *+10-2 *10-3 *10-4 *10-5 #8 *!Концентрациясы 0,01 моль/л CaCl2 ерітіндісінің иондық күші *0,03 *0,06 *0,6 *0,3 *+0,006 #9 *!0,1М әлсіз бірнегізді қышқылдың сутегі ионының концентрациясы 10-5 моль/л. Қышқылдың диссоциация константасы тең *1∙10-1 *1∙10-5 81∙10-6 *1∙10-10 *1∙10-9 #10 *!Иондық күшті есептейтін формула: *+I = 1/2∑CiZi2 *K = K1 / K2 *f = α / C *α = Cдисс/Cобщ E) m = Clim ∙ Vmin ∙ 106 #11 *!mA + nB ↔ pC + qD тепе-теңдіктегі реакциясы үшін концентрациялық және термодинамикалық константалар арасындағы байланыс *+KT = KC ∙ fCp ∙ fDq / fAm ∙ fBn *KT = KC ∙ fCq ∙ fDp / fAn ∙ fBm *KT = KC ∙ fCp ∙ fDq / fAm + fBn *KC = KT ∙ fCp ∙ fDq / fAm ∙ fBn *KT = KC ∙ fCp + fDq / fAm ∙ fBn #12 *!Концентрациясы 0,005 моль/л барий нитратының иондық күші: *0,00015*0,0015 *+0,015 *0,15 *1,5 #13 *!Ерітіндінің иондық күшін есептейтін формула *∑CiZi *1/2∑CiZi *1/2∑Ci2Zi *∑CiZi2 *+1/2∑CiZi2 #14 *!Эквивалентінің молярлық концентрациясы 0,1 моль/л хлорсутек қышқылы ерітіндісінің иондық күші: *+0,1 *0,2 *0,3 *0,4 *0,5 #15 *!Концентрациясы 0,1 моль/л, активтілік коэффициенті 0,51 тең болатын ионның активтілігі: *5,100 *0,510 *+0,051 *0,1960 *0,019 #16 *!0,05 М тұз қышқылы ерітіндісінің иондық күші: *0,5 *0,1 *+0,05 *0,01 *0,005 #17 *!0,1 М күкірт қышқылы ерітіндісінің иондық күші: *0,1 *0,2 *+0,3 *0,4 *0,5 #18 *!AB2 тұздың ерігіштігі 1∙10-3 моль/л, KS мәні тең *1∙10-3 *+4∙10-9 *2∙10-6 *3∙10-6 *4∙10-6 #19 *!A2B3 тұзының ерігіштік көбейтіндісі 1,08∙10-23. Ерігіштік неге тең (моль/л) *2∙10-23 *+1∙10-5 *1∙10-3 *1∙10-7 *1∙10-18 #20 *!Ag+, Pb2+, Ca2+, Ba2+ иондары бар ерітіндіге K2C2O4 ерітіндісін қосқан кезде тұнбалардың түзілу реті (Ks(Ag2C2O4) = 3,5·10-11; Ks(PbC2O4) = 4,8·10-10; Ks(CaC2O4) = 2,3·10-9; Ks(BaC2O4) = 1,1·10-7): *PbC2O4, BaC2O4, Ag2C2O4, CaC2O4 *+PbC2O4, Ag2C2O4, BaC2O4, CaC2O4 *CaC2O4, Ag2C2O4, BaC2O4, PbC2O4 *Тұнбаның түзілу реті Ks мәніне тәуелсіз *PbC2O4, CaC2O4, Ag2C2O4, BaC2O4 #21 *!Кальций және барий хлоридтерін Na2SO4 және Na2CO3 ерітінділерімен өңдеген кезде түзілген тұнбаның құрамы (Ks(BaCO3) = 5,1·10-9; Ks(BaSO4) = 1,1·10-10; Ks(CaCO3) = 4,8·10-9; Ks(CaSO4) = 9,1·10-6): *+BaSO4 + CaCO3 *BaSO4 + CaSO4 *BaCO3 + CaCO3 *BaCO3 + CaSO4 *BaSO4 + CaCl2 #22 *!Солдан оңға қарай бағытта жүретін реакция (Ks(PbCl2) = 1,6·10-5; Ks(AgCl) = 1,78·10-10; Ks(AgJ) = 8,3·10-17, Ks(PbJ2) = 1,1·10-9): *PbCl2 + 2AgJ → 2AgCl + PbJ2 *+PbCl2 + 2AgNO3 → Pb(NO3)2 + 2AgCl *AgJ + KCl → AgCl + KJ *Pb(NO3) 2 + 2AgJ → PbJ2 + 2AgNO3 *2AgCl + Pb(NO3) 2 → PbCl2 + 2AgNO3 #23 *!Ерігіштік көбейтіндісі Ks(AgCl) = 10-10 тең болатын AgCl ерігіштігі (моль/л): *10-10 *10-7 *+10-5 *10-3 *1 #24 *!Ерігіштігі S(Ag2CrO4) = 5·10-5 моль/л тең болатын Ag2CrO4 ерігіштік көбейтіндісі: *5·10-15 *1·10-15 *+5·10-13 *1·10-10 *5·10-5 #25 *!Ерігіштігі S(Mg(OH)2) = 5·10-5 моль/л тең болатын Mg(OH)2 ерігіштік көбейтіндісі: *+5·10-10 *5·10-8 *1·10-7 *5·10-4 *2,5·10-2 #26 *!Ерігіштік көбейтіндісі Ks(PbJ2) = 4·10-9 тең болатын PbJ2 ерігіштігі (моль/л): *4·10-9 *10-9 *10-6 *+10-3 *10-1 #27 *!Ерігіштік көбейтіндісі KS(BaSO4) = 1∙10-10 тең болатын 0,01М Na2SO4 ерітіндідегі BaSO4 тұнбасының ерігіштігі *10-10 *+10-8 *10-5 *10-3 *10-2 #28 *!Қорғасын концентрациясы ең көп болатын тұздың ерітіндісі: *+Ks(PbMoO4) = 4,0·10-6 *Ks(PbSO4) = 1,6·10-8 *Ks(PbS) = 2,5·10-27 *Ks(PbCO3) = 7,5·10-14 *Ks(PbCrO4) = 1,8·10-14 #29 *!Ерігіштік көбейтіндісін есептейтін формула: *KW = [H+][OH-] *I = 1/2∑CiZi2 *m = Clim ∙ Vmin ∙ 106 *+KS = [A] m[B]n *KS = [A] m + [B]n #30 *!Нашар еритін хромат: *Ks(Ag2CrO4) = 1,1·10-12 *Ks(BaCrO4) = 1,2·10-10 *+Ks(PbCrO4) = 1,8·10-14 *Ks(SrCrO4) = 3,6·10-5 *Ks(CaCrO4) = 7,1·10-4 #31 *!Концентрациялары 0,01 моль/л Cl- және I- иондары бар ерітіндіге 0,01 моль/л AgNO3 ерітіндісімен әсер еткенде бірінші тұнбаға түседі (Ks(AgCl) = 1,78·10-10; Ks(AgJ) = 8,3·10-17): *AgCl *+AgJ *AgCl және AgJ бірге түседі *екі тұз да тұнбаға түспейді *қос тұз түрінде тұнбаға түседі #32 *!Концентрациялары бірдей KCl және K2CrO4 ерітінділеріне AgNO3 тамшылатып қосқан кезде, бірінші тұнбаға түседі (Ks(AgCl) = 1·10-10; Ks(Ag2CrO4) = 1·10-12): *Ag2CrO4 *+AgCl *тұнба түзілмейді *екі тұз бірге түзіледі *қос тұз түрінде тұнбаға түседі #33 *!Қаныққан кальций карбонаты ерітіндісінде 0,0069 г тұз бар. Кальций карбонатының ерігіштік көбейтіндісі Кs неге тең *2,3·10-8 *7,5·10-3 *+4,8·10-7 *1,1·10-5 *6,5·10-7 #34 *!Темірді (III) гидроксид түрінде тұндыру үшін қолданылатын тұндырушы реагент *+NH4OH *KOH *Ca(OH)2 *H2O *H2SO4 #35 *!Күміс ионын тұндыру үшін қолданылатын тұндырушы реагент *+Ag2S, ЕК=1,610-49 *AgCI, ЕК=1,610-10 *Ag3PO4, ЕК =1,810-18 *Ag2C2O4; ЕК=1,610-11 *AgBr, ЕК =7,710-13 3 *!Негіздік буфер жүйесін 100 есе сұйылтқанда рН мәні қалай өзгереді *10 есе артады *2 есе артады *+өзгермейді *2 есе кемиді *10 есе кемиді #2 *!Қышқылдық буфер жүйесін 10 есе сұйылтқанда рН мәні қалай өзгереді *10 есе артады *2 есе артады *+өзгермейді *2 есе кемиді *10 есе кемиді #3 *!HCl ерітіндісін 100 есе сумен сұйылтқанда рН мәні қалай өзгереді *5 есе артады *+2-ге артады *Өзгермейді *2 есе кемиді *2-ге кемиді #4 *!CH3COOH және CH3COONa қоспасы *аммоний буфері*гемоглобин буфері *оксигемоглобин буфері *+ацетат буфері *фосфат буфері #5 *!NaH2PO4 және Na2HPO4 қоспасы *аммоний буфері*гемоглобин буфері *оксигемоглобин буфері *ацетат буфері *+фосфат буфері #6 *!NH4OH және NH4Cl қоспасы *+аммоний буфері*гемоглобин буфері *оксигемоглобин буфері *ацетат буфері *фосфат буфері #7 *!HHbO2 және KHbO2 қоспасы *аммоний буфері*гемоглобин буфері *+оксигемоглобин буфері *ацетат буфері *фосфат буфері #8 *!HHb және KHb қоспасы *аммоний буфері*+гемоглобин буфері *оксигемоглобин буфері *ацетат буфері *фосфат буфері #9 *!Бренстед-Лоури протолиттік теориясы бойынша сулы ерітінділердегі қышқыл: *+HClO4 *NH3жидк. *СO32- *S2- *P2O72- #10 *!Амфолит болып табылады *NH4+ *+H2O *H3O+ *Cl- *HCOOH #11 *!Бренстед-Лоури протолиттік теориясы бойынша қышқыл дегеніміз *Суда ерігенде H+ ионын бөліп диссоциацияланатын электробейтарап қосылыстар *Басқа атомның бос электрон жұбын пайдаланып, электрондық топтасудан кейін тұрақты атомдар түзетін қосылыстар *Катионды бөліп шығаруға қабілетті бөлшек – протон, анионды бөліп шығаруға қабілетті бөлшек – электрон *Протонын беруге қабілетті бөлшек *Сутегін еріткіштердің құрамындағы металл немесе электробейтарап бөлшектермен алмастырғанда түзілетін жаңа қосылыстар #12 *!Бренстед-Лоури протолиттік теориясы бойынша негіз дегеніміз *+Протонды қосып алуға қабілетті бөлшек *Сутегін еріткіштердің құрамындағы металл немесе радикал бөлшектермен алмастырғанда түзілетін жаңа қосылыстар *Суда ерігенде OH- ионын бөліп диссоциацияланатын электробейтарап қосылыстар *Анионды бөліп шығаруға қабілетті бөлшек – электрон, катионды бөліп шығаруға қабілетті бөлшек – протон *Басқа атомның бос электрон жұбын пайдаланып, электрондық топтасудан кейін тұрақты атомдар түзетін қосылыстар #13 *!COH- = 10-13 болғанда, ерітінді ортасы *cілтілік *әлсіз сілтілік *бейтарап *әлсіз қышқылдық *+күшті қышқылдық #14 *!25 °С температурадағы судың иондық көбейтіндісі *+1·10-14 *1·1014 *1·10-7 *1·10+7 *14 #15 *!Буферлік сыйымдылық сақталатын шек *pH = pK *pH = pK + 5 *+pH = pK 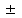 1 1*pH = pK - 5 *pH = pK - 4 |
