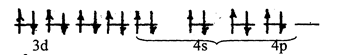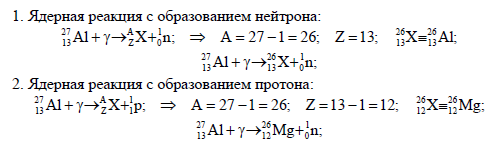Cм̊(N2)=0,049; Cм̊(О2)=0,01.Определите концентрации
реагентов в момент,когда в реакционном
пространстве накопилось 0,005 моль/литр продукта этой
реакции.
Решение:
C(N2)=0,049-0,005/2=0,0465моль/л;
C(O2)=0,01-0,005/2=0,0075моль/л
Ответ:C(N2)=0,0465моль/л;
C(O2)=0,0075моль/л.
Условия смещения химического равновесия
Химическим равновесием называется такое состояние химической системы, при котором количества исходных веществ и продуктов не меняются со временем.
Способность равновесных систем «сопротивляться» внешним воздействиям носит общий характер и известна под названием принципа Ле Шателье:
Если на равновесную систему воздействовать извне, изменяя какой-нибудь из факторов, определяющих положение равновесия, то в системе усилится то направление процесса, которое ослабляет это воздействие.
В-19.Установите направление смещения равновесия в
Системе,в которой протекает реакция:
NH4Cl<=>NH3+HCl,
Если давление понизить в 4 раза и одновременно повысить
Температуру на 40̊С.Температурные коэффициенты прямой
и обратной реакции равны соответственно 2 и 3.
Решение:
Данная реакция эндотермическая, поэтому при повышении температуры на каждые 10 град, скорость химической реакции увеличивается в 2 раза, а если температуру повысить на 40 град, то скорость прямой р-и увеличится в 2^4=16 раз, реакция проходит с увеличением объема продуктов реакции, поэтому при снижении давления в 4 раза скорость прямой реакции увеличится в 4 раза. В итоге с учетом повышения давления в 4 раза и повышением температуры на 40 град. скорость прямой реакции увеличится в 64 раз (4*16).
Г. Теория растворов
Концентрация раствора, растворимость, тепловой эффект при растворении
«ПОНЯТИЕ «РАСТВОР». ХИМИЧЕСКАЯ ТЕОРИЯ РАСТВОРОВ»
Растворы имеют важное значение в жизни и практической деятельности человека. Растворами являются все важнейшие физиологические жидкости (кровь, лимфа и т.д.). Организм – сложная химическая система, и подавляющее большинство химических реакций в организме происходит в водных растворах. Именно по этой причине человеческий организм на 70 % состоит из воды, а сильное обезвоживание организма наступает быстро и является очень опасным состоянием.
Многие технологические процессы, например получение соды или азотной кислоты, выделение и очистка редких металлов, отбеливание и окрашивание тканей, протекают в растворах.
Растворение - это физико-химический процесс. При физическом явлении разрушается кристаллическая решетка и происходит диффузия молекул растворенного вещества. При химическом явлении в процессе растворения молекулы растворенного вещества реагируют с молекулами растворителя.
Количественной характеристикой соотношения компонентов насыщенного раствора является растворимость. Наиболее распространенными способами такой характеристики служат:
· коэффициент растворимости вещества (Р) – наибольшая масса вещества, способная при данной температуре раствориться в 100 г растворителя. Например, при 20ْ С в 100 г воды с образованием насыщенного раствора растворяется 36,0 г NaCI, значит Р(NaCI) = 36.
Массовая доля (W) или процентная концентрация - отношение массы растворенного вещества к массе раствора. Массовая доля – безразмерная величина, ее выражают в долях от единицы в процентах (10%). Массовая доля показывает, сколько граммов данного вещества, находится в 100 г раствора.
Молярная концентрация (молярность) См (моль/л) – показывает число молей растворенного вещества в одном литре раствора, выражается отношением количества растворенного вещества к объему раствора.
Моляльная концентрация (моляльность Сm) - отношение количества растворенного вещества к массе растворителя, выраженой в килограммах.
Процесс растворения сопровождается выделением или поглощением теплоты. Эту теплоту, отнесенную к одному молю вещества, называют тепловым эффектом растворения, Qp.
Общий тепловой эффект растворения зависит от тепловых эффектов:
а) разрушения кристаллической решетки (процесс всегда идет с затратой энергии — Q1);
б) диффузии растворенного вещества в растворителе (затрата энергии - Q2)
в) гидратации (выделение теплоты, +Q3, так как гидраты образуются за счет возникновения непрочной химической связи, что всегда сопровождается выделением энергии).
Общий тепловой эффект растворения Qp будет равен сумме названных тепловых эффектов.
Г-4.Плотность раствора натрия карбоната Na2CO3 равна
1,102 г/см3. Из 4 л этого раствора при действии соляной
Кислоты HCl получено 66,6 л диоксида углерода CO2
(объем газа измерен при н.у.).Вычислите массовую долю
Na2CO3 в растворе.
Решение:
1 моль Na2CO3 + 2HCl = 2NaCl + 1 моль CO2 + H2O;
n= 66,6л / 22,4 л/моль= 2,97 моль – получено оксида углерода (IV);
Значит в реакцию вступило 2,97 моль карбоната натрия m(Na2CO3)=2,97 моль х 106 г/моль = 314,8 г карбоната натрия, которое содержится в 4 л раствора m= 4л х 1102 г/л = 4406 г масса 4 л раствора;
ω =314,8 х 100 / 4406 = 7,14%
Ответ:массовая доля карбоната натрия в растворе равна
7.14%.
Общие свойства растворов
Растворами называют однородные системы, состоящие из двух или нескольких компонентов, состав которых можно изменять в определенных пределах без нарушения однородности.
Раствор это не механическая смесь, поскольку при растворении наблюдаются объемные и энергетические эффекты.
Раствор отличается от механической смеси гомогенностью, а от химического соединения:
a) переменным составом – от нуля до предела насыщения;
б) тем, что изменение свойств растворителя и растворённого вещества не носит радикальный характер.
Растворение – это самопроизвольный процесс, заключающийся во взаимодействии растворенного вещества с молекулами растворителя. Точка зрения Д. И. Менделеева:
раствор - это сложная равновесная химическая система, образованная растворителем, растворенным веществом и продуктами их взаимодействия.
Различают истинные и коллоидные растворы.
Истинные растворы - размер частиц
10-10…10-11 м, т.е. атомы или молекулы.
Коллоидные растворы - размер частиц
10-8… 5×10-10 м
Растворы бывают:
1) газообразные: газ-газ;
2) жидкие: газ-жидкость,
жидкость-жидкость,
твердое вещество – жидкость;
3) твердые: газ - твердое вещество,
твердое вещество - твердое вещество.
Жидкие растворы могут быть водные и неводные. Водные растворы – это растворы, в которых растворителем является вода.
Твёрдым раствором называется кристалл, кристаллическая решётка которого состоит из двух или более компонентов.
Растворы делятся на электролиты и неэлектролиты. Вещества, которые в растворе или расплаве полностью или частично распадаются на ионы и проводят электрический ток, называются электролитами.
Идеальным называется раствор, в котором не происходит химической реакции между компонентами, а силы межмолекулярного взаимодействия между взаимодействующими компонентами одинаковы.
Общие (коллигативные) свойства растворов те, которые не зависят от природы растворённых веществ, а зависит от количества растворенного вещества.
Закон Рауля:
Понижение давления насыщенного пара растворителя над раствором пропорционально мольной доле растворённого нелетучего вещества:
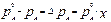 , ,
где 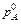 и и 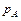 – давление насыщенного пара растворителя над чистым растворителем и над раствором, Па; – давление насыщенного пара растворителя над чистым растворителем и над раствором, Па;
х – мольная доля.
Первое следствие из закона Рауля:повышение температуры кипения DТкип пропорционально моляльной концентрации раствора:
DТкип= Кэ×Сm ,
где Кэ – эбулископическая постоянная растворителя,
Сm – моляльная концентрация, моль/1000 г .
Второе следствие из закона Рауля:понижение температуры замерзания DТзам пропорционально моляльной концентрации раствора:
DТкип=Кк×Сm ,
где Кк – криоскопическая постоянная.
Кк и Кэ – зависят от природы растворителя:

где DНкип – удельная теплота испарения, 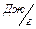 ; ;
Ткип – температура кипения чистого растворителя, К;
R – газовая постоянная,  . .
 , ,
где DНкриc. – удельная теплота кристаллизации,  ; ;
Ткрит. – температура кристаллизации чистого растворителя, К.
Г.11.В радиатор объемом 10 литров поместили равные
Объемы воды и метилового спирта CH3OH(плотность
Спирта ρ=0,8 г/см3 ).Определите температуру
Замерзания полученного антифриза.
Решение:
^t = Cm*K .
m (CH3OH) = p*V = 0.8*5000 = 4000 г;
n = m/M = 4000/ 32 = 125 моль;
Cm = 125/5 = 25 моль/кг;
^t = 25*1.86 = 46.5 град.;
Tзам . = -46,5 град .
Ответ:температура замерзания полученного антифриза
Равна -46,5 грамм
Водородный показатель и произведение растворимости
Растворение твердых электролитов прекращается, когда образуется насыщенный раствор, в котором устанавливается гетерогенное равновесие между твердой фазой и перешедшими в раствор ионами.
В выражение константы гетерогенного равновесия не входит концентрация твердой фазы :
K= [Ca2+][SO42–]
В насыщенном растворе твердого электролита произведение концентраций его ионов есть величина постоянная при данной температуре. Она называется произведением растворимости.
ПР(CaSO4) = [Ca2+][SO42–]
В кислых растворах больше концентрация ионов водорода, в щелочных – концентрация ионов OH–. Однако произведение этих молярных концентраций всегда остается постоянным. Если, например, к чистой воде добавить столько кислоты, чтобы концентрация ионов водорода повысилась до 10–3 моль/л, то концентрация гидроксид-ионов станет равной 10–11 моль/л. Следовательно, если известна величина [H+], то однозначно определяется величина [OH–]. Поэтому степень кислотности или щелочности раствора можно количественно охарактеризовать концентрацией ионов водорода:
Нейтральный раствор [H+]=10–7 моль/л;
кислый раствор [H+]>10–7 моль/л;
щелочной раствор [H+]<10–7 моль/л.
Наиболее часто используют не концентрацию [H+], а ее десятичный логарифм, взятый с обратным знаком:
pH= –lg [H+]
Эта величина называется водородным показателем. Например, если [H+]=10–5 моль/л, то pH=5; если [H+]=10–9 моль/л, то pH=9. Отсюда следует, что в нейтральном растворе pH=7, в кислом растворе pH<7, в щелочном растворе pH>7. Иногда пользуются значением гидроксидного показателя pOH= –lg[OH–]. При 25°С выполняется равенство: pH+pOH=14.
Для многих процессов величина pH очень важна (для жизнедеятельности растений и животных их активность, сильно зависят от pH.
Г.25.Рассчитайте водородный показатель раствора,
Содержащего в 1000 г воды 0,37 г соляной кислоты
HCl, 0,12г натрия хлорида NaCl и 0,29 г натрия
сульфата
Na2SO4.
Решение:
HCl ⇄ Н + Cl - сильный электролит;
Рассчитаем молярные концентрации электролитов :
C(HCl)=0,01 моль/л;
C(NaCl)=0,002 моль/л;
C(Na2SO4)=0,002моль/л
По уравнению диссоциации вычислим, сколько моль ионов водорода H+ образуется при полной диссоциации 0,01 моль соляной кислоты (HCl):
при диссоциации 1 моль HCl образуется ионов H+
при диссоциации 0,1 моль HCl образуется х ионов H+
Откуда:
1/1=0,01/х, х=1∙0,01/1=0,01(моль);
Следовательно, концентрация ионов водорода равна:
[H+]=0,01=10-2(моль/л);
Вычислим pH раствора по формуле:
pH=-lg[H+];
Водородный показатель (pH) раствора численно равен отрицательному десятичному логарифму концентрации ионов водорода в этом растворе.
получаем:
pH=-lg[10-2]=2
Ионной силой называют полусумму произведений молярных концентраций всех присутствующих в растворе ионов на квадраты их зарядов:
I=0,5∑Cm,ez2i ;
Где:
I – ионная сила раствора;
Cm,i – молярная концентрация i-го иона;
zi – заряд i-го иона.
Определите pH раствора Запишем уравнение диссоциации раствора хлорида натрия (NaCl):
NaCl=Na+ + Cl-;
Определите pH раствора Запишем уравнение диссоциации раствора Na2SO4:
Na2SO4=2Na++ SO42-
Находим ионную силу раствора:
I=0,5(0,01+0,01+0,002+0,002+0,004+0,008)=0,036;
Определяем коэффициент активности и активность ионов оксония:
f(H3O+) = 0,860( табл.)
a(H3O+) = C(H3O+) f(H3O+) = 0,010•0,860 = 8,6•10-3 моль/л.
Рассчитаем рН раствора:
рH = - lg a(H3O+) = - lg 8,6•10-3 = 2,07
Ответ: а(Н3О+) = 8,6•10-3 моль/л ; рН = 2,07.
Ионно-молекулярные (ионные) реакции обмена, гидролиз, буферные системы
Реакции ионного обмена – это реакции между сложными веществами в растворах, в результате которых реагирующие вещества обмениваются своими составными частями.
Правила составления ионных уравнений реакций:
1. Нерастворимые в воде соединения (простые вещества, оксиды, некоторые кислоты, основания и соли) не диссоциируют.
2. В реакциях используют растворы веществ, поэтому даже малорастворимые вещества находятся в растворах в виде ионов.
3. Если малорастворимое вещество образуется в результате реакции, то при записи ионного уравнения его считают нерастворимым.
4. Сумма электрических зарядов ионов в левой и в правой части уравнения должна быть одинаковой.
Гидролиз - это химическая реакция ионного обмена между водой и растворённым в ней веществом с образованием слабого электролита. (В общем случае обменное взаимодействие растворённого вещества с растворителем носит название - сольволиз).
В большинстве случаев гидролиз сопровождается изменением pH раствора.
Большинство реакций гидролиза - обратимы:
Pb(NO3)2 + H2O « Pb(OH)(NO3) + HNO3
Na2HPO4 + H2O « NaH2PO4 + NaOH
Некоторые реакции гидролиза протекают необратимо:
Al2S3 + 6H2O « 2Al(OH)3¯ + 3H2S
Причиной гидролиза является взаимодействие ионов соли с молекулами воды из гидратной оболочки с образованием малодиссоциированных соединений или ионов.
Способность солей подвергаться гидролизу зависит от двух факторов:
1) свойств ионов, образующих соль;
2) внешних факторов.
Буферная система - это система, способная поддерживать постоянное значение рН при разбавлении её водой и при добавлении в неё определённых небольших количеств сильных кислот и оснований.
По составу буферные системы делят на 3 типа:
1) кислотные;
2) основные
3) амфолитные
Кислотные буферные системы - это системы, состоящие из слабой кислоты и соли этой же кислоты, анион которой выполняет роль сопряжённого с ней основания.
Основная буферная система состоит из слабого основания и соли этого основания, катион которого выполняет роль сопряжённой с ним кислоты.
Амфолитная буферная система - это система, образованная амфотерным соединением, т.е. соединением, для которого характерны свойства и кислоты и основания одновременно.
Г 35.Составьте по два молекулярных уравнения реакций,
Для которых сокращенное ионно-молекулярное
Уравнение имеет вид:
а)HCO3- + H+= CO2+H2O;
б)Al(OH)3+OH- AlO2 - + 2H2O;
в)Fe(OH)3+H+ Fe(OH)2+ + H2O;
г)Mg 2+ + C2O42- =>MgC2O4
Решение:
a)NaHCO3 + HNO3=> NaNO3+H2O+CO2↑;
б)Al(OH)3+NaOH=>NaAlO2+2H2O
Д. Дисперсные системы и коллоидные растворы
Дисперсные частицы можно получить либо дроблением крупных частиц, либо объединением мелких частиц (молекул, атомов или ионов) в более крупные агрегаты. Первый метод называется диспергированием, а второй конденсацией.
К методам получения дисперсных систем методом конденсации относятся конденсация паров в газовой фазе; конденсация паров при пропускании их через холодную жидкость; замена растворителя; а также химические методы, когда дисперсные системы образуются при получении малорастворимых соединений в результате химических реакций, проведенных в определенных условиях, когда вместо осадка получается дисперсная система. Дисперсные системы являются гетерогенными системами. Они состоят из сплошной непрерывной фазы – дисперсионной среды и находящихся в этой среде раздробленных частиц различного размера и формы – дисперсной фазы.
Дисперсные системы классифицируют по дисперсности (степенью дисперсности называется величина, обратная размеру частицы) на грубодисперсные системы (с размерами частиц от 1 до 10-2 см) и коллоидные растворы (с размерами частиц от 10-2 до 10-7 см). Частицы грубодисперсных систем различимы в обычный микроскоп, задерживаются бумажным фильтром и расслаиваются при стоянии. Частицы коллоидных растворов проходят через бумажный фильтр, невидимы в обычный микроскоп и не изменяются при стоянии.
Д.3.Вычислить суммарную поверхность 1 г платины,
Раздробленной на правильные кубики с длиной ребра
1∙10-8 м. Плотность платины 21,4 г/см 3
Решение:
1∙10-8 м=1∙103 см
Вычислим объем одной частицы:
V1=l3 =(103 )3 = 10 9 cм3;
Определим объем 1 г платины :
Vpt=mpt / ppt = 1/21,4=0,04673cм3 ;
Считаем площадь поверхности одной частицы:
S1=6∙l=6∙10 3 cм2;
Считаем число коллоидных частиц:
N=Vpt/V1=0,04673/109 = 4,67∙10-11 ;
Расчитаем суммарную поверхность:
S=S1∙N=6∙103 ∙ 4,67∙10-11 = 0,28∙10-6 см2
Ответ: суммарная поверхность 1 г платины
Равна 0,28∙10-6 см2.
Д.18.Определите ,в каком порядке необходимо сливать
Следующие пары растворов ,чтобы получить
Коллоидные системы с частицами ,несущими
:а)положительные электрические заряды;
Б)отрицательные электрические заряды.
Напишите уравнения реакций получения
Нерастворимой фазы и формулы мицелл,
Образующихся золей:
А)мышьяковистая кислота H2AsO2 и сульфид аммония
(NH4)2S;
Б)хлорид кадмия(2) CdCl2 и натрия сульфид Na2S;
В)мышьяковая кислота H2AsO4 и сульфид аммония (NH4)2S;
Г)нитрат серебра AgNO3 и йодид магния MgI2.
Решение:
Чтобы получить положит. коллоид. частицы, нужно, чтобы на поверхности монокристаллов образующихся в реакции труднорастворимых вещ-в адсорбировались находящиеся в р-ре положительные ионы. На поверхности монокристалла могут абсорбироваться только ионы, из кот. состоит кристалл. Следовательно, катионы, образующие труднорастворимые кристаллы (агрегаты) должны быть в избытке, тогда они смогут стать потенциалоопределяющими (ПОИ). Поэтому к р-ру, содержащему ПОИ-катионы, следует медленно приливать второй р-р.
Напр., в р-ции (б) CdCl2 + Na2S → CdS↓ + 2NaCl , образуются агрегаты CdS, содержащие катионы кадмия, поэтому к CdCl2 нужно приливать понемногу Na2S - так ионы кадмия будут все время в избытке, адсорбируются на поверхности агрегата и образуют положительно заряженный слой. Формула получ. мицеллы: {m[CdS] • n Cd2+ • 2(n-x) Cl–}^2x+ • 2xCl–
Точно также, при реакции г) 2AgNO3 + MgI2 → 2AgI↓ + Mg(NO3)2, для получения положит. частиц золя нужно, чтобы AgNO3, содержащий катионы Ag+, был в избытке , поэтому к нему понемногу приливаем MgI2. Формула получ. мицеллы: {m[AgI] • n Ag+ • (n-x) NO3–}^x+ • xNO3–
a) В настоящее время общепринятой теорией строения коллоидных частиц является мицеллярная теория, согласно которой дисперсная фаза в системах коллоидной степени дисперсности представлена в виде мицелл. Мицелла — это агрегат молекул и ионов, состоящий из ядра и двойного электрического слоя. Хотя сами мицеллы электронейтральны, на поверхности каждой из них концентрируется электрический заряд определенного знака — либо положительного, либо отрицательного. Наличие одноимённого заряда у всех частиц данного золя является важным фактором его устойчивости. Заряд препятствует сближению частиц, а значит, предотвращает их слипание, укрупнение и выпадение в виде осадка.
Причиной возникновения заряда является процесс адсорбции ионов того или иного знака на поверхности частиц, происходящий в соответствии с правилом Пескова—Фаянса:
В случае если одно из веществ взято в избытке, оно будет выполнять роль стабилизатора. Другое вещество будет в недостатке, что предотвращает рост зародышей коллоидных частиц до крупных размеров. Молекулы As2S3, конденсируясь, образуют ядро мицеллы m[As2S3] (m означает число молекул сульфида мышьяка).
При избытке, например, (NH4)2S он будет являться стабилизатором. Сульфид аммония диссоциирует по уравнению:
(NH4)2S ←→ NH4+ + NH4S–.
По правилу Пескова-Фаянса на ядре m[As2S3] будут адсорбироваться, как родственные и находящиеся в растворе в избытке, ионы nNH4S–
Эти ионы плотно прилегают к ядру и называются потенциалоoпределяющими. Они определяют знак заряда на поверхности твердых частиц — гранул.
Отрицательно заряженные ионы NH4S– притягивают из раствора часть находящихся в избытке ионов NH4+, образующих слой противоионов (n–x)NH4+ в адсорбционном слое.
Ядро m[As2S3] и адсорбционный слой (куда входят ионы nNH4S– и противоионы (n–х)NH4+) образуют гранулу, несущую отрицательный заряд, так как ионов nNH4S–больше, чем (n–x)NH4+ на число х. Другая часть противоионов хН+ образуют диффузный слой в составе двойного электрического слоя, окружающего ядро мицеллы.
Формула золя сульфида мышьяка:
{[mAs2S3] · nNH4S– · (n–x)NH4+ }x– xNH4+
< ядро >| <адсорбционный > <диффузный>
| | слой слой
|< -------- гранула ------------->
| < -------------- мицелла ---------------------- >
Итак, двойной электрический слой состоит из адсорбционного слоя (в нем содержатся родственные потенциалопределяющие ионы и часть противоионов) и диффузного слоя противоионов.
Е). Окислительно-восстановительные и
электрохимические процессы
Окислительно-восстановительные реакции
Окислительно-восстановительные реакции – это химические процессы, сопровождающиеся изменением степени окисления элементов, входящих в состав реагирующих веществ. Окислительно-восстановительные реакции представляют собой единство двух процессов – окисления и восстановления.
Е 5.Рассчитайте массу оксалата аммония (NH4)2C2O4 ,
Который можно окислить действием 50 мл 0,2 н р-ра
Перманганата калия KMnO4 в кислотной среде.
Составьте уравнение соответствующего процесса и
Уравняйте его.
Решение:
Сн (KMnO4) = 0,2н р-ра;
V(KMnO4) = 50 мл = 0,05 л;
Оксалат аммония – соль двухосновной предельной карбоновой кислоты и при окислении перманганатом калия будет окисляться до углекислого газа. Уравнение реакции:
3(NH4)2C2O4 + 2KMnO4 = 6CO2↑ + 2MnO2↓ + 2KOH + 6NH3↑ + 2Н2О
Расставим коэффициенты методом электронно-ионного баланса.
C2O4(2-) – 2е = 2CO2 | 3 – окисление ;
MnO4(-) + 2H2O + 3e = MnO2 + 4OH(-) | 2 – восстановление;
Суммарно: 3C2O4(2-) + 2MnO4(-) + 4H2O = 6CO2 + 2MnO2 + 8OH(-)
В молекулярном виде:
3(NH4)2C2O4 + 2KMnO4 + 4H2O = 6CO2 + 2MnO2 + 2KOH + 6NH4OH
Образовавшийся в результате реакции гидроксид аммония распадается на аммиак и воду. Тогда уравнение реакции перепишется в виде:
3(NH4)2C2O4 + 2KMnO4 = 6CO2↑ + 2MnO2↓ + 2KOH + 6NH3↑ + 2Н2О
В результате окислительно-восстановительной реакции перманганат калия KMnO4 принимает три электрона, следовательно, эквивалентное число перманганата калия в данной реакции равно 3.
z(KMnO4) = 3 – эквивалентное число равно числу принятых электронов. Молярная концентрация раствора перманганата калия KMnO4. Cм (KMnO4) = Сн (KMnO4)/z(KMnO4) = 0,2/ 3=
0,0666моль/л;
Количество вещества прореагировавшего перманганата калия n(KMnO4) = Cм (KMnO4)* V(KMnO4) = 0,0666*0,05 = 0,003моль;
Тогда согласно уравнению реакции количество вещества прореагировавшего оксалата аммония. n((NH4)2C2O4) = 1,5*n(KMnO4) = 1,5*0,003 = 0,005 моль;
Масса прореагировавшего оксалата аммония. m((NH4)2C2O4) = n((NH4)2C2O4)*M((NH4)2C2O4) = 0,005*124 = 0,62 г
Ответ:Масса оксалата аммония равна 0,62 грамма
Коррозия металла и методы борьбы с ней
Коррозия – это разрушение поверхности сталей и сплавов под воздействием различных физико-химических факторов наносит огромный ущерб деталям и металлоконструкциям. Ежегодно этот невидимый враг «съедает» около 13 млн. т металла. Длительная эксплуатация стальных изделий без их эффективной защиты от коррозии вообще невозможна.
Основной причиной интенсивного окисления поверхности металлов (что и является основной причиной коррозии) являются:
Повышенная влажность окружающей среды.
Наличие блуждающих токов.
Неблагоприятный состав атмосферы.
Методы борьбы с коррозией:
Выбор подходящего способа защиты поверхности от образования ржавчины определяется условиями, в которых работает данная деталь или конструкция.
Наиболее эффективны следующие методы:
Нанесение поверхностных атмосферостойких покрытий;
Поверхностная металлизация;
Легирование металла элементами, обладающими большей стойкостью к участию в окислительно-восстановительных реакциях;
Изменение химического состава окружающей среды.
Е 16.Составьте электронные уравнения анодного и катодного
Процессов с кислородной и водородной деполяризацией
При коррозии пары магний-никель Mg-Ni. Установите
Продукты коррозии и определите ЭДС коррозионного тока
Решение:
Коррозия пары магний-никель с кислородной деполяризацией:
Анодный процесс: Mg - 2e ⟶ Mg2+
Катодный процесс: 2H2O + O2 + 4e ⟶ 4OH-
Суммарный процесс: 2Mg + 2H2O + O2 ⟶ 2Mg(OH)2 Продукты коррозии: гидроксид магния.
Коррозия пары магний-никель с водородной деполяризацией: Анодный процесс: Mg - 2e ⟶ Mg2+
Катодный процесс: 2H+ + 2e ⟶ H2
Суммарный процесс: Mg + 2H+ ⟶ Mg2+ + H2↑
Продукты коррозии: соль магния и водород.
Поскольку магний имеет меньшую величину электродного потенциала (–2,37 В), чем никель (– 0,25 В), то он будет играть роль анода, а никель – роль катода. Так как металл катода является восстановленной формой, то на нем будет протекать процесс восстановления молекул кислорода, присутствующего в нейтральной среде (кислородная деполяризация), или ионов водорода, присутствующего в кислой среде (водородная деполяризация).
ЭДС = Е К – Е А =-0,25+2,37=2,12В
Ответ:ЭДС=2,12В
Уравнения ядерных реакций
Ядерная реакция – это процесс взаимодействия одного ядра с другим или элементарной частицей, сопровождающийся изменением состава и структуры ядра и выделением вторичных частиц или γ-квантов.
Ж.10. При облучении ядер изотопа алюминия 1327 Al нейтронами протекает несколько реакций, при этом возможно образование ядер изотопов алюминия
1326 Al
или 25 13Al, а также ядер изотопов магния 2712 Mg или натрия 1124 Na. Во всех случаях выделяются и вторичные
частицы. Напишите уравнения возможных ядерных реакций
Решение:
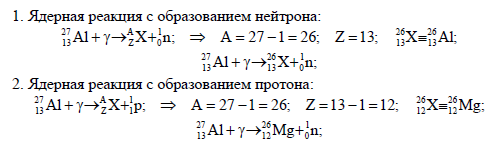
Явление самопроизвольного превращения неустойчивого изотопа химического элемента в другой изотоп (обычно другого элемента) (процесс радиоактивного распада) путем излучения γ-квантов, элементарных частиц или ядерных фрагментов.
Ж.13.
Напишите полные уравнения следующих ядерных
превращений, сокращенные схемы которых имеют вид:
90Th(b-a)

Б)24Cr(h,?)25Mn
53\24Cr + 2\1D = 1\0n + 54\25Mn;
В)19/9F+1/1p=20/10Ne+y
Описание химической связи методом валентных связей
3.9.Установите ,какие из следующих частиц являются
Реальными,а какие гепотетическими ,с точки зрения
Учения о хим.связи:
BeFe2- ; BeF4;BeF2;BeF64-
Решение:
BeFe2- и BeF64-реальные частицы;
BeF4 и ВеF2-гепатетические частицы
3.12.Определите пространственное расположение ядер
Атомов в молекулах углерода сульфида CS2 и диоксида
Углерода CO2,если их дипольные моменты равны нулю.
Решение:
В молекуле СО2 (O=C=O) также две пары связывающих электронов (рассматриваем только σ-связи), однако в отличие от молекулы воды у атома углерода неподеленных пар электронов нет. Очевидно, что отталкивание между парами электронов в этом случае будет минимальным, если они расположатся под углом 180°, т.е. при линейной форме молекулы СО2:
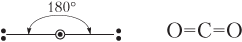
Пространственное расположение –линейное,a=180̊;
Число σ-связей, образованных центральным атомом-2
Механизм образования связей в комплексных соединениях
И 8.Определите тип гибридизации атомных орбиталей
Иона Ni2+ и пространственную структуру,образуемых
Им комплексных соединений:[NiCl4]2- и [Ni[(CN4]2-
Обьясните их магнитные свойства.
Решение:
sp3
|
[NiCl4]2– Ni2+:…3d8
Тетраэдри-ческая Парамагнетик;
|
[Ni(CN)4]2–
Ион Ni+2 сильно взаимодействует с ионами CN–. В этом случае происходит спаривание двух d-электронов иона Ni+2 и образовавшаяся свободная ячейка заполняется электронной парой CN–
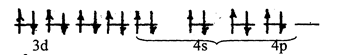
dsp2–гибридизация (внутренняя), плоское квадратное строение, диамагнитна.
Свойства комплексных соединений
И 14.Определите типы изомерии в следующих наборах
Комплексных соединений :
А) [Pt(NH3)4(SO4)](OH)2 и [Pt(NH3)4(OH)2]SO4
Ионизационная изомерия.
Этот вид изомерии связан с различным распределением ионов различного типа между внутренней и внешней сферами комплекса.
B)цис-K[Al(OH)4(NH3)2]
транс - K[Al(OH)4(NH3)2]
Этот вид изомерии обусловлен различным расположением лигандов относительно друг друга и распространен у комплексных соединений.
Если одинаковые лиганды находятся по одну сторону от комплексообразователя, то образуется цис-изомер(от лат. cis - по эту сторону), а если по разные стороны, - образуется транс-изомер(от лат. trans - по ту сторону).
Список использованной литературы:
1.Глинка Н.Л. Общая химия.—Л.: Химия, 1977-1987.
2.Глинка Н.Л. Задачи и упражнения по общей химии.— Л.: Химия, 1985
3.Гольбрайх З.Е., Маслов Е.И. Сборник задач и упражнений по химии.- М.:
Высшая школа, 1997
4.Краткий справочник физико-химических величин / Под ред. А.А.
5.Равделя, A.M. Пономаревой.— Л.: Химия, 1983
6.Свойства неорганических соединений: Справочник / А.И. Ефимов и др./.— Л.:
Химия, 1983
7.Фролов В.В. Химия.—М.: Высшая школа, 1986
8.Харин А.Н., Катаева И.А., Харина А.Т. Курс химии.— М: Высшая школа, 1983
|
 Скачать 129.03 Kb.
Скачать 129.03 Kb.