Физ U (1). Молекулалы былыстар1466 #1 ! Дыбысты объективті сипаттамалары
 Скачать 333.04 Kb. Скачать 333.04 Kb.
|
|
Кез келген дененің спектрлі энергетикалық жарықтануының оған сәйкес монохроматты жұтылу коэффициентіне қатынасы – бұл: +спектрлі энергетикалық жарықтануының тығыздығы 334 Боз дене үшін энергетикалық жарықтануы: +E=α∙σT4 335 Денелердің энергетикалық жарықтануы: + 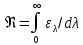 336 Заттың бірлік массасының жұтатын сәулесімен сипатталатын шама: +жұтылу дозасы 337 Сәуле дозасының уақытқа қатынасы: +дозаның қуаты 338 Экспозициялық дозаның тұжырымдамасы: +толық иондалғанда құрғақ ауаның сәуле шығаруымен сипатталатын шама 339 Радиотолқындар (толқын ұзындығы=2нм) мен көрінетін жарықтың (толқын ұзындығы= 0,76 мкм) арасында жататын электрмагниттік сәуле шығару: +инфрақызыл. 340 Бір шеті көрінетін табиғи жарықтың күлгін сәулесімен ( 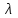 =400нм) және бір шеті рентген сәулесімен ( =400нм) және бір шеті рентген сәулесімен (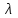 =10нм) шектесетін сәуле: +ультракүлгін =10нм) шектесетін сәуле: +ультракүлгін341 Спектрлік сызықтар қарқындылығы тәуелді: +атомдардың жұтылу санына 342 Больцман таралуы бойынша анықталады: +электрондардың энергетикалық деңгейлер 343 Спектрлік сызықтардың қарқындылығы анықталады: +жұтылу спектрімен 344 Адам денесі спектрдің инфрақызыл бөлігінің аумағында жылулық сәуле шығарады және оның толқын ұзындығының диапазоны: +> 900 нм және толқын ұзындығы 920 нм сәулелерінің максимумы 345 Фотохимиялық реакция: +жарықтың жұтылуынан заттың химиялық түрленуі 346 Термодинамикалық тепе - теңдікте инверсия пайда болмайды, себебі жоғарғы энергетикалық деңгейде бөлшектер төменгі деңгейге қарағанда: +аз 347 Фотоэффект сәуле шығару қарқындылығына тәуелсіз критикалық мәнінен төмен толқын ұзындығында болады - бұл: +фотоэффектінің қызыл шекарасы 348 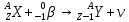 – бұл: +электрондық қармап алу – бұл: +электрондық қармап алу349 Фотоэффект, Комптон-эффект және электронды-позитронды жұптарының өзара әсерінен туындайтын жұтылу коэффициенттерінің қосындысы: +сызықты коэффициент 350 Рэлей заңының формуласы: +І= 1 / 4 351 Эффективті доза: +берілген энергетикалық күйде сол кездегі уақыттағы қандай да бір радионуклидтер санының радиоактивтілік өлшемі 352 Электрондық қармап алудың сызбасы: +  353 Өткен сәулемен қатар рентген сәулелерінің әртүрлі бұрыштарға толқын ұзындығы өзгере отырып ауытқуы: +Комптон эффектісі 354 Инфрақызыл сәуленің адам денесіне тигізетін бастапқы әсері: +бактерицидті 355 Жылулық сәуле шығарудың қарқындылығын өлшейтін құрал: +актинометр. 356 Дозиметрдің негізгі қызметінде мына шама өлшенеді: +иондалған сәуленің дозасы 357 Бірінші реттік электрондар шоғырымен металдар бетін атқылау нәтижесінде пайда болатын екінші реттік электрондық эмиссиясы қолданылатын орта: +фотоэлектрондық көбейткіштер 358 Жұтылған кванттар энергиясының мөлшеріне қарай анықталады: +электрондардың энергетикалық деңгейлерінің өзгерісі 359 Радиоактивті көздермен жұмыс жасағанда препараттың активтілігі артқан сайын радиоактивті ядролар көп болады, ал жартылай ыдырау периодының өзгерісі: +кемиді 360 Электрондарды электростатикалық өріспен атомда немесе ядрода тежелуден болатын рентген сәуле шығаруы: +тежелуші «Физика» пәнінен «Фармацевтикалық өндіріс технологиясы» мамандығы студенттері үшін жаттығу тест сұрақтары 1. Дыбыстың биіктігі анықталады: жиілігі 2. Дыбыстың физикалық шамалары: қарқындылығы, жиілігі, толқын ұзындығы 3. Есту сезімталдығының физиологиялық сипаттамалары: қаттылық, биіктік, тембр 4. Дыбыс тербелістерінің жиілік шектері: 16 Гц – 20 кГц 5. Ультрадыбыстың жиілік шектері: 20 кГц-200 кГц 6. Инфрадыбыстың жиілік шектері 0 - 16 Гц 7. Инфрадыбыс жиілігінің шегі: <16 Гц  Доплер эффектісі: 𝜈 = 𝜈±𝜈б 𝜈 //// v=v| 𝜈±𝜈з Дыбыстың қаттылығы сипаттайды: қарқындылығы 10. Дыбыстың тембрі анықталады: гармониялық спектр 11. Дыбыс биіктігі тәуелді:жиілігіне Бойль-Мариот заңы PV const, T const; Гей-Люссак заңы V const, P const; T V const; T const P P const; V const; V T const; T const V Шарль заңы V1 P2 ; T const P1 V2 T1 V2 T2 ; Р const V1 P const,V const; T Заттың молі үшін идеал газдың күй теңдеу 𝑃𝑉0 = 𝑅𝑇; Әртүрлі массасы бар газ үшін Менделеев-Клапейрон теңдеуі: PV = νRT; Барометрлік формула: 1. 𝑃 = 𝑃0 𝑚𝑔ℎ 𝑅𝑇 2. 𝑃0 = µ𝑔ℎ  𝑃 𝑚𝑔ℎ 𝑒− 𝑘𝑇 ℎ2𝑇3 µ𝑔ℎ 3. 𝑃 = 𝑒− 𝑇  𝑃0 𝑃0𝑅2 4. 𝑃 = 𝑃0𝑒 −µ𝑔ℎ 𝑅𝑇 𝑚𝑔ℎ 5. 𝑃 = 𝑃0𝑒 𝑘𝑇 Больцман таралуы: 𝑚𝑔ℎ 4. 𝑛 = 𝑛0𝑒 𝑘𝑇 ; Тұрақты температурада термодинамикалық жүйе күйінің өзгеру үрдісі: изотермиялық Газдың тұрақты көлемінде қысымның температураға қатынасы тұрақты болады, бұл үдерістің аталуы: изобаралық Тұрақты көлемде термодинамикалық жүйе күйінің өзгеру үрдісі: изохоралық Термодинамиканың бірінші бастамасының формуласы: 𝑄 = ∆𝑈 + 𝐴 Араларында энергия алмасуы мүмкін болатын жүйелерді қарастыратын физика бөлімі: термодинамика 24. Циклде, жүйе: бастапқы күйге қайтадан келеді 25. Термодинамика: бір-бірімен энергия алмаса алатын жүйелер 26. Қоршаған жүйенің заттарымен және энергиясымен ауысатын жүйелер: ашық 27. Идел газ қоспасының қысымы парциалдық газдардың қысымдарының қосындысына тең – бұл: Дальтон заңы 28. Тек қана энергиямен алмасатын жүйелер: Жабық 29. Жүйеге берілген жылу жұмсалады: ішкі энергияға және жұмыс жасауға 30. Қоршаған ортамен энергия да, зат та алмаса алатын жүйенің аталуы: ашық 31. Қоршаған ортамен тек энергия алмаса алатын жүйенің аталуы: жабық 32. Қоршаған ортамен энергия да зат та алмаса алмайтын термодинамикалық жүйе: оқшауланған 33. Жабық жүйе қоршаған ортамен алмасады: энергиямен 34. Термодинамикалық жүйенің күйін сипаттайды: параметрлермен 35. Жүйеге берілген жылу жұмсалады: ішкі энергияға және жұмыс жасауға Газдың жасайтын жұмысы:   𝐴 = 𝑚 𝑅𝑇𝑙𝑛 𝑉2 𝐴 = 𝑚 𝑅𝑇𝑙𝑛 𝑉2𝑀 𝑉1 Бір моль заттың концентрациясы аз алабтан көп алабқа өту жұмысы: 𝐴 = 𝑅𝑇 ln 𝑐2 𝑐1 Пригожин формуласы:    𝑑𝑆 = 𝑑𝑆𝑖 + 𝑑𝑆𝑏 𝑑𝑆 = 𝑑𝑆𝑖 + 𝑑𝑆𝑏𝑑𝑡 𝑑𝑡 𝑑𝑡 Жүйенің стационар күйінде жүйенің параметрлері уақыт бойынша: өзгермейді, зат ағыны мен энергия бар 40. Жүйенің тепе-теңдік күйінде жүйенің параметрлері уақыт бойынша: өзгермейді, зат ағыны мен энергия жоқ 41. Жұмысшы дененің жылуалмасу кезіндегі беретін немесе алатын жылу мөлшерлерінің қатынасы – бұл келтірілген: жылу мөлшері. 42. Оқшауланған жүйеде жүйе ортамен зат, не энергиямен алмаса алмайды 43. Жабық термодинамикалық жүйе деп ортамен тек энергия алмасады 44.Термометрия мен калориметрия әдістері негізделген: жылу мен энергияның сақталу заңына 45. Энтропия: келтірілген жылу мөлшерінің қосындысының жүйенің күйі функцияның айырмасына тең болатын шама 46. Қайтымды үрдіс үшін келтірілген жылу мөлшерінің қосындысы: энтропия 47. Бір денені салқындату арқылы жылуды жұмысқа айналдыратын периодты үрдіс: мүмкін емес 48. Адиабаталық ұлғайған кезде идеал газдың ішкі энергиясының өзгерісі: ∆𝑈 = −𝐴 ∆𝑈 <𝐴 49. Адиабаталық үдерісте жүйе қоршаған ортамен: жылу алмаспайды 50. Пуассон теңдеуі сипаттайтын үдеріс: адиабаталық Адиабаталық процесті сипаттайтын теңдеу Пуассон теңдеуі деп аталады. 𝑝𝑉𝛾 = 𝑐𝑜𝑛𝑠𝑡 52.. Аускультация үшін қолданылады:фонендоскоп 53. Ағзаның ішіінде пайда болатын дыбыстарды тікелей тыңдау: аускультация 54. Күрделі тонның спектрі: сызықты 55. Фазалар айырмасы 2π тең болатын екі нүктенің арақашықтығы: |
