Хирургия печени и желчных путей. Нежизнеспособности ее у больного или для борьбы с тяжелой печеночной недостаточностью
 Скачать 11.68 Mb. Скачать 11.68 Mb.
|
|
Экстракорпоральная перфузия печени. Известны два метода подключения изолированной печени к больному (Б. А. Петров, 1970): артерия реципиента — воротная вена изолированной печени — нижняя полая вена — вена реципиента (рис. 120) и вена реципиента — портальная вена изолированной печени — нижняя полая вена — вена реципиента (рис. 121 а, б). В схемы включен аппарат «искусственная почка» типа Коль-фа с роликовым насосом типа Сарпа. Во второй схеме обязательным является оксигенация крови, которая достается подведением кислорода в потоке в диализатор аппарата «ис-куственная почка» (Б. В. Петровский и соавт., 1972). В результате последних клинических и экспериментальных иссле- дований (Г. М. Соловьев и соавт., 1972) было установлено, что при перфузии только через воротную вену наблюдается диссоциация функций печени: мочевинообразовательная восстанавливается, а желче-выделительная наоборот угнетается. В связи с этим Г. М. Соловьев и соавторы рекомендуют одновременно включать в кровоток воротную вену и печеночную артерию. Скорость перфузии. По этому поводу в литературе еще не выработалась определенная точка зрения. Так, Liew, Rafiucci (1965) рекомендуют высокие скорости порядка 800— 1200 мл /мин с оксигенацией в 0,9 мл на 1 г веса ткани в 1 минуту для оптимального покрытия метаболических потребностей печени при перфузии через портальную вену. Большинство же исследователей (Н. Н. Савицкий, 1967; В. С. Сергиевский, 1969, 1970; Б. А. Петров, 1970; Г. С. Соловьев и соавт., 1972; Battersly, 1971, и др.) наоборот считают, что перфузионное давление не должно превышать 180—200 мм вод. ст., а скорость перфузии 0,5—2 мл на 1 г/минуту, при достаточной оксигенации (96%) и рН равном 7,4. При увеличении этих показателей, по их мнению, возникают различные морфологические изменения печеночной паренхимы вплоть до разрыва печеночных балок и развития блока оттока. Для создания медленного кровотока может быть использован артерио-венозный шунт Скриб-пера, наложенный на предплечье (Б. В. Петровский и соавт., 1972), а для создания постоянного перфу-зионного давления и гашения «пульсовой» волны оксигенатора Б. А. Петров (1970) рекомендует включать в схему градуированный резервуар, устанавливаемый на высоте 200 мм над уровнем перфузируемой печени и для более равномерного кровообращения применять управляемое подключение, при котором изолированная печень получает кровь из оксигенатора аппарата искусственного кровообращения и от больного. В случае ухудшения гемодинамики поступление крови от больного прекращается и кровообращение осуществляется только АИ К. Продолжительность перфузии. В настоящее время установлено, что оптимально-полезный срок перфузии исчисляется 2,5—3 часами (Б. В. Петровский с соавт., 1970; Chrzanorv-ska, 1968, и др.). Starzl (1966) в эксперименте па собаках установил, что желчевыдели-тельная функция изолированной печени сохраняется до 30 часов, а Abouna (1970) в клинике длительность перфузии гетерологической печени доводил до 6—22 часов, а гомологической — до 35 часов. Martines (1967) путем электронной микроскопии уже через 150 минут от начала перфузии отмечал определенные сдвиги во внутриклеточном метаболизме изолированной печени, несмотря на то, что последняя сохраняла функцию до 3 часов. Wagner (1971) показал, что даже в условиях гипотермической перфузии после 4 часов функция изолированной печени прогрессивно падает: нарастает активность трансаминаз, определяются застойные явления в печеночных синусах и некротические повреждения паренхимы. Неустойчивость и неполноценность функции изолированной печени по замещению ее функции у больного с убедительностью доказаны в исследованиях Б. В. Петровского с соавторами (1970) на 4 больных, у которых они применили экстракорпоральную перфузию печени свиньи. Уже в первые 5 часов после начала перфузии было отмечено накопление в крови недоокисленных продуктов обмена, а кровоснабжение печени было неадекватным. Несмотря на создание совершенно адекватного кровотока, нарастала ишемия печени свиньи. И тем не менее была отмечена на протяжении 2 часов нормализация в крови содержания ферментов и ряда биохимических тестов (аль-долаза, сорбитдегидрогеназа, лактат- 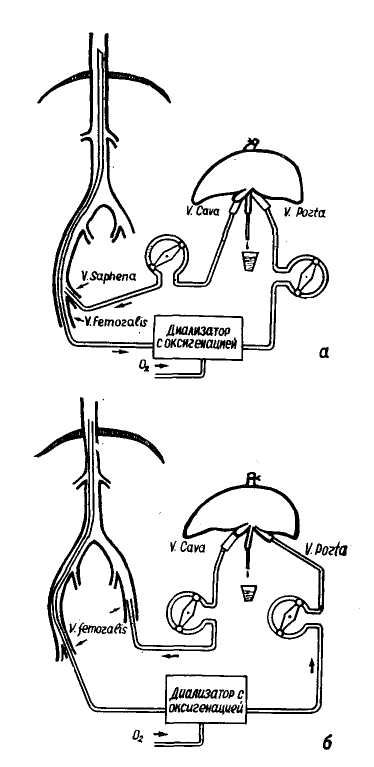 Рис. 121. Схема экстракорпоральной перфузии: а) большая подкожная вена реципиента или б) бедренная вена реципиента — портальная вена изолированной печени — нижняя полая вена — бедренная вена реципиента (но Б. В. Петровскому). дегидрогеназа, глютаматдегидрогеназа, щелочная фосфатаза), снижение общего билирубина и остаточного азота. Клинические наблюдения в настоящее время охватывают 153 случая экстракорпоральной перфузии печени (табл. 23, по Г. М. Соловьеву и соавт., 1972 с дополнением). Как видно из данных табл. 27, стойкий эффект от перфузии получен лишь у 20 больных (смертность составляет 86,9%). Однако, если учесть, что без этого метода лечения погиб- Таблица 23 Экстракорпоральная перфузия печени в клинике (данные литературы).
ли бы и остальные 13,1% больных, можно отметить псе же некоторую эффективность данного метода, находящегося еще далеко от совершенства. Как выяснилось, конечный результат зависит не только от методики перфузии, по главным образом от состояния больного, в котором он попадает для производства перфузии и от причины, вызвавшей тяжелое состояние. Г. М. Соловьев (1972) указывает, что экстракорпоральная перфузия больше показана у больных с циррозом печени и аммиачной инток- сикацией, чем у больных с острым гепатитом и массивными некрозами в печени. Требуется раннее подключение печени, так как при коматозном состоянии продолжительностью более 20 часов этот метод абсолютно неэффективен. Вместе с тем Romien (1967) вообще считает экстракорпоральную перфузию печени бесполезной при лечении хронических форм печеночной недостаточности и в частности цирротического происхождения. Подобной точки зрения придерживаются Norman (1967) и Waldshraidt (1971). Вопрос об использовании в экстракорпоральной системе человеческой печени встретил ряд дополнительных трудностей. Длительность агонального периода, исходное состояние донора, большой срок тепловой ишемии — все это приводит к более раннему и глубокому анаэробному гликолизу. Немаловажную трудность представляет и исследование функциональной способности печени человека, а также возможность сохранения постоянной микроциркуляции до подключения ее к больному. Л. Алипхевич (1971), Degradi (1968), Schrvemmel (1971) и другие, анализируя результаты экстракорпоральной перфузии свиной печени выделяют следующие группы осложнений: гемодинамические, нарушения кислотно-щелочного равновесия, нарушения деятельности почек, нарушения в системе свертывания крови. Мы подключали печень всего 1 раз при острой печеночной недостаточности на почве острого гепатита. Это дало временный эффект, снизилась мочевина крови, аммиак, пировиноградная и молочные кислоты, однако через 5 часов состояние больного ухудшилось и он погиб. Имея малый личный опыт, мы не можем утверждать, что метод экстракорпоральной перфузии печени займет определенное место при лечении острой и хронической печеночной недостаточности. ТРАНСПЛАНТАЦИЯ ПЕЧЕНИ В настоящее время существует два метода пересадки печени: полное удаление собственной печени и ее замещение органом донора — ор-тотопическая гомотрансплантация; пересадка печени или части ее с оставлением собственного мало- или пефункционирующего органа — гете-ротопическая пересадка. Преимущества обоих методов оспариваются. Ортотопическая трансплантация приемлема почти при всех поражениях печени, в то время, как гетеро-топическая не приемлема при злокачественных поражениях. И в то же время преимущества последней заключаются в отсутствии необходимости удаления собственной печени, что во многом сокращает объем оперативного вмешательства, а также позволяет надеяться на частичное функционирование собственного органа в период вживления новой печени. Ортотопическая пересадка связана с изъятием печени и ее пересадкой в ограниченно короткий срок, что требует высокой квалификации хирурга, возникает необходимость пережатия приводящих и отводящих сосудов печени и при этом возникают серьезные нарушения важнейших видов обмена, требующие немедленной компенсации. Преимуществом ортотопичес-кой пересадки является возможность размещения пересаженного органа па место прежнего, в то время как при гетеротопической пересадке размещение донорской печени в теле реципиента представляет значительные трудности. Весьма существенным фактом является и то, что отторжение пересаженной печени, встречающееся при всех видах пересадок, при ортотопической операции неминуемо ведет к смерти реципиента, а при гетеротопической возможны даже неоднократные пересадки. Впервые гетеротопическую пересадку цельного органа печени произвол на собаках Welch в 1955 г. В 1959 г. Moore и несколько позже Starzl в опытах на собаках произвели ортотопическую пересадку печени. В 1963 г. Starzl впервые разработал и осуществил ортотопическую нересадку в клинике, операция закончилась смертью на операционном столе от кровотечения. В этом же году Starzl повторил операцию, которая закончилась успешно. Больной погиб на 22-й день от эмболии легочной артерии, 11 дней после подобной операции прожил и больной, оперированный в том же 1963 году Moore. Гетеротопическая пересадка печени в клинике была выполнена в 1965 г. Absolon и Hagihara. После первых попыток пересадки печени в клинике трансплантация печени стала все шире внедряться в практику хирургических клиник. К концу 1972 года пересадка печени была выполнена 162 раза у 159 больных в 34 клиниках мира (данные Международного центра трансплантации в Чикаго, Ю. Н. Мальков, 1972; Dalore, 1972) с максимальной продолжительностью жизни более 40 месяцев. И все же несмотря на некоторое улучшение прогноза трансплантации летальность остается очень высокой, поэтому поиски методов пересадки остаются и будут оставаться в центре внимания всех исследователей, занимающихся этой проблемой. В результате проведенных экспериментальных и клинических исследований твердо установлено, что для гомотрансплантации печени в клинике приемлема только печень человека (Ю. М. Лопухин, Г. Е. Островерхов, 1970; Paolaggi, 1970, и др.). И если сама техническая сторона пересадки разработана довольно детально и практически выполнима, то такие проблемы, как проблема донора, подготовка и консервирование печени, вопросы тканевой несовместимости при пересадке остаются еще неразрешенными и в значительной 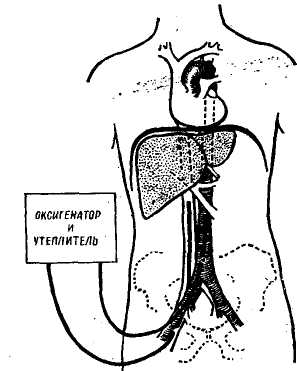 Рис. 122. Экстракорпоральная перфузия на трупе перед экстирпацией печени (по Starzl) мере тормозят клинические возможности трансплантации (Starzl и Cal-nе, 1969). |
