Скрипко Т.В. Общая и неорганическая химия Практикум. Общая и неорганическая химия
 Скачать 2.12 Mb. Скачать 2.12 Mb.
|
|
Задача 185 Вычислить эквивалентную массу металла, зная, что его хлорид содержит 79,78 % хлора и 20,22 % металла. Решение: Согласно закону эквивалентов отношение количества металла и хлора в соединении должно быть равно отношению их эквивалентных масс: Задача 190 Вычислить эквивалентную массу оксида и металла, если на восстановление 1,80 г оксида израсходовано 0,833 л водорода (н.у.). Решение: В тех случаях, когда одно из реагирующих веществ находится в твердом состоянии, а второе – в газообразном, закон эквивалентов может быть выражен так: 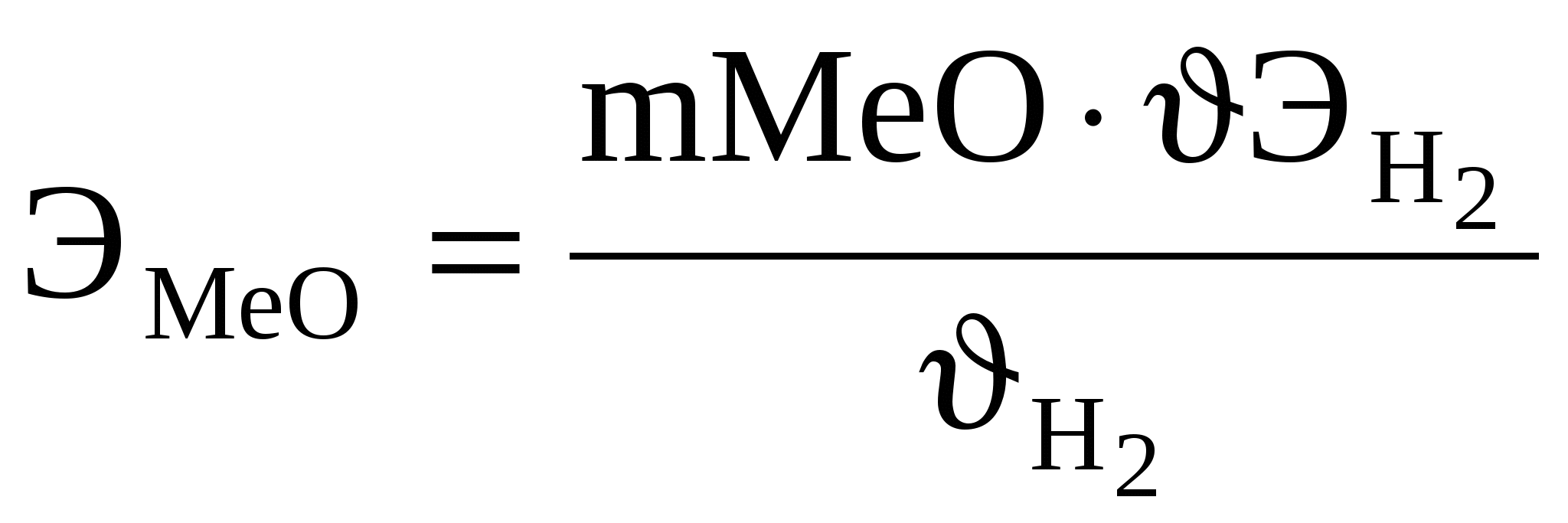 . .Эквивалентная масса оксида равна сумме эквивалентных масс элемента, образующего оксид, и кислорода: ЭМеО = ЭМе + ЭО ; ЭМе = ЭМеО + ЭО = 24,20 – 8 = = 16,20 г/моль. Эквивалентная масса металла равна 16,20 г/моль. Задача 196 При растворении 0,5 г метана в кислоте выделилось 0,189 л водорода при температуре 294 К и давлении 101,325 кПа. Вычислить эквивалентную массу металла. Решение: Необходимо объем газа привести к нормальным условиям. Из закона эквивалентов вытекает, что 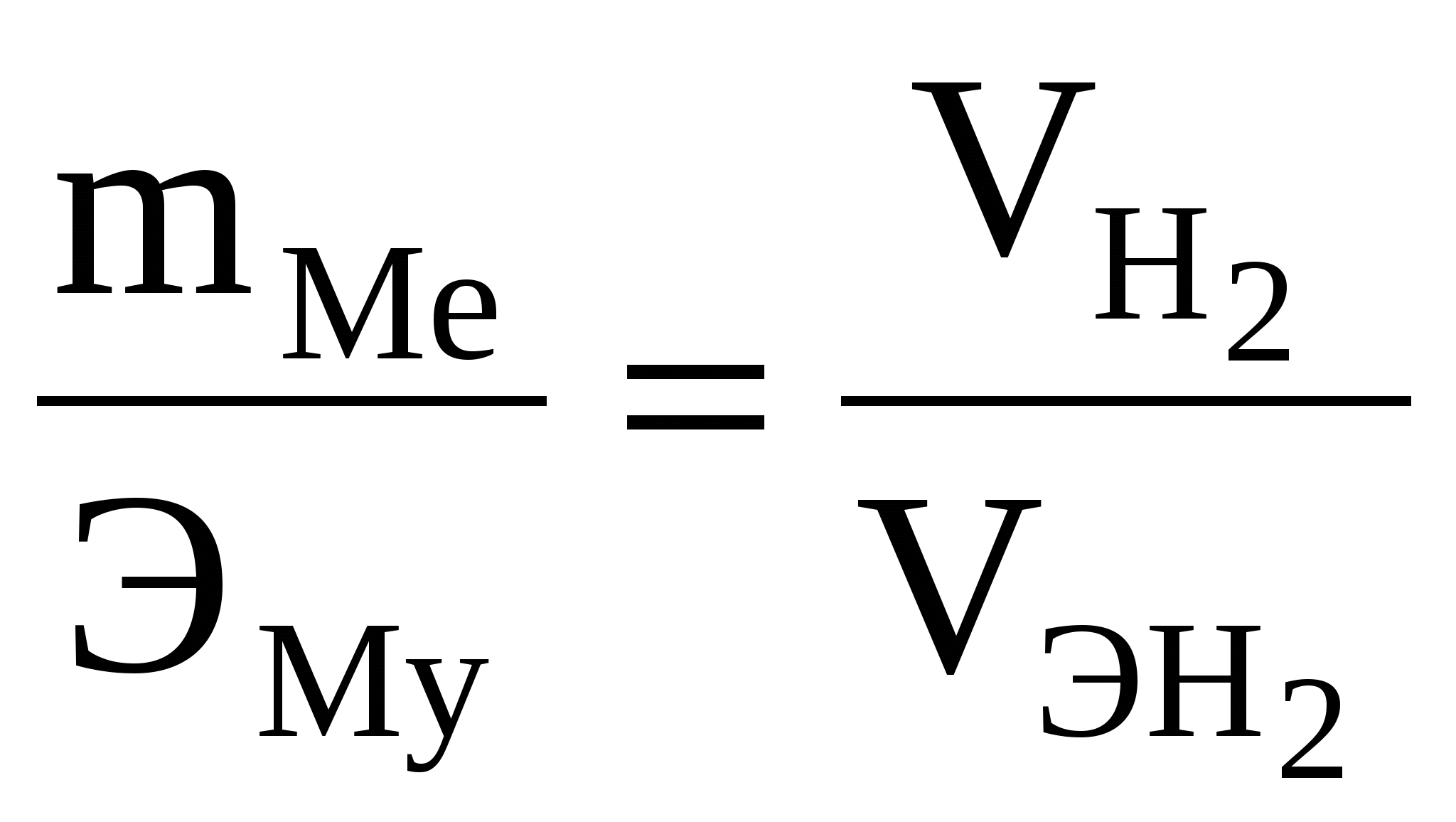 , ,подставив значение величин из условия, получим В задачах (160–179) определить эквивалентную массу соединения (первого) в следующих реакциях:
В задачах (180–189) вычислить эквивалентную массу металла по процентному содержанию его в соединениях:
В задачах (190–195) вычислить эквивалентные массы оксида и металла, если на восстановление определенного количества оксида металла израсходованы следующие объемы водорода (н.у.):
В задачах (196–204) вычислить эквивалентную массу металла, если определенное количество его присоединяет или вытесняет следующие объемы газов:
3. ОСНОВНЫЕ ЗАКОНОМЕРНОСТИ ПРОТЕКАНИЯ ХИМИЧЕСКИХ РЕАКЦИЙ 3.1. Энергетика химических реакций. Химико-термодинамические расчеты Следствием закона сохранения энергии является положение, экспериментально установленное в 1840 г. Г. И. Гессом (закон Гесса) и лежащее в основе термохимических расчетов. Тепловой эффект химической реакции (т.е. изменение энтальпии или внутренней энергии системы в результате реакции) зависит только от начального и конечного состояний, участвующих в реакции веществ, и не зависит от промежуточных стадий процесса. Из закона Гесса следует, в частности, что термохимические уравнения можно складывать, вычитать и умножать на численные множители. Важное следствие из закона Гесса, применение которого упрощает многие термохимические расчеты, можно сформулировать следующим образом: «Стандартное изменение энтальпии химической реакции равно сумме стандартных энтальпий образования продуктов реакции за вычетом суммы стандартных энтальпий образования исходных веществ». При каждом суммировании следует учитывать, в соответствии с уравнением реакции, число молей, участвующих в реакции веществ. Тепловые эффекты химических процессов вызываются тем, что протекание реакции сопровождается разрывом одних химических связей и возникновением других. Разность энергий образующихся связей и тех, которые претерпели разрыв, и проявляется в виде результирующего теплового эффекта химического процесса. Химические реакции, сопровождающиеся выделением тепла, называются экзотермическими, а идущие с поглощением тепла – эндотермическими. Уравнения химических реакций в сочетании с указанием их тепловых эффектов называются термохимическими уравнениями. Тепловой эффект реакции зависит от агрегатного состояния веществ, которое указывается в уравнении в скобках рядом с соответствующими символами или формулами – твердое (т), кристаллическое (к), растворенное (р), жидкое (ж), парообразное (п) и газообразное (г). Тепловой эффект реакции принято относить к стандартным условиям (t =25 оС и Р = 1 атм) и обозначать символом Δ Но298. Значения теплот образования ΔНо298 большого числа соединений приведены в табл. 3 приложения, при этом значения теплот образования простых веществ, взятых в стандартных условиях, например водорода, хлора, графита и т.д., условно принимаются равными нулю. Примеры составления условий задач и их решения Задача 240 Вычислить тепловой эффект реакции при 298 К: 1) при Р = const; 2) при = const 2 Mg (к) + CO2 (г) = 2 MgO (к) + С (графит). Тепловой эффект образования веществ при стандартных условиях найти по данным табл. 3 приложения. Решение: Находим стандартные энтальпии образования СО2 и MgO, которые равны соответственно -393,5 и -601,8 кДж/моль (напомним, что стандартные энтальпии образования простых веществ равны нулю). Тепловой эффект данной химической реакции рассчитываем по формуле: Но298 = 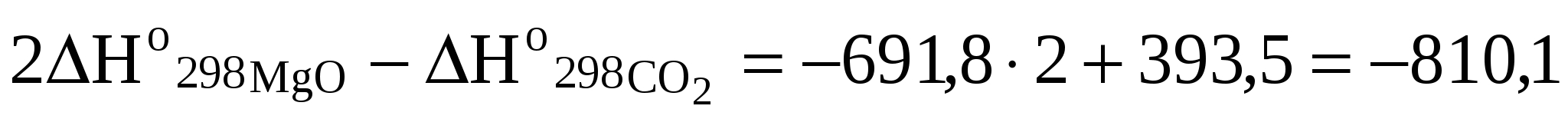 кДж/моль. кДж/моль.По известному значению теплового эффекта реакции Н при постоянном давлении можно рассчитать тепловой эффект реакции U при постоянном объеме: Uо298 = Ho298 - nRT, где n – изменение числа молей газообразных продуктов реакции и исходных веществ (n = n прод. - n исх.вещ.). n = -1. Значение R = 8,314 Дж/моль К. Т = 298 К. Uо298 = -810,1 – (-1) Задача 244 Определить стандартную энтальпию образования (Но298 обр.) РН3, исходя из уравнения 2 РН3 (г) + 4 O2 (г) Р2О5 (к) + 3 Н2О (ж) : Но = -2360,4 кДж. Решение: Согласно закону Гесса Нох.р.= Отсюда В таблице приложения находим стандартные энтальпии образования Н2О (ж) и Р2О5 (к): Находим Задача 264 Вычислить, сколько моль СН3ОН (н.у.) нужно сжечь, чтобы выделилось 2500 кДж тепла, исходя из уравнения: СН2ОН (ж) + 3/2 О2 (г) СО2 (г) + 2 Н2О (ж). Решение: Решение данной задачи осуществляется по плану решения предыдущей задачи: СН3ОН (ж) + 3/2 О2 (г) СО2 (г) + 2 Н2О (ж) + 726,78 кДж. При сжигании 1 моль СН3ОН выделяется 726,78 кДж тепла, а при сжигании Х моль СН3ОН выделится 2500 кДж тепла: Х = Для получения 2 500 кДж тепла необходимо сжечь 3,4 моль метилового спирта. Задача 268 Используя термодинамические величины веществ, вычислить для реакции Mg3N2 (к) + 6 H2O (ж) 3 Mg(OH)2 (к) + 2 NH3 (г) изменение энтальпии, энтропии и энергии Гиббса. Определить, в каком направлении возможно протекание реакции? Решение: Для расчета Go298 воспользуемся уравнением Gох.р. = Нох.р. – Т Sох.р. . Находим Но реакции: Нох.р.=[2 (-46,19) + 3 (-924,66)] – [461,1 + 6(-285,840] = -690,22 кДж/моль. Аналогично вычисляем: Sox.p. =( Sox.p =(2192,5 + 3,63,14) – (87,9 + 669,96) = 66,76 Дж/моль∙К. Теперь находим Go химической реакции, используя в качестве единой энергетической единицы килоджоуль: Gox.p. = Hox.p. – T Sox.p.= Таким образом, Gox.p. < 0, так что данная реакция термодинамически возможна (протекает слева направо). Задача 280 Рассчитать приблизительно температуру, при которой устанавливается равновесие в системе SiCl4 (г) + 2 H2 (г) Si (к) + 4 HCl (г). Решение: Находим Нo реакции: Нox.p.= 4 (-92,4) – (-664,8) = 295,2 кДж/моль. Аналогично вычисляем So реакции: Sox.p.= (4So298HCl (г) + So298Si(к)) – ( Sox.p.= (4186,9 + 18,72) – (252,6 + 2130,6) = 252,92 Дж/моль∙К. В момент равновесия Gox.p.= 0, тогда Нox.p.= Т Sox.p. Откуда Т = 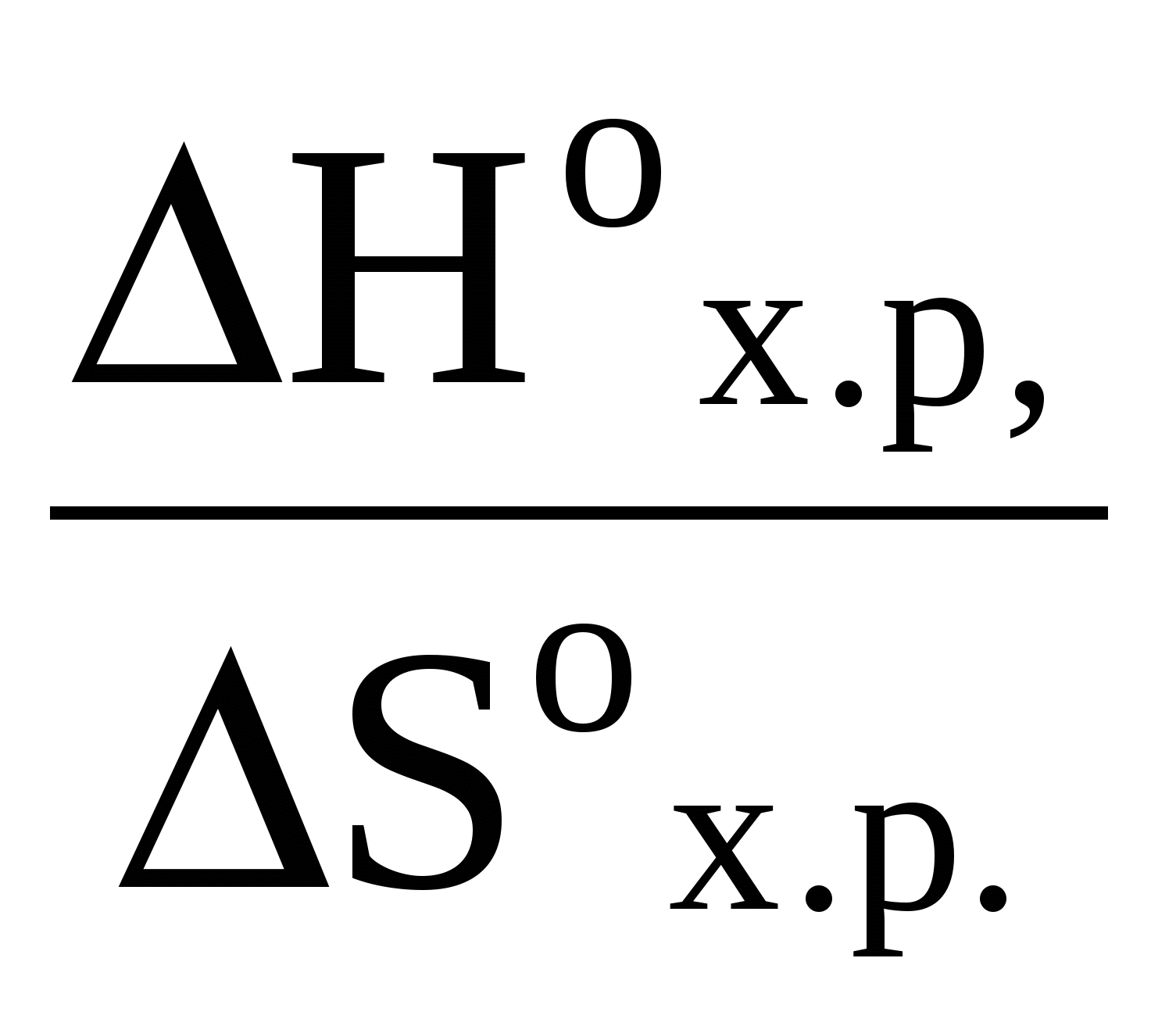 = 1166,79 К. = 1166,79 К. |
