|
|
Скрипко Т.В. Общая и неорганическая химия Практикум. Общая и неорганическая химия
Задача 335
Определить восстановитель и окислитель, расставить коэффициенты, пользуясь методом электронно-ионных полуреакций в следующих окислительно-восстановительных реакциях:
1. Na2SO3 + КМnО4 + H2O Na2SO4 + МnО2 + КОH
2. NaCrO2 + H2O2 + KOH Na2CrO4 + K2CrO4 + H2O
3. Mn(NO3)2 + РbO2 + HN03 HMnO4 + РЬ(N03)2 + H2O.
Решение:
1. В молекулярной схеме реакции определяем изменение степени окисления, находим окислитель и восстановитель:
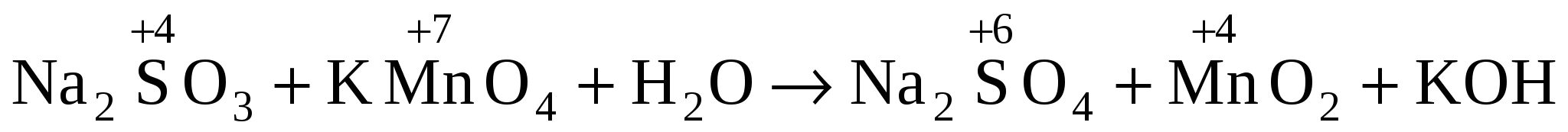
в-ль о-ль среда
Составляем электронно-ионные полуреакции сначала для процесса окисления, а затем для процесса восстановления, учитывая закон сохранения массы и заряда и правила стяжения:
 3 SO32– + H2O – 2e SO42– + 2Н+ o-e, в-ль 3 SO32– + H2O – 2e SO42– + 2Н+ o-e, в-ль
2 МnО4– + 2H2O + 3е МnO2 + 4OH- в-е, о-ль
Умножаем на полученные множители обе полуреакции и суммируем:
3 SO32– + 2 МnО4– + 7 H2O 3 SO42– + 2 МnO2 + 8 OH– + 6 Н+.
После преобразования ионное уравнение реакции будет иметь следующий вид:
3 SO32– + 2 МnО4– + H2O → 3 SO42– + 2 МnO2 + 2 OH–.
В молекулярной форме это уравнение запишется следующим образом:
3 Na2SO4 + 2 КМnО4 + H2O = 3 Na2SO4 + 2 МnО2 + 2 КОH.
2. 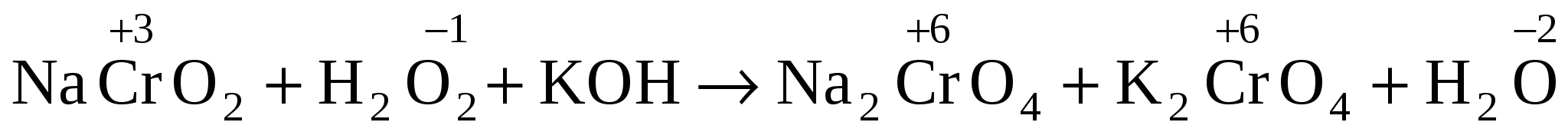 . .
 2 CrO2– + 4OH– – 3e CrO42– + H2O о-е; в-ль 2 CrO2– + 4OH– – 3e CrO42– + H2O о-е; в-ль
3 H2O2 + 2e 2 OH– в-е, о-ль
Для перехода CrO2– в ион CrO42– необходим кислород, который в щелочной среде выделяется из гидроксид-ионов (2ОН– → О2– + Н2О). Восстановление H2O2 в щелочной среде идет с образованием ионов OH–.
Умножаем на полученные множители обе полуреакции и суммируем:
2CrO2– + 3H2O2 + 8OH– 2CrO42– + 4H2O + 6OH–.
После преобразования ионное уравнение реакции следующее:
2 CrO2– + 3 H2O2 + 2 OH– → 2 CrO42– + 4 H2O.
На основе ионного уравнения запишем уравнение реакции в молекулярной форме:
2 NaCrO2 + 3 H2O2 + 2 KOH Na2CrO4 + K2CrO4 + 4 H2O.
3. 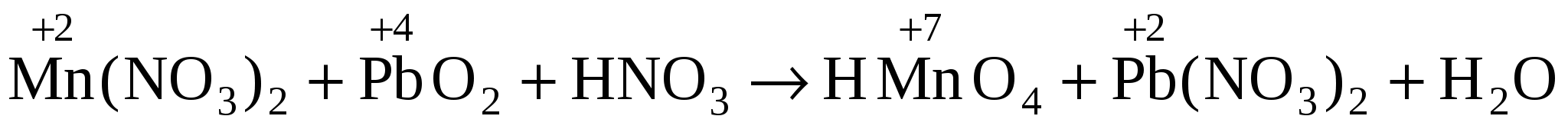 . .

2 Mn+2 + 4 H2O – 5е MnO4– + 8 Н+ o-e, в-ль
5 РbO2 + 4 Н+ + 3е Рb2+ + 2 H2O в-е, о-ль
После преобразования ионное уравнение реакции будет иметь вид:
2 Mn+2 + 5 РbO2 + 4 Н+ = 2 MnO4– + 5 Рb2+ + 2 H2O.
2 Mn(NO3)2 + 5 РbO2 + 6 HNO3 = 2 HMnO4 + 5 Рb(NO3)2 + 2H2O.
В рассмотренных реакциях взаимодействуют вещества, одно из которых служит окислителем, а другое - восстановителем, третье - средой. Такие реакции относятся к реакциям межмолекулярного окисления-восстановления. Реакция 330(1) служит примером реакций самоокисления - самовосстановления (диспропорционирования), в которых функции окислителя и восстановителя выполняет один и тот же элемент. В реакции 330(2) оба элемента (восстановитель и окислитель) входят в состав одного и того же исходного вещества. Реакции такого типа называются реакциями внутримолекулярного окисления-восстановления.
При выполнении задания рекомендуется использовать методические указания [4].
В задачах 330–391 определить восстановитель и окислитель, расставить коэффициенты, пользуясь методам электронно-ионных или электронных полуреакций
№
задачи
|
Уравнение окислительно-востановительной реакции
|
330
|
S + KOH K2SO3 + K2S + H2O
(NH4)2Cr2O7 N2 + Cr2O3 + H2O
Cu + HNO3 Cu(NO3)2 + NO + H2O
|
331
|
H3PO3 + AgNO3 + H2O H3PO4 + Ag + HNO3
NaBrO3 + NaBr + H2SO4 Br2 + Na2SO4 + H2O
MnO2 + KClO3 + KOH K2MnO4 + KCl + H2O
|
332
|
NaHSO3 + Cl2 + H2O NaHSO4 + HCl
H2Se + K2Cr2O7 + H2SO4 Se + Cr2(SO4)3 + K2SO4 + H2O
Cr(OH)3 + Br2 + KOH K2CrO4 + KBr +H2O
|
333
|
P + HNO3 + H2O H3PO4 +NO
H2O2 + KMnO4 + KOH O2 + K2MnO4 + H2O
NaBr + NaBrO3 + HNO3 Br2 + NaNO3 + H2O
|
334
|
HNO2 + Br2 + H2O HNO3 + HBr
As2S3 + H2O2 + NH4OH (NH4)3AsO4 + (NH4)2SO4 + H2O
MnSO4 + NaBiO3 + HNO3 HMnO4 + Na2SO4 + Bi(NO3)3 + Н2О
|
335
|
Se + HNO3 + H2O H2SeO3 + NO
Cr2(SO4)3 + Br2 + KOH K2CrO4 + KBr + K2SO4 + H2O
Hg + NaNO3 + H2SO4 Na2SO4 + Hg2SO4 + NO +H2O
|
334
|
As2Se5 + HNO3 + H2O H3AsO4 + H2SeO4 +NO
AsH3 + KMnO4 + H2SO4 H3AsO4 + MnSO4 + K2SO4 + H2O
Cr2(SO4)3 + H2O2 + KOH K2CrO4 + K2SO4 + H2O
|
335
|
Na2SO3 + KMnO4 + H2O MnO2 + Na2SO4 + KOH
NaCrO2 + H2O2 + NaOH Na2CrO4 + H2O
Mn(NO3)2 + PbO2 + HNO3 HMnO4 + Pb(NO3)2 + H2O
|
336
|
Na2SO3 + K2Cr2O7 + H2SO4 Na2SO4 + Cr2(SO4)3 + K2SO4 + H2O
NaAsO2 + I2 + Na2CO3 + H2O NaH2AsO4 + NaI + CO2
Br2 + NaOH NaBrO3 + NaBr + H2O
|
337
|
Ca(ClO)2 + NaBr + H2O CaCl2 + Br2 + NaOH
Na2SeO3 + F2 + NaOH Na2SeO4 +NaF + H2O
PH3 + KMnO4 + H2SO4 H3PO4 + MnSO4 + K2SO4 +H2O
|
338
|
Na3AsO3 + I2 + H2O Na3AsO4 + HI
MnO2 + KNO3 + KOH K2MnO4 + KNO2 + H2O
K2S + NaOCl + H2SO4 S + K2SO4 + NaCl + H2O
|
339
|
Fe(CrO2)2 + Cl2 + K2CO3 FeCl3 + K2CrO4 + KCl + CO2
KI + KIO3 + H2SO4 I2 + K2SO4 + H2O
MnCl + KBrO + KOH MnO2 + KBr + KCl + H2O
|
340
|
CrCl3 + Br2 + KOH K2CrO4 + KBr + KCl + H2O
FeS2 + HNO3 Fe(NO3)3 + NO + H2SO4 + H2O
K4[Fe(CN)6] + Br2 K3[Fe(CN)6] + KBr
|
341
|
NaCrO2 + H2O2 + NaOH Na2CrO4 + H2O
Co(OH)2 + O2 + H2O Co(OH)3
Zn + HNO3 Zn(NO3)2 + NH4NO3 + H2O
|
342
|
PH3 + KClO3 + KOH KCl + K3PO4 + H2O
KNO3 + Na2Cr2O7 + HCl KNO3 + CrCl3 + NaCl + H2O
Al + NaOH + H2O Na[Al(OH)4] + H2
|
343
|
Ni(OH)2 + Br2 + H2O Ni(OH)3 + HBr
CrBr3 + H2O2 + KOH K2CrO4 + KBr + H2O
Au + HCl + HNO3 H[AuCl4] + NO + H2O
|
344
|
H2O2 + AgNO3 + NH4OH O2 + Ag + NH4NO3 + H2O
Na3AsO3 + K2Cr2O7 + H2SO4Na3AsO4 + Cr2(SO4)3 + K2SO4 +H2O
Sb2S5 + HNO3 + H2O H3SbO4 + H2SO4 + NO
|
345
|
NaOCl + KI + H2SO4 NaCl + I2 + K2SO4 + H2O
Na2SnO2 + Bi(OH)3 Na2SnO3 + Bi + H2O
AsH3 + AgNO3 + H2O H3AsO4 + Ag + HNO3
|
346
|
Sb2S3 + H2O2 + NaOH Na3SbO4 + Na2SO4 + H2O
Fe2(SO4)3 + KI I2 + FeSO4 + K2SO4
SO2 + K2Cr2O7 + H2SO4 K2SO4 + Cr2(SO4)3 + H2O
|
347
|
Na3CrO3 + PbO2 + NaOH Na 2CrO4 + Na2PbO2 + H2O
Na2S2O3 + Cl2 + H2O H2SO4 + Na2SO4 + HCl
Al + K2Cr2O7 + H2SO4 Al2(SO4)3 + Cr2(SO4)3 + K2SO4 + H2O
|
348
|
Fe(OH)2 + O2 + H2O Fe(OH)3
Sb2O3 + Cl2 + KOH KSbO3 + KCl + H2O
K4[Fe(CN)6] + Br2 K3[Fe(CN)6] + KBr
|
349
|
Fe2O3 + KClO3 + KOH K2FeO4 + KCl + H2O
HIO3 + H2O2 I2 + O2 + H2O
FeS2 + O2 Fe2O3 + SO2
|
350
|
Mn(NO3)2+[Ag(NH3)2]OH +H2OH2MnO3+Ag + NH4NO3+ NH4OH
Na2SO3 + KMnO4 + H2SO4 MnSO4 + Na2SO4 + K2SO4 + H2O
I2 + NaOH NaIO + NaI + H2O
|
351
|
Fe(OH)3 + KClO4 + KOH K2FeO4 + KCl + H2O
NaBiO3 + MnCl2 + HCl NaMnO4 + BiCl3 + NaCl + H2O
K2MnO4 + H2O KMnO4 + MnO2 + KOH
|
352
|
Te + HClO3 + H2O H6TeO6 + Cl2
H2O2 + AgNO3 + NH4OH O2 + Ag + NH4NO3 + H2O
H2S + K2Cr2O7 + H2SO4 S + Cr2(SO4)3 + K2SO4 +H2O
|
353
|
FeCl2 + HNO3 + HCl FeCl3 + NO + H2O
AsH3 + AgNO3 + H2O Ag + H3AsO4 + HNO3
CrBr3 + H2O2 + NaOH Na2CrO4 + NaBr + H2O
|
354
|
KI + (NH4)2Cr2O7 + H2SO4 I2 + Cr2(SO4)3 + K2SO4+(NH4)2SO4+ H2O
Cl2 + I2 + H2O HIO3 + HCl
Zn + NaClO3 + NaOH Na2[Zn(OH)4] + NaCl + H2O
|
355
|
As2S5 + HNO3 H3AsO4 + H2SO4 + NO2
Ag2SeO3 + Br2 + H2O H2SeO4 + AgBr
H2O2 + AuCl3 + NaOH O2 + Au + NaCl + H2O
|
356
|
Al + KNO3 + KOH +H2O KAlO2 + NH3
Na2S2O3 + HOCl + H2O H2SO4 + NaCl + HCl
S + HNO3 H2SO4 + NO2 + H2O
|
357
|
KNO2 + KMnO4 + H2SO4 KNO3 + MnSO4 + K2SO4 +H2O
K3[Cr(OH)6] + Cl2 + KOH K2CrO4 + KCl + H2O
Br2 + SO2 + H2O HBr + H2SO4
|
358
|
Pt + HNO3 + HCl H2[PtCl6] + NO + H2O
Br2 + KOH(хол) KBrO + KBr + H2O
MnSO4 + KMnO4 + H2O MnO2 + K2SO4 + H2SO4
|
359
|
Al + HNO3(разб) Al(NO3)3 + N2 + H2O
W + NaNO3 + NaOH Na2WO4 + NaNO2 + H2O
KBrO3 + XeF2 + H2O KbrO4 + Xe + HF
|
360
|
Au + H2SeO4 Au2(SeO4)3 + SeO2 + H2O
Cl2 + KOH (гор) KCl + KClO3 + H2O
SO2 + NO2 + H2O H2SO4 + NO
|
361
|
C6H12O6 + KMnO4 + H2SO4 CO2 + MnSO4 + K2SO4 + H2O
Te2O3 + KNO3 + KOH K2TeO4 + KNO2 + H2O
As + Cl2 + H2O H3AsO4 + HCl
|
362
|
H2S + KMnO4 + H2SO4 S + MnSO4 + K2SO4 + H2O
K3[Cr(OH)6] + Br2 + KOH K2CrO4 + KBr + H2O
Be + NaOH + H2O Na[Be(OH)4] + H2
|
363
|
KBr + K2Cr2O7 + H2SO4 Br2 + Cr2(SO4)3 + K2SO4 + H2O
Ge + H2O2 + NaOH Na2GeO3 + H2O
CO + PdCl2 + H2O Pd + HCl + CO2
|
364
|
Si + HNO3 + HF H2[SiF6] + NO +H2O
Br2 + KOH (гор) KBr + KBrO3 + H2O
Co(OH)2 + NaClO + H2O Co(OH)3 + NaCl
|
365
|
FeCl2+KMnO4+H2SO4MnSO4 +FeCl3 + Fe2(SO4)3 + KCl +H2O
CuO + NH3 Cu + N2 + H2O
Ti + HNO3 + H2O H2TiO3 + NO
|
366
|
Nb + HNO3 + HF H2[NbF7] + NO + H2O
SiC + NaOH + O2 Na2SiO3 + H2O + CO2
Ni(OH)2 + Cl2 + KOH Ni(OH)3 + KCl
|
367
|
FeSO4 + HNO3 + H2SO4 Fe2(SO4)3 + NO2 + H2O
Cl2 + NaOH (гор) NaCl + NaClO3 + H2O
K2SO3 + KMnO4 + H2O MnO2 + K2SO4 + KOH
|
368
|
K2Cr2O7 + HCl (конц.) CrCl3 + Cl2 + KCl + H2O
Na3[Cr(OH)6] + Br2 + NaOH Na2CrO4 + NaBr + H2O
Zn + NaOH + H2O Na2[Zn(OH)4] + H2
|
369
|
Re + HNO3 HReO4 + NO + H2O
Cr2O3 + KClO3 + KOH K2CrO4 + KCl + H2O
CuSO4 + Na2CO3 + H2O (CuOH)2CO3 + 2Na2SO4 + CO2
|
370
|
H2C2O4 + KMnO4 + H2SO4 CO2 + MnSO4 + K2SO4 + H2O
K3ASO3 + I2 + KOH K3AsO4 + KI + H2O
Si + KOH + H2O K2SiO3 + H2
|
371
|
CH3OH + KMnO4 + H2SO4 HCOOH +MnSO4 + K2SO4 +H2O
Zn + KNO3 + KOH K2ZnO2 + KNO2 + H2O
SeO2 + SO2 + H2O H2SO4 + Se
|
372
|
Os + HNO3 [Os(H2O)2O4] + NO2 +H2O
NaBrO3 + F2 + NaOH NaF + NaBrO4 + H2O
K2S + KMnO4 + H2O S + MnO2 + KOH
|
373
|
HCl + H2SeO4 (конц.) H2SeO3 + Cl2 + H2O
Zn + AgO + KOH K2ZnO2 + Ag + H2O
Pb + KOH + H2O K4[Pb(OH)6] + H2
|
374
|
C + H2SO4 CO2 + SO2 + H2O
ClO2 + KOH KClO3 + KClO2 + H2O
As2S3 +HNO3 + H2O H3AsO4 + H2SO4 + NO
|
375
|
Zn + KMnO4 + H2SO4 ZnSO4 + MnSO4 + K2SO4 + H2O
K2SO3 + KMnO4 + KOH K2SO4 + K2MnO4 + H2O
Br2 + Cl2 + H2O HCl + HBrO3
|
376
|
KI + K3AsO4 + H2SO4 I2 + K3AsO3 + K2SO4 + H2O
Cr(OH)3 + Cl2 + NaOH Na2CrO4 + NaCl + H2O
H2S + Cl2 + H2O HCl + H2SO4
|
377
|
FeSO4 + KClO3 + H2SO4 Fe2(SO4)3 + KCl + H2O
Cr2O3 + Br2 + KOH KBr + K2CrO4 + H2O
MoO3 + Na2CO3 + H2O Na2MoO4 + NaHCO3
|
378
|
W + HNO3 + HF H2[WF8] + NO + H2O
Al + NaNO3 + NaOH + H2O NaAlO2 + NH3
NiCl2 + NaH2PO2 + H2O Ni + NaH2PO3 + H2 + HCl
|
379
|
Mo + HNO3 + HF H2[MoF8] + NO + H20
Cl2 + NaOH(хол) NaClO + NaCl + H2O
Cr2O3 + NaBrO3 + H2O Na2Cr2O7 + HCr2O7 + Br2
|
380
|
FeO + HNO3 Fe(NO3)3 + NO + H2O
Zn + NaNO3 + NaOH + H2O Na2[Zn(OH)4] + NH3
KOCl + CO2 + H2O KHCO3 + HOCl
|
381
|
MnS + HNO3 MnSO4 + NO2 + H2O
V + O2 + KOH K3[VO4] + H2O
Si + NaOH + H2O Na2SiO3 +H2
|
382
|
Cd + KMnO4 + H2SO4 CdSO4 + K2SO4 + MnSO4 +H2O
Ca3(PO4)2 + C +SiO2 CaSiO3 + P + CO
SO2 + Br2 + H2O H2SO4 + HBr
|
383
|
H3PO3 + KMnO4 + H2SO4 H3PO4 + MnSO4 + K2SO4 +H2O
KCrO2 + H2O2 + KOH K2CrO4 + H2O
SO2 + CaOCl2 + H2O CaSO4 + HCl
|
384
|
HCl + KMnO4 Cl2 + KCl +MnCl2 + H2O
Mo + NaNO3 + NaOH Na2MoO4 + NaNO2 + H2O
Au + KCN + H2O + O2 K[Au(CN)2] + KOH
|
385
|
NaJ + NaNO2 + H2SO4 NO + J2 + Na2SO4 +H2O
Cr2(SO4)3 + Cl2 + NaOH Na2CrO4 + NaCl + Na2SO4
Na2SO3 + Br2 + H2O Na2SO4 + HBr
|
386
|
V + H2SO4 (VO)SO4 + SO2 + H2O
KNO2 + KMnO4 + KOH KNO3 + K2MnO4 + H2O
XeF2 + H2O Xe + O2 +HF
|
387
|
V + HNO3 + HCl VCl4 + NO + H2O
CrCl3 + NaClO + NaOH Na2CrO4 + NaCl + H2O
SO2 + NaJO3 + H2O NaJ + H2SO4
|
389
|
PbS + HNO3(конц) PbSO4 + NO2 + H2O
Fe(OH)3 + Br2 + KOH K2FeO4 +KBr +H2O
As2S3 + HNO3 + H2O H3AsO4 + H2SO4 + NO
|
390
|
K2MnO4 + H2S MnO2 + S+ KOH
CrCl3 + KClO3 + KOH K2CrO4 + KCl + H2O
KBr +KMnO4 + H2O Br2 + MnO2 + KOH
|
391
|
FeSO4 + H2O2 + H2SO4 Fe2(SO4)3 + H2O
MnO2 + KNO3 + K2CO3 K2MnO4 + KNO2 + CO2
Sn + NaOH + H2O Na2[Sn(OH)6] + H2
|
4.2. Гальванические элементы
Гальваническими элементами называются устройства, с помощью которых химическая энергия окислительно-восстановительных процессов может быть преобразована в электрическую. В основе работы гальванических элементов лежат явления, происходящие на границе между металлом и раствором электролита и сопровождающиеся возникновением на ней разности или скачка потенциалов.
Разности или скачки потенциалов на границе металл-раствор зависят от активности катионов металла в растворе или, другими словами, каждой данной активности катионов металла в растворе соответствует определенное значение равновесного скачка потенциалов. Они называются электродными потенциалами, а их значения определяются относительно стандартного водородного электрода, принятого в качестве эталона, потенциал которого, называемый стандартным или нормальным, условно принимается равным нулю.
Всякий гальванический элемент состоит из двух электродов – металлов, погруженных в растворы электролитов; последние сообщаются друг с другом – обычно через пористую перегородку. Электрод, на котором в ходе реакции происходит процесс окисления, называется анодом; электрод, на котором осуществляется восстановление, – катодом.
При схематическом изображении гальванического элемента граница раздела между металлом и раствором обозначается вертикальной чертой, граница между растворами электролитов – двойной вертикальной чертой: Zn|Zn(NO3)2 ||AgNO3|Ag.
Максимальное напряжение гальванического элемента, отвечающее обратимому протеканию происходящей в нем реакции, называется электродвижущей силой Е (э.д.с.) элемента.
Если реакция осуществляется в стандартных условиях, т.е., если все вещества, участвующие в реакции, находятся в своих стандартных состояниях, то наблюдаемая при этом э.д.с. называется стандартной электродвижущей силой Ео данного элемента.
Э.д.с. гальванического элемента может быть представлена как разность двух электродных потенциалов φ, каждый из которых отвечает полуреакции, протекающей на одном из электродов:
Е = φAg – φZn .
Здесь φAg и φZn – потенциалы, отвечающие электродным процессам, происходящим соответственно на серебряном и цинковом электродах.
Примеры составления условий задач и их решения
Задача 399
Составить схему, написать уравнения электродных процессов и рассчитать э.д.с. элемента, состоящего из цинковой и никелевой пластин, опущенных в растворы сернокислых солей с концентрацией 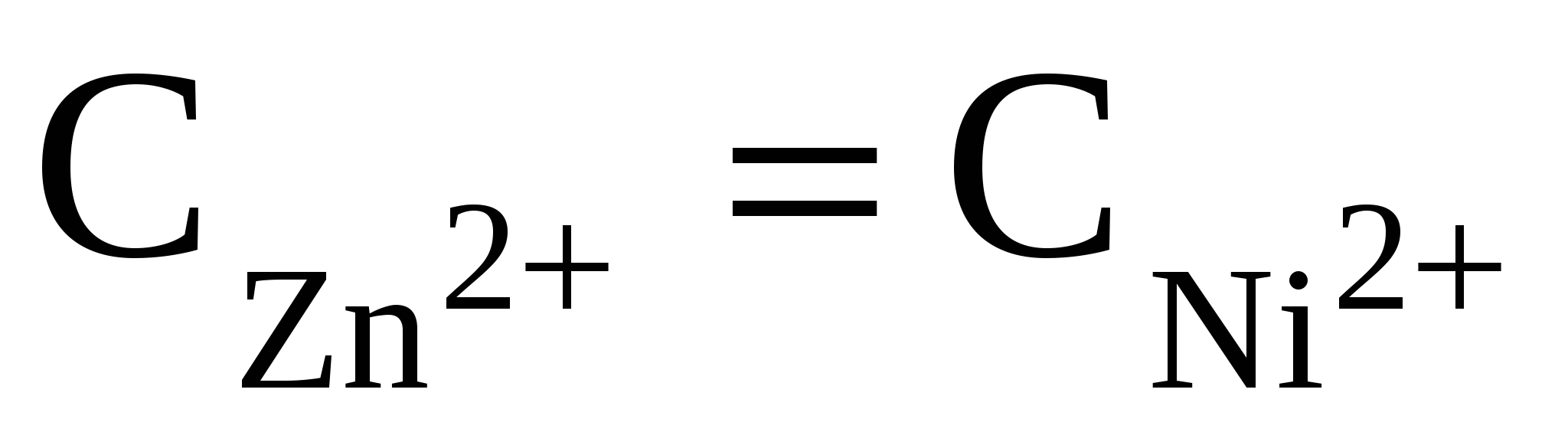 = 0,01 моль/л. = 0,01 моль/л.
Решение:
В ряду напряжений Zn стоит левее Ni, поэтому в гальваническом элементе отрицательным (анодом) будет цинковый электрод, а положительным (катодом) - никелевый.
Схема гальванического элемента
(-) ZnZnSO4NiSO4Ni (+).
При работе элемента протекают реакции:
на аноде Zn Zn2+ + 2e,
на катоде Ni2+ + 2e Ni.
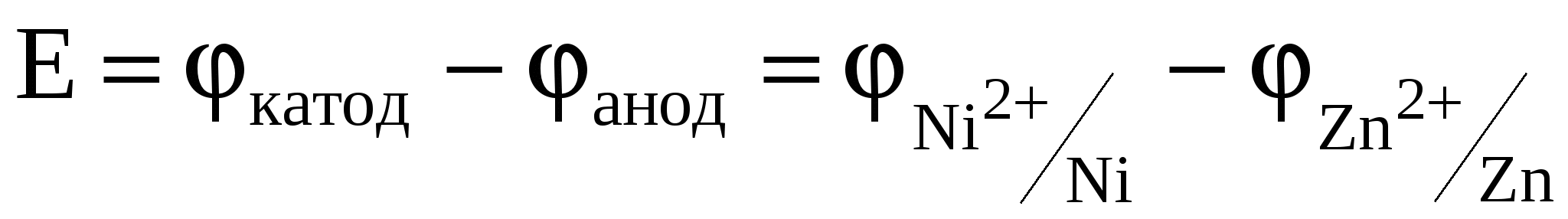
Электродные потенциалы необходимо вычислить по уравнению Нернста:
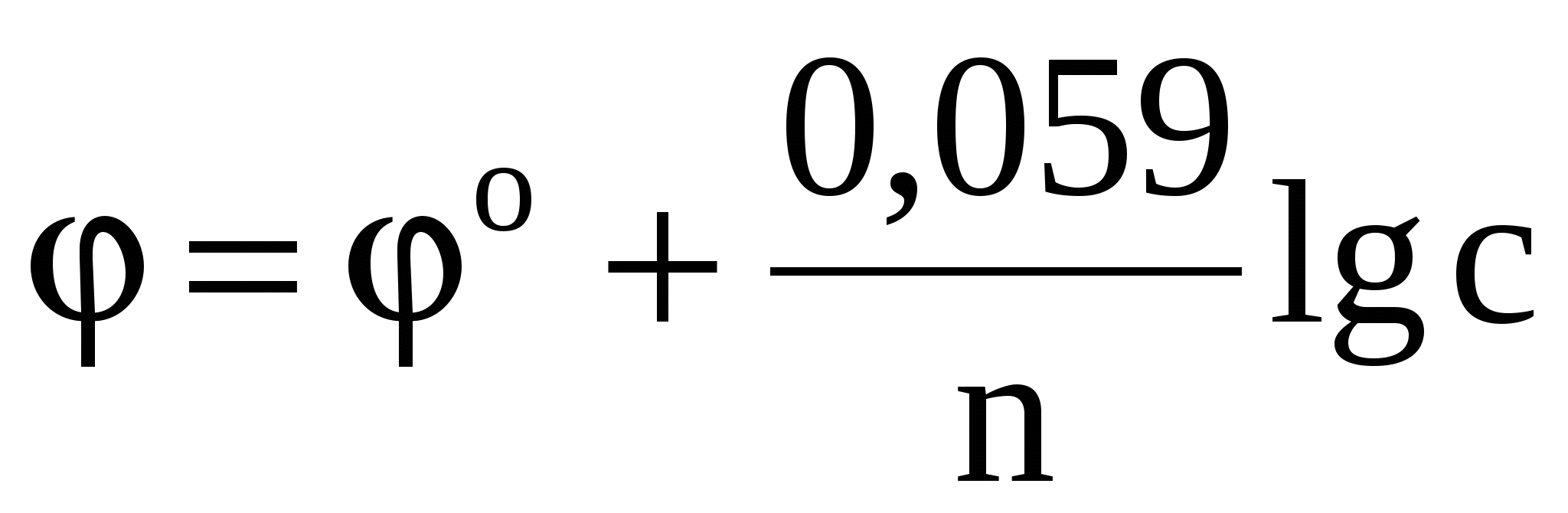 . .
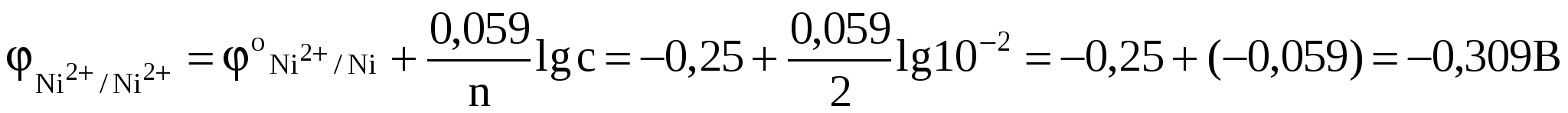 . .
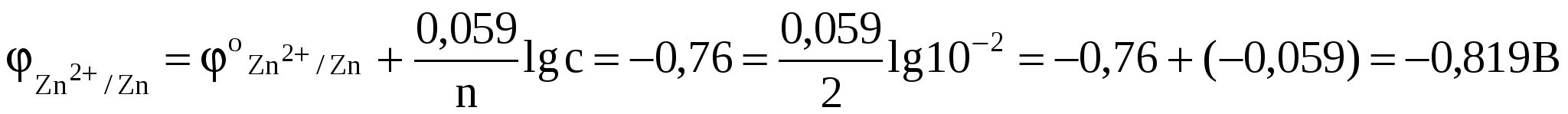 . .
Отсюда Е = -0,309 - (-0,819) = 0,51 В.
С учетом того, что число электронов, переносимых во время электрохимической реакции металлами, одинаково и концентрации растворов равны, уравнение упрощается и принимает вид
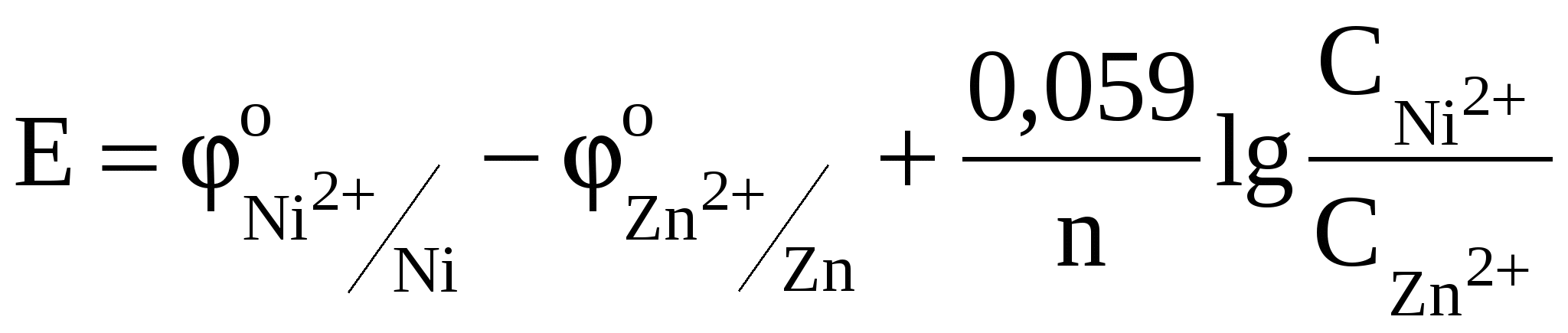 ; ; 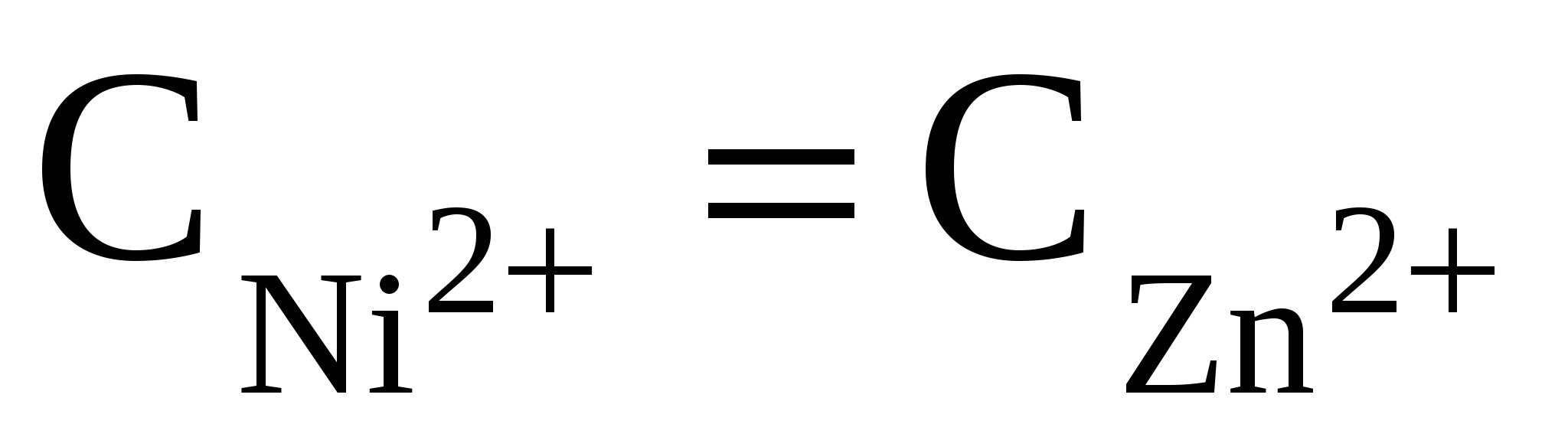 ; ;
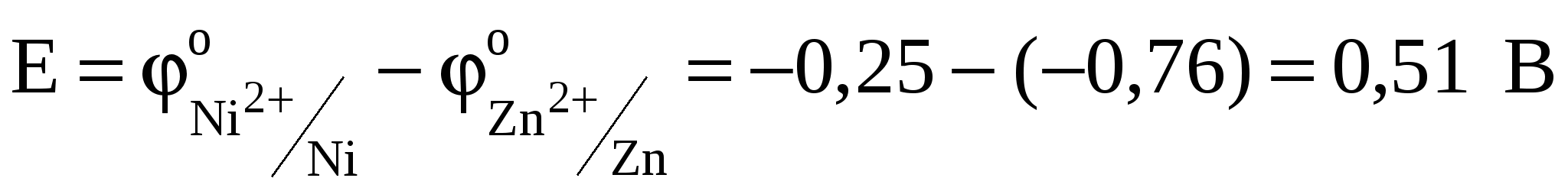 . .
Гальванический элемент может быть составлен не только из различных, но и из одинаковых электродов, погруженных в растворы одного и того же электролита, различающиеся только концентрацией (концентрационные гальванические элементы). Э.д.с. такого элемента также равна разности потенциалов составляющих его электродов.
Электрод, погруженный в более концентрированный раствор, положителен по отношению к другому, который погружен в более разбавленный раствор. |
|
|
 Скачать 2.12 Mb.
Скачать 2.12 Mb. 3 SO32– + H2O – 2e SO42– + 2Н+ o-e, в-ль
3 SO32– + H2O – 2e SO42– + 2Н+ o-e, в-ль 2 CrO2– + 4OH– – 3e CrO42– + H2O о-е; в-ль
2 CrO2– + 4OH– – 3e CrO42– + H2O о-е; в-ль
