наталье. Поступательное движение. Основные величины кинематики поступательного движения. Поступательное движение
 Скачать 2.32 Mb. Скачать 2.32 Mb.
|
|
E = const 8. Основные положения молекулярно-кинетической теории. Параметры состояния газа. Опытные газовые законы: Бойля-Мариотта, Гей-Люссака, Шарля, Клапейрона, Авогадро, Дальтона. В основе молекулярно-кинетической теории лежат три основных положения: Все тела (вещества) состоят из частиц (молекул, атомов, ионов...), между которыми есть промежутки. Атомы и молекулы находятся в непрерывном хаотическом движении. Частицы взаимодействуют друг с другом силами, имеющими электрическую природу. Гравитационное взаимодействие между частицами пренебрежимо мало. К основным параметрам состояния газов относятся: давление, абсолютная температура и удельный объем. Давление — физическая величина, численно равная отношению нормальной составляющей силы к площади, на которую действует эта сила. Единицей давления в СИ является паскаль (Па). Для измерения давления применяют высоту столба жидкости (воды, ртути, спирта) в капилляре, если давление небольшое. При этом давление рассчитывается по формуле: где ρ - плотность вещества (жидкости) в кг/м3, g = 9,80665 (м/c2) - ускорение свободного падения, соответственно: Удельным объемом Vu называют величину, обратную плотности ρ: 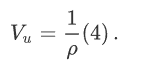 В системе СИ за единицу количества вещества принят моль. Количество одинаковых частиц, содержащихся в одном моле, называют постоянной (числом) Авогадро NA = 6,022⋅1023 моль−1. Температура, измеряемая в кельвинах, называется абсолютной. Связью между абсолютной температурой и температурой по Цельсию отражает выражение: Опытные газовые законы: Бойля-Мариотта, Гей-Люссака, Шарля, Клапейрона, Авогадро, Дальтона. 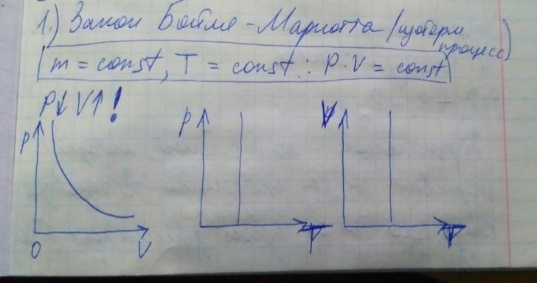 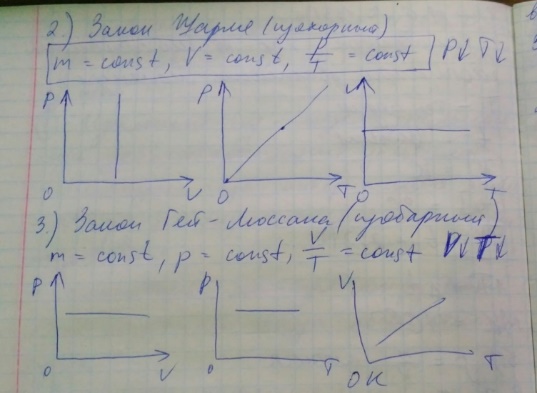 Закон Дальтона Давление газовой смеси равно сумме парциальных давлений газов, входящих в газовую смесь. P = P1+P2+Pn Парциальное – это давление, которое оказывал бы газ, входящий в газовую смесь, если бы он один занимал объем всей газовой смеси. Закон Авогадро При одинаковом давлении и температуре моли любых газов занимают одинаковый объем. При нормальных условиях: P = 105 Па, Т = 273 К, VM = 22,4 * 10-3 м3/моль. Закон Клапейрона 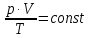 9. Уравнение Менделеева-Клапейрона. Основное уравнение молекулярно-кинетической теории и следствия из него.  Где R – универсальная газовая постоянная (8,31 Дж/моль*К) 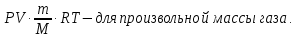 Основное уравнение МКТ: 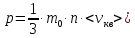 Где m0 – масса молекулы, n – число молекул в единице объема (1/м3),  10. Число степеней свободы. Закон Больцмана. Внутренняя энергия идеального газа и её изменение. Работа газа при изменении его объёма. Число степеней свободы - число независимых координат, определяющих положение тела в пространстве. i- число степеней свободы 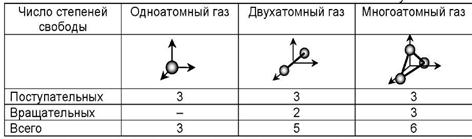 Закон Больцмана -на каждую степень свободы приходится в среднем одинаковая энергия. < 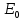 >= >=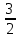 kT -средняя кинетическая энергия поступательного движения одной молекулы. kT -средняя кинетическая энергия поступательного движения одной молекулы.< 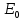 >= >=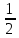 kT -средняя кинетическая энергия, приходящаяся на одну степень свободы. kT -средняя кинетическая энергия, приходящаяся на одну степень свободы.< 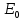 >= >= kT -средняя кинетическая энергия движения одной молекулы. kT -средняя кинетическая энергия движения одной молекулы.Под внутренней энергией вещества понимают сумму кинетической энергии движения всех молекул и потенциальной энергии их взаимодействия. Т.к. молекулы идеального газа не взаимодействуют друг с другом, то их 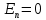 , поэтому под внутренней энергией идеального газа понимают кинетическую энергию поступательного и вращательного движений всех молекул. , поэтому под внутренней энергией идеального газа понимают кинетическую энергию поступательного и вращательного движений всех молекул.U- внутренняя энергия [U]=Дж 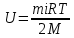 ΔU= 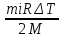 -изменение внутренней энергии -изменение внутренней энергииВнутренняя энергия изменяется только тогда, когда изменяется температура. ΔU>0 при T↑ ΔU<0 при T↓ Под работай газа понимают часть внутренней энергии, которая передается от одного тела к другому при теплообмене в виде упорядоченной формы движения молекул. A –полная работа при изменении объема от 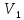 до до 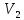 [A]=Дж А= 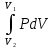 Работа газа при изменении его объёма А>0, если газ совершает ее против внешних сил V↑ A<0, если работа совершается над газом V↓ 11. Количество теплоты. Удельная и молярная теплоемкости. Молярная теплоемкость при постоянном объёме и постоянном давлении. Уравнение Майера. Коэффициент Пуассона. Под количеством теплоты понимают часть внутренней энергии, которая передается при теплообмене от одного тела к другому в виде беспорядочной формы движения молекул. Q –количество теплоты [Q]=Дж Q=mcΔT, m -масса газа ΔT -изменение температуры с – удельная теплоемкость Удельная теплоемкость –количество теплоты необходимое для нагревания 1кг вещества на 1К. С -удельная теплоемкость [C]= 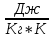 C= 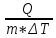 Молярная теплоемкость –количество теплоты необходимое для нагревания 1кг вещества на 1К. 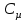 -молярная теплоемкость -молярная теплоемкость[ 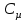 ]= ]=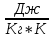  -связь удельной и молярной теплоемкостей -связь удельной и молярной теплоемкостейМолярная теплоемкость при постоянном объёме и постоянном давлении. Теплоемкости зависят от рода вещества и от условий, при которых газ нагревают: при постоянном объеме и давлении. 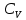 ( ( ) –удельная теплоемкость (молярная теплоемкость) при изохорном процессе. ) –удельная теплоемкость (молярная теплоемкость) при изохорном процессе. = =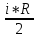 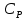 ( (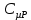 ) –удельная теплоемкость (молярная теплоемкость) при постоянном давлении. ) –удельная теплоемкость (молярная теплоемкость) при постоянном давлении.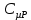 = =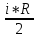 +R= +R=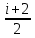 *R *RУравнение Майера. 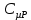 = = +R +RКоэффициент Пуассона. ɣ -коэффициент Пуассона [ɣ]-- ɣ= 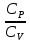 = =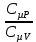 = =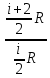 = = 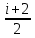 12. Первое начало термодинамики. Адиабатический процесс. Закон Пуассона. Применение первого начала термодинамики к различным процессам. Первое начало термодинамики - количество теплоты, передаваемое газу, идет на изменение его внутренней энергии и на совершение газом работы против внешних сил. Q= ΔU+A ΔU= 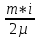 R ΔT A= R ΔT A=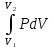 Q>0 -если тепло проводится сразу Q<0 -если тепло отводится от газа ΔU>0 -если температура увеличивается ΔU<0 -если температура уменьшается A>0 -если работа совершается газом против внешних сил, при этом объем увеличивается A<0 -если работа совершается над газом внешними силами, при этом объем уменьшается Адиабатический процесс –без теплообмена газа с окружающей средой. К адиабатным относятся быстро протекающие процессы. Закон Пуассона. 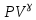 = const = const 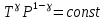 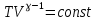 Применение первого начала термодинамики к различным процессам. План применения первого начала термодинамики. 1.Условие протекания процесса 2. закон или уравнение, которым описывается этот процесс 3.Графическое изображение 4.Формула работы 5. Формула изменения внутренней энергии 6. Первое начало термодинамики 7. Формула количества теплоты Изотермический процесс 1. T=const 2. PV=const 3.  4. A= 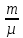 RT*ln RT*ln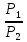 5. ΔU=0 6. Q=A –для изотермического расширения -Q=-A –для изотермического сжатия 7.Q= 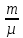 RT*ln RT*ln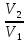 Изохорный процесс 1. V=const 2. 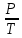 =const =const3. 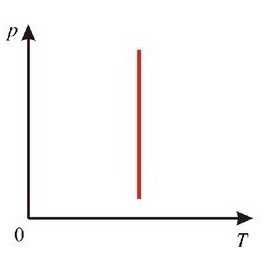 4. A= 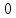 5. ΔU= 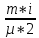 RΔT RΔT6. Q= ΔU –для изохорического нагревания -Q=- ΔU –для изохорического охлаждения 7. Q= 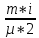 RΔT= RΔT=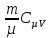 ΔT ΔTИзобарный процесс 1. P=const 2. 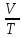 =const =const3. 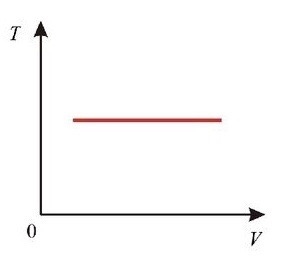 4. A= 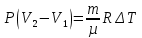 5. ΔU= 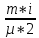 RΔT RΔT6. Q= ΔU +A –для изобарного расширения -Q=- ΔU -A –для изобарного сжатия 7.Q= 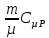 ΔT ΔTАдиабатный процесс 1. Q=const 2. 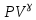 =const =const3. 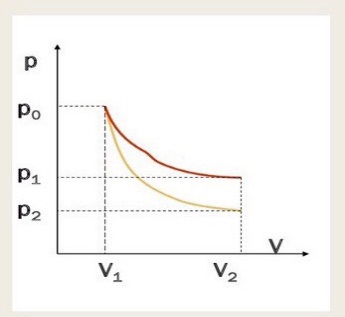 4. A= 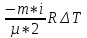 5. ΔU= 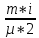 RΔT RΔT6. Q= ΔU +A ΔU =-A –для адиабатного сжатия -ΔU =A –для адиабатного расширения 7.Q= 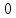 13. Цикл Карно и его КПД. Второе начало термодинамики. В 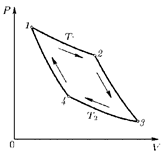 торое начало термодинамики – теплота не может самопроизвольно переходить от тела менее нагретого к телу более нагретому. Под теплотой понимается внутренняя энергия тела. торое начало термодинамики – теплота не может самопроизвольно переходить от тела менее нагретого к телу более нагретому. Под теплотой понимается внутренняя энергия тела.Коэффициент полезного действия (КПД) определяется по формуле: Теорема Карно гласит, что коэффициент полезного действия тепловой машины, работающей по циклу Карно, зависит только от температур и нагревателя и холодильника, но не зависит от устройства машины, а также от вида рабочего вещества. Вторая теорема Карно гласит – коэффициент полезного действия всякой тепловой машины не может превосходить коэффициент полезного действия идеальной машины, работающей по циклу Карно с теми же самыми температурами нагревателя и холодильника. Цикл состоит из 4-х процессов: 2-х изотермических и 2-х адиабатических. -1-2изотермическое расширение Т1=const А12= m/μ RT1 ln V2/V1 Газ изотермически расширяется за счет подвода тепла от нагревателя -2-3адиабатическое расширение Q=0 А23= -m/μ i/2 R (T2-T1) Газ адиабатически расщиряется за счет уменьшения внутренней энергии (перво нначало термодинамики) -3-4изотермическое сжатие T2=const А34= m/μ RT2 ln V4/V3 Изотермически сжимается за счет теплоты холодильника -4-1адиаботическое сжатие А41= -m/μ i/2 R (T1-T2)=(T2-T1) Газ адиабатически сжимается за счет внешних сил,при этом внутренняя энергия газа увеличивается. А-работа газа за весь цикл A=Qн-Qх-второе начало термодинамики
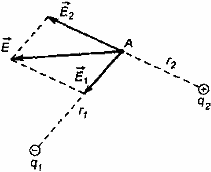 14. Закон сохранения заряда. Закон Кулона. Диэлектрическая проницаемость среды. Электростатическое поле и его напряженность. Силовые линии. Принцип суперпозиции. Силовые линии-это линии каждые точки которых касательные совпадают с вектором магнитной индукции. Силовые линии магнитного поля, всегда замкнутые, этим они отличаются от силовых линий электростатического поля, которые разомкнутые. Силовые линии прямого тока –концентрация окружности с центрами на оси проводника, направление которых определяется по правилу Буравчика. Закон сохранения электрического заряда. Эл заряд сохраняется для изолированных систем. Алгебраическая сумма эл. Зарядов изолированной системы остается постоянной. |
