ацетальдегид расчет. Проект узла синтеза ацетальдегида из этилена в присутствии хлористого палладия
 Скачать 156.51 Kb. Скачать 156.51 Kb.
|
3.2 Расчет основных расходных коэффициентовС учетом 2% потерь на стадии ректификации получаем ацетальдегида на стадии синтеза: 255,7∙100/(100-2) = 260,9 кмоль/ч или 11479,5 кг/ч. Основные расходные коэффициенты (в кг/кг) рассчитываются по данным таблицы 8: по этилену: 8187,3 / 11479,5 = 0,7132; по техническому этилену: 81996,7 / 11479,5 = 0,7139; по воздуху: 29415,9 / 11479,5 = 2,56; по хлороводороду: 292,9 / 11479,5 = 0,0255. 3.3 Тепловой расчет аппарата3.3.1 Тепловой расчет реактора РТ1Исходные данные: составы материальных потоков представлены в таблице 9; температура: катализаторного раствора на входе в реактор 108ºС; на выходе из реактора 112 ºС. Цель расчета – определение температуры поступающего этилена. Уравнение теплового баланса в общем виде: Ф1+Ф2+Ф3 = Ф4+Ф5+Фпот, (3.14) где Ф1, Ф2, Ф4, Ф5 – тепловые потоки этилена, катализаторного раствора на входе в реактор, продуктов реакции, катализаторного раствора на выходе из реактора соответственно, кВт; Ф3 – теплота экзотермических реакций, кВт; Фпот – теплопотери в окружающую среду, кВт. Тепловой поток этилена определяют из уравнения теплового баланса: Ф1 = (Ф4 +Ф5+Фпот) – (Ф2+ Ф3). Среднюю удельную теплоемкость катализаторного раствора рассчитывают при температуре Т = 108 + 273 = 381 К (хлорид палладия, хлорид меди и хлороводород объединяют в один поток «хлорид меди»). Удельные теплоемкости компонентов рассчитывают по значениям молярных теплоемкостей, определенных по справочнику [27]. ск.р. = 0,555∙0,1390+2,057∙0,033+4,248∙0,8280 = 3,662 кДж/(кг∙К). Ф2 = (1169218,5/3600) ∙ 3,662∙108 = 128450,3 кВт. Определяют теплоту целевой реакции. Значения энтальпий образования находят по справочнику [27].  Рассчитываем теплоту экзотермической реакции Ф3. С целью упрощения расчета вводим коэффициент, учитывающий увеличение теплоты за счет побочных реакций на 6,5%:  Среднюю удельную теплоемкость продуктов реакции определяем, сделав следующие допущения: в поток «ацетальдегид» объединены все кислородсодержащие органические соединения; в поток «трихлорметан» объедены все хлорорганические соединения; в поток «этилен» объединены этилен и полимеры.  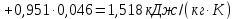 Ф4 = (7663,2/3600) ∙1,518∙112 = 361,9 кВт. Рассчитываем Ф5 (допуская, что средняя удельная теплоемкость катализаторного раствора практически не изменяется в ходе процесса): Ф5 = (1166098,3/3600)∙3,662∙1132 = 132853,5 кВт. Принимаем, что теплопотери составляют 3,5 % от общего расхода теплоты, тогда общий расход теплоты равен: Фрасх = (361,9+132853,5)∙100/(100-3,5) = 138047,0 кВт. Определяем теплопотери в окружающую среду: Фпот = 138047,0 – (361,9+132853,3) = 4831,6 кВт. Рассчитываем тепловой поток этилена: Ф1 = 138047,0 – (128450,3+ 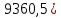 = 236,2 кВт. = 236,2 кВт.Определяем температуру подогрева этилена методом линейной интерполяции. Принимаем температуру подогрев t’x = 90 ºC, тогда теплоемкость этилена при Т= 90 + 273 = 363 К составит: С0р=50,607 Дж/(моль∙К) или с = 1807,17 Дж/(кг∙К). Рассчитываем тепловой поток этилена Фˈ1 = (4553,4/3600)∙1807,17∙90 = 205,7 кВт. Так как Фˈ1 меньше Ф1, принятая температура подогрева недостаточна. Принимаем температуру подогрева t’ˈx = 120 ºC, тогда теплоемкость этилена при Т= 120 + 273 = 393 К составит с = 1,908 Дж/(кг∙К), а тепловой поток этилена: Фˈˈ1 = (4553,4/3600)∙1,908∙120 = 289,6 кВт. Так как Фˈˈ1 больше Ф1, принятая температура подогрева слишком высокая. Необходимое значение температуры находим интерполяцией: tx = 90 +[(236,2-205,7)/(289,6 – 205,7)]∙(120-90) = 100,9 ºC. Такое значение температуры соответствует оптимальному технологическому режиму. Составляем таблицу теплового баланса реактора РТ1, таблица 12. Таблица 12 - Тепловой баланс РТ1.
|
