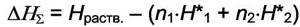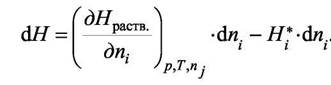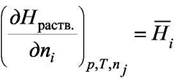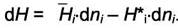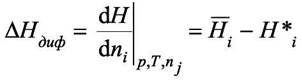Пояснительная записка. Реферат Дисциплина тема студент гр нмт202203 Тихомиров Захар Проверил преподаватель кафедры Истории России Бармин А. В
 Скачать 240.95 Kb. Скачать 240.95 Kb.
|
|
ФГАОУ ВПО «Уральский Федеральный Университет имени первого Президента России Б.Н.Ельцина» Институт новых материалов и технологий Департамент металлургии и металловедения Реферат Дисциплина: «» Тема: «» Выполнил: студент гр НМТ-202203 Тихомиров Захар Проверил: преподаватель кафедры Истории России Бармин А.В. Екатеринбург 2021 Природа процесса растворения сложна. Естественно, возникает вопрос, почему некоторые вещества легко растворяются в одних растворителях и плохо растворимы или практически нерастворимы в других. Образование растворов всегда связано с теми или иными физическими процессами. Одним из таких процессов является диффузия растворенного вещества и растворителя. Благодаря диффузии частицы (молекулы, ионы) удаляются с поверхности растворяющегося вещества и равномерно распределяются по всему объему растворителя. Именно поэтому в отсутствие перемешивания скорость растворения зависит от скорости диффузии. Однако нельзя лишь физическими процессами объяснить неодинаковую растворимость веществ в различных растворителях. Великий русский химик Д. И. Менделеев (1834—1907) считал, что важную роль при растворении играют химические процессы. Он доказал существование гидратов серной кислоты. Н2SО4Н2О, Н2SО42Н2О, Н2SО44Н2О и некоторых других веществ, например, С2Н5ОНЗН2О. В этих случаях растворение сопровождается образованием химических связей частиц растворяемого вещества и растворителя. Этот процесс называется сольватацией, в частном случае, когда растворителем является вода, – гидратацией. Как установлено, в зависимости от природы растворенного вещества сольваты (гидраты) могут образовываться в результате физических взаимодействий: ион-дипольного взаимодействия (например, при растворении веществ с ионной структурой (NаСI и др.); диполь-дипольного взаимодействия – при растворении веществ с молекулярной структурой (органические вещества)). Химические взаимодействия осуществляются за счет донорно-акцепторных связей. Здесь ионы растворенного вещества являются акцепторами электронов, а растворители (Н2О, NН3) – донорами электронов (например, образование аквакомплексов), а также в результате образования водородных связей (например, растворение спирта в воде). Доказательствами химического взаимодействия растворенного вещества с растворителем являются тепловые эффекты и изменение окраски, сопровождающие растворение. Например, при растворении гидроксида калия в во–де выделяется теплота: КОН + хН2О = КОН(Н2О)х; ΔН°раств = –55 кДж/моль. А при растворении хлорида натрия теплота поглощается: NаСI + хН2О = NаСI(Н2О)х; ΔН°раств = +3,8 кДж/моль. Теплота, выделяемая или поглощаемая при растворении 1 моля вещества, называется теплотой растворения Qраств В соответствии с первым началом термодинамики. Qраств = ΔНраств, Где ΔНраств – изменение энтальпии при растворении данного количества вещества. Растворение в воде безводного сульфата меди белого цвета приводит к появлению интенсивной голубой окраски. Образование сольватов, изменение окраски, тепловые эффекты, как и ряд других факторов, свидетельствуют об изменении химической природы компонентов раствора при его образовании. Таким образом, в соответствии с современными представлениями, растворение – физико-химический процесс, в котором играют роль как физические, так и химические виды взаимодействия. Уже говорилось о том, что образование неидеальных растворов сопровождается выделением или поглощением тепла. Тепловой эффект процесса при конечном изменении состава раствора называется интегральной теплотой растворения. Соответственно бесконечно малое изменение состава раствора сопровождается дифференциальной теплотой растворения. Для теплоты образования раствора при смешении двух чистых жидкостей имеем:
где 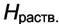 - энтальпия раствора. Тогда интегральная теплота - энтальпия раствора. Тогда интегральная теплотарастворения определяется как 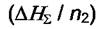 а интегральная теплота а интегральная теплотаразведения- 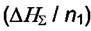 Добавим к раствору i - го компонента при постоянных давлении и температуре dni молей. Изменение энтальпии будет равно разности между приращением энтальпии раствора и энтальпией добавляемого вещества:
Но величина 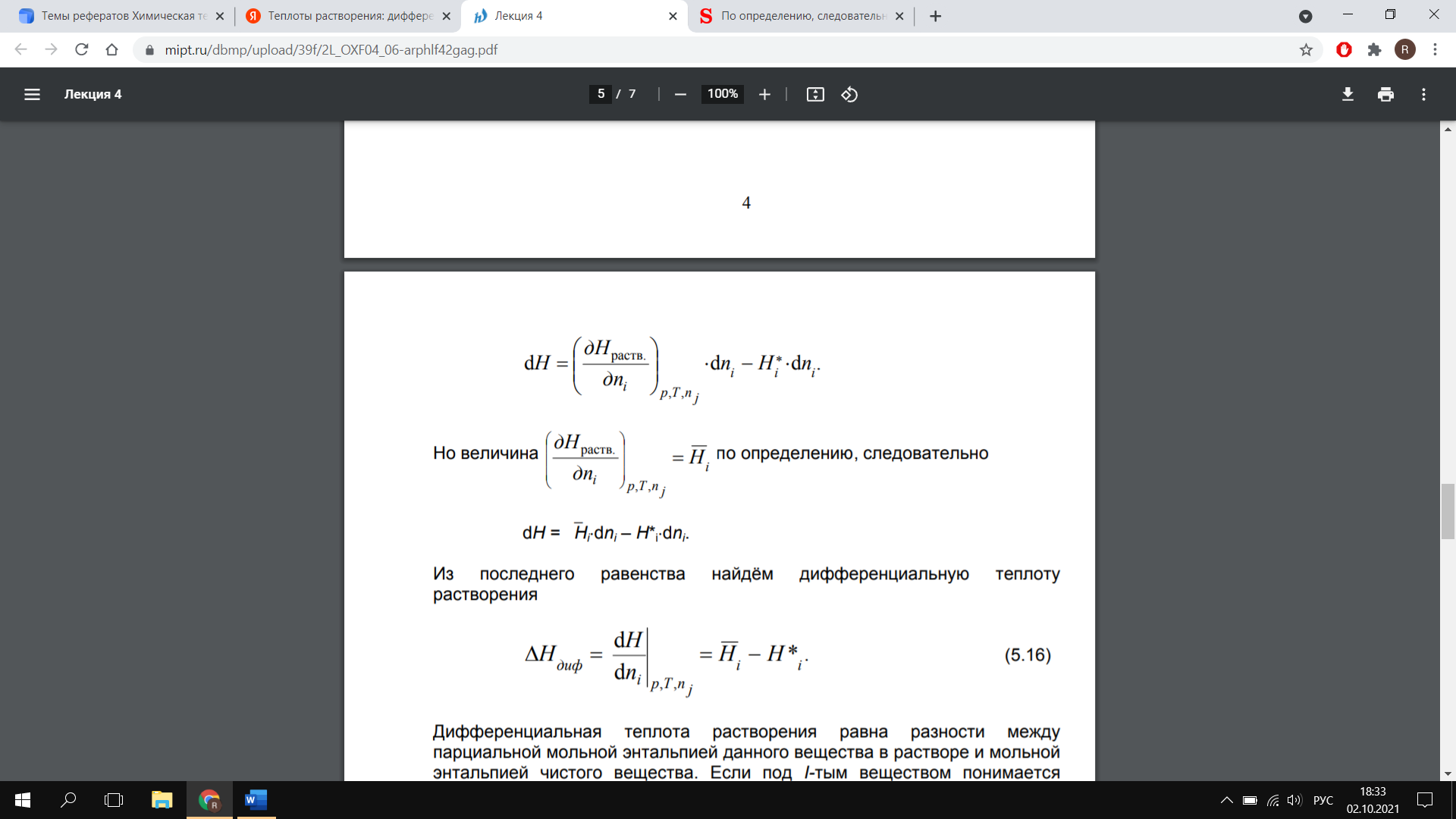 по определению, следовательно по определению, следовательно
Из последнего равенства найдём дифференциальную теплоту растворения
(5.16) Дифференциальная теплота растворения равна разности между парциальной мольной энтальпией данного вещества в растворе и мольной энтальпией чистого вещества. Если под I-тым веществом понимается растворитель, то (5.16) определяет дифференциальную теплоту разбавления. Зависимость теплоты растворения от агрегатного состояния компонентов раствора ▪ Теплота растворения твердых тел в жидкости складывается из тепловых эффектов разрушения кристаллической решетки и сольватации ионов: ΔHраств.= ΔHкр.реш.+ ΔHсольв. (< 0 >) ΔHКР.РЕШ. > 0 ΔHСОЛЬВ. < 0 ▪ Теплоnта растворения жидкости в жидкости (теплота смешения) обуславливается взаимодействием частиц растворяемого вещества с молекулами растворителя, т.е. процессом сольватации: ΔHСМЕШ. = ΔHСОЛЬВ. < 0 |