Ряд стандартных электродных потенциалов окислительно-восстановительных (О-В) систем в водных растворах при Т = 298 К (по отношению к стандартному водородному электроду)
О-В система (сопряженная пара)
|
Схема, или условная запись электрода
|
Уравнение электродного процесса
|
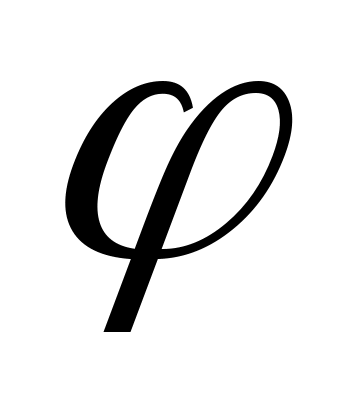 0, В 0, В
|
Электроды первого рода, обратимые относительно катиона
(электрохимический ряд напряжений металлов)
|
Li+/Li
|
Li+|Li
|
Li+ + e ↔Li
|
-3,045
|
K+/K
|
K+|K
|
K+ + e ↔ K
|
-2,924
|
Ba2+/Ba
|
Ba2+|Ba
|
Ba2+ + e ↔Ba
|
-2,906
|
Ca2+/Ca
|
Ca2+|Ca
|
Ca2+ + 2e ↔ Ca
|
-2,866
|
Na+/Na
|
Na+|Na
|
Na+ + e ↔ Na
|
-2,714
|
Mg2+/Mg
|
Mg2+|Mg
|
Mg2+ + 2e ↔ Mg
|
-2,363
|
Al3+/Al
|
Al3+|Al
|
Al3+ + 3e ↔ Al
|
-1,662
|
Ti2+/Ti
|
Ti2+|Ti
|
Ti2++ 2e ↔ Ti
|
-1,628
|
Ti3+/Ti
|
Ti3+|Ti
|
Ti3++ 3e ↔ Ti
|
-1,208
|
Mn2+/Mn
|
Mn2+|Mn
|
Mn2+ + 2e ↔ Mn
|
-1,180
|
Cr2+/Cr
|
Cr2+|Cr
|
Cr2+ + 2e ↔ Cr
|
-0,913
|
Zn2+/Zn
|
Zn2+|Zn
|
Zn2+ + 2e ↔ Zn
|
-0,763
|
Cr3+/Cr
|
Cr3+|Cr
|
Cr3+ + 3e ↔ Cr
|
-0,744
|
Fe2+/Fe
|
Fe2+|Fe
|
Fe2+ + 2e ↔ Fe
|
-0,440
|
Cd2+/Cd
|
Cd2+|Cd
|
Cd2+ + 2e ↔ Cd
|
-0,403
|
Co2+/Co
|
Co2+|Co
|
Co2+ + 2e ↔ Co
|
-0,277
|
Ni2+/Ni
|
Ni2+|Ni
|
Ni2+ + 2e ↔ Ni
|
-0,250
|
Sn2+/Sn
|
Sn2+|Sn
|
Sn2+ + 2e ↔ Sn
|
-0,136
|
Pb2+/Pb
|
Pb2+|Pb
|
Pb2+ + 2e ↔ Pb
|
-0,126
|
Fe3+/Fe
|
Fe3+|Fe
|
Fe3+ + 3e ↔ Fe
|
-0,036
|
H+/H2
|
H+|H2
|
2H+ + 2e ↔ H2
|
0,000
|
Cu2+/Cu
|
Cu2+|Cu
|
Cu2+ + 2e ↔ Cu
|
+0,337
|
Cu+/Cu
|
Cu+|Cu
|
Cu+ + e ↔ Cu
|
+0,521
|
Hg22+/Hg
|
Hg22+|Hg
|
Hg22+ + 2e ↔ Hg
|
+0,798
|
Ag+/Ag
|
Ag+|Ag
|
Ag+ + e ↔ Ag
|
+0,799
|
Hg2+/Hg
|
Hg2+|Hg
|
Hg2+ + 2e ↔ Hg
|
+0,854
|
Pd2+/Pd
|
Pd2+|Pd
|
Pd2+ + 2e ↔ Pd
|
+0,987
|
Pt2+/Pt
|
Pt2+|Pt
|
Pt2+ + 2e ↔ Pt
|
+1,190
|
Ag3+/Ag
|
Ag3+|Ag
|
Ag3+ + 3e ↔ Ag
|
+1,498
|
Ag+/Ag
|
Ag+|Ag
|
Ag+ + e ↔ Ag
|
+1,691
|
Электроды первого рода, обратимые относительно аниона
|
Se2+/Se
|
Se2+|Se
|
Se2+ + 2e ↔ Se
|
-0,920
|
S/S2-
|
S|S2-
|
S + 2e ↔ S2-
|
-0,447
|
I2/I-
|
I2|I-, Pt
|
I2(т) + 2e ↔ 2I-
|
+0,536
|
Br2/Br-
|
Br2/Br-, Pt
|
Br2(ж) + 2e ↔ 2Br-
|
+1,065
|
Газовые электроды первого рода, обратимые относительно катиона либо аниона
|
H2O/H2
|
H2O,OH-|H2,Pt
|
2H2O + 2e ↔ H2+2OH-
|
-0,828
|
H+/H2
|
H+|H2
|
2H+ + 2e ↔ H2
|
0,000
|
O2/OH-
|
H2O,OH-|O2, Pt
|
O2+2H2O +4e ↔ 4OH-
|
+0,401
|
NO3-/NO
|
NO3-,H+,H2O|NO, Pt
|
NO3-+4H+ + 3e ↔ NO+2H2O
|
+0,960
|
O2/H2O
|
H2O,H+|O2, Pt
|
O2+4H+ + 4e ↔ 2H2O
|
+1,229
|
Cl2/Cl-
|
Cl-|Cl2, Pt
|
Cl2 + 2e ↔ 2Cl-
|
+1,360
|
F2/F-
|
F-|F2, Pt
|
F2 + 2e ↔ 2F-
|
+2,871
| |
 Скачать 245 Kb.
Скачать 245 Kb.