230
V2
|
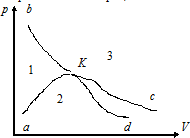
Суреттегі заттың әртүрлі күйде болуының нұсқалары (К – критикалық нүкте, aKd – бинодаль, bKc – критикалық изотерма)
|
0
|
1 - газ, 2 - сұйық, 3 –екі фаза
|
1
|
1 - сұйық, 2 –екі фаза, 3 - газ
|
1
|
2 –екі фаза, 1 - сұйық, 3 - газ
|
0
|
1 - газ, 2 –екі фаза, 3 - сұйық
|
0
|
1 –екі фаза, 2 – газ, 3 - сұйық
|
0
|
3 –екі фаза, 1 – сұйық, 2 - газ
|
231
V2
|
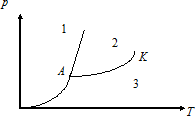
Күй диаграммасында нормальдық заттың әртүрлі күйде болуының дұрыс аймақтары көрсетілген (К – критикалық нүкте, А – үштік нүкте)
|
0
|
1 - газ, 2 - сұйық, 3 - кристалл
|
0
|
1 - газ, 2 - кристалл, 3 - сұйық
|
0
|
1 - сұйық, 2 - кристалл, 3 – газ
|
1
|
3 – газ, 1 - кристалл, 2 - жидкость;
|
0
|
3 – кристалл, 1 - газ, 2 - сұйық;
|
1
|
2 - жидкость, 1 - кристалл, 3 – газ.
|
232
V2
|
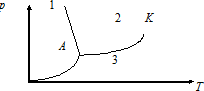
Күй диаграммасында аномальдық заттың әртүрлі күйде болуының дұрыс аймақтары көрсетілген (К – критикалық нүкте, А – үштік нүкте)
|
0
|
1 - кристалл, 2 - газ, 3 - сұйық
|
0
|
1 - сұйық , 2 - газ, 3 - кристалл
|
0
|
1 - сұйық, 2 - кристалл, 3 - газ
|
1
|
1 - кристалл, 2 - жидкость, 3 - газ
|
0
|
1 - газ, 2 - сұйық, 3 – кристалл
|
1
|
3 – газ, 1 - кристалл, 2 – жидкость
|
233
V2
|
Идеал газ үшін молярлық көлемдіVманықтайтын дұрыс формула
|
0
|
Vм kT / p
|
1
|
Vм RT/ p
|
0
|
Vм nRT/ p
|
1
|
V RTp1
м
|
234
V2
|
{Изохоралық, избаралық } процестер үшін жылусиымдылықтың
дұрыс мәндері
|
0
|
V = const, C = CP
|
1
|
V = const, C = CV
|
0
|
V = const, C = 0
|
0
|
p = const, C = CV
|
1
|
p = const, C = CP
|
235
V2
|
Қаттыбайланыстағы {біратомды, екіатомды} идеал газ
молекулаларының ішкі энергиясының дұрыс формулалары
|
1
|
U 3 mRT
2
|
0
|
U 7 mRT
2
|
1
|
U 5 mRT
2
|
0
|
U 9 mRT
2
|
0
|
U 11 mRT
2
|
236
V2
|
{Изохоралық, адиабаталық} процестерүшін жылусиымдылықтың
дұрыс мәндері
|
0
|
V = const, C = CP
|
1
|
V = const, C = CV
|
0
|
V = const, C = 0
|
0
|
V = const, C =
|
1
|
dQ 0 , C = 0
|
237
V2
|
{Фик, Фурье} заңдарының математикалық жазылуы
|
0
|
F S
|
0
|
Q kTt
|
0
|
m D S
|
1
|
m D St
x
|
0
|
F
|
1
|
F S
x
|

 238 238
V2
|
Тұрақты қысымдағы {гелий, азот жәнекөмірқышқылгаздарының}
молярлықжылусиымдылықтары
|
0
|
120 кДж/( моль К)
|
0
|
1,2 кДж/( моль К)
|
1
|
29,05 Дж/(моль К)
|
0
|
21 Дж/(моль К)
|
1
|
33,24 Дж/(моль К)
|
0
|
21 Дж(кмольК)
|
  239 239
V2
|
Диффузия D жәнетұтқырлық коэффициенттерінің өзара байланыстыратын дұрыс формулалар
|
1
|
DpM
RT
|
0
|
= Dcv
|
0
|
D
|
1
|
D
|
0
|
D =
|
0
|
= Dcv
|
 240 240
V2
|
Газдардағы тұтқырлық және жылусиымдылық коэффициенттерінің өзара байланыстыратын дұрыс формулалар
|
0
|
=
|
1
|
= cv
|
0
|
= cv
|
0
|
= cv
|
1
|
iR
2 M
|
0
|
iR
2
|
  241 241
V2
|
Жылу мөлшеріне арналған дұрыс формулалар
|
1
|
Q cmT
|
1
|
Q m
|
0
|
Q cm
|
0
|
Q rT
|
0
|
Q cT
|
0
|
Q mc
T
|
242
V2
|
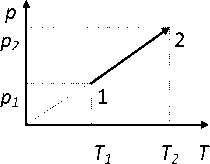
Идеал газды қыздыру кезінде қысымның температураға тәуелділік графигі алынған болса, газдың алатын көлемі (газдыңмассасытұрақты)
|
0
|
артады
|
0
|
кемиді
|
1
|
өзгермейді
|
0
|
газдыңмассасынбілуқажет
|
0
|
әртүрлігаздарүшінжауаптарәртүрлі
|
1
|
тұрақты
|
 243 243
V2
|
Дұрыс жазылған формула
|
0
|
2
A A2 A1
1
|
0
|
A 0
|
0
|
pdV 0
|
1
|
2
A A12
1
|
1
|
2
pdV A12
1
|
0
|
2
A A2 A1
жұмыс–күй функциясы, яғни 1
|
 
  244 244
V2
|
Молекулалардың еркін жүру жолына < l > арналған дұрыс формула
|
0
|
l 1 2 d2
|
0
|
l 1 2d2n
|
0
|
l 1
d2n
|
1
|
l 1 2d2n
|
0
|
l RT
2 d2 p
|
1
|
l RT
2 d2 pN
A
|
   245 245
V2
|
Газдардың диффузия коэффициенті D үшін жазылған дұрыс формула
|
0
|
D 1 l
3
|
0
|
D l
|
0
|
D 1
3
|
1
|
D 1 l
3
|
1
|
D 1 1
3 2 d2n
|
 246 246
V2
|
Газдардың тұтқырлығы үшін жазылған дұрыс формула
|
0
|
1 l
3
|
1
|
1 l
3
|
0
|
1 l c
3 V
|
0
|
l
|
1
|
1 l 8RT
3 M
|
0
|
1 l 8RT
3 M
|
 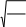 247 247
V2
|
Газдардың жылу өткізгіштігі үшін жазылған дұрыс формула
|
0
|
1 l
3
|
0
|
1 l c
3 V
|
1
|
1 l c
3 V
|
0
|
l cV
|
0
|
1 l c
3 V
|
1
|
1 l pMc
3 RT V
|
 248 248
V2
|
Бір моль Ван-дер-Ваальс газы үшін дұрыс формуланың түрлері
|
0
|
p aV b RT
V2
|
0
|
p aV b RT
V2
|
0
|
p aV b RT
V
|
1
|
p aV b RT
V2
|
0
|
p aV b RT
V2
|
1
|
p aV b kNT
A
V2
|
   249 249
V2
|
Қаттыбайланыстағы {біратомды, үшатомды} идеал газ
молекулаларының ішкі энергиясының дұрыс формулалары
|
1
|
U 3 mRT
2
|
0
|
U 7 mRT
2
|
0
|
U 11 mRT
2
|
1
|
U 3RT
|
0
|
U 5 mkT
2
|
0
|
U 3 mkT
2
|
 250 250
V2
|
{Фик, Ньютон} заңдарының математикалықжазылуы
|
0
|
Q kTt
|
0
|
m D S
|
0
|
m D St
|
1
|
m D St
x
|
0
|
F
|
1
|
F S
x
|
251
V 2
|
Диффузия D
жәнетұтқырлықкоэффициенттерініңөзарабайланыстыратындұрысформ улалар
|
1
|
= D
|
0
|
D =
|
1
|
DpM
RT
|
0
|
= Dcv
|
0
|
D =
|
0
|
= Dcv
|
252
V 2
|
Газдардағытұтқырлықжәнежылусиымдылықкоэффициенттерініңөзара байланыстыратындұрысформулалар
|
0
|
=
|
0
|
=
|
1
|
= cv
|
0
|
= cv
|
0
|
= cv
|
1
|
iR
2 M
|
253
V2
|
Бір моль Ван-дер-Ваальс
газыныңішкіэнергиясынаарналғандұрысформула
|
0
|
U(V,T)=CvT + a/V
|
1
|
U(V,T) iRT a
2 V
|
0
|
U(V,T)=CvT - aV
|
0
|
U(V)=CvT + a/V
|
  254 254
V2
|
Сенімдіоқиғаныңықтималдылығы
|
1
|
P(A) = 1
|
0
|
P(A) 1
|
0
|
P(A) 1
|
1
|
P(A) =100%
|
1
|
сенімдіоқиғаныңықтималдылығыбіргетең 1
|
255
V2
|
Идеал газдыңтығыздығынаарналғандұрысформуласы (М- газдыңмолярлықмассасы)
|
0
|
RT
pM
|
0
|
pm
RT
|
0
|
pV
RT
|
1
|
pM
RT
|
1
|
pm0
kT
|
0
|
pm
kT
|
  256 256
V 2
|
Өлшемсізжылдамдық u /варқылыжазылған,
жылдамдықтыңмодулінеарналғанМаксвеллдіңүлестірімзаңыныңдұрысфо рмуласы
|
1
|
fu 4 u2eu2
|
0
|
fu 4 u2eu2
|
0
|
fu 4 ueu2
|
0
|
fu 4 ueu2
|
1
|
f 4 u2eu2
â
|
0
|
fu 4 u2eu
|
0
|
1 m x2 y2 z2
→ m 2
F e 2kT
2 kT
|
  
 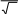 257 257
V2
|
Барометрлікформуланыңдұрысөрнегі (m – ауамолекуласыныңмассасы,
M – ауаныңмолярлықмассасы)
|
0
|
mgh
p p0eRT
|
0
|
p p0e RT
|
0
|
mh
p p0ekT
|
1
|
p p0 e RT
|
1
|
p mgh
e kT
p0
|
0
|
p mgh
ekT
p0
|
0
|
En
n n0eRT
|
  258 258
V2
|
Газдардағы {изохоралықжәнеизобаралық}
процестергеарналыпжазылғантермодинамиканыңбіріншізаңы
|
1
|
m V2
RT V
Q = = ln 1
|
0
|
m p2
RT P
Q = = ln 1
|
0
|
mRT
Q = dU = M dT
|
1
|
mCdT
Q = M p
|
0
|
mRdT
Q = = M
|
0
|
mRT
Q = dU = M
|
0
|
mRT
Q = 3
|
  
  259 259
V2
|
Газдардағы {изотермдік, изохоралық}
процестергеарналыпжазылғантермодинамиканыңбіріншізаңы
|
1
|
m V2
RT V
Q = = ln 1
|
0
|
mRdT
Q = = M
|
0
|
mRT p2
Q = = ln P1
|
1
|
mCdT
Q = dU = M v
|
0
|
mRT
Q = dU = M dT
|
0
|
mRT
Q = dU = M
|
0
|
Q = dU
|
 260 260
V2
|
Больцман үлестірімінеарналғандұрыс формула (Еп –
сыртқыкүшөрісіндегібірмолекуланыңпотенциальдықэнергиясы)
|
0
|
En
n n0eRT
|
0
|
kT
n n0 e
En
|
0
|
n neEn
0
|
1
|
n n0ekT
|
1
|
n n0e RT
|
0
|
En
N N0ekT
|
0
|
p mgh
ekT
p0
|
 261 261
V2
|
Политроптықпроцестіңкөрсеткішдәрежесінің n дұрысөрнегі
|
0
|
n C Cp
C CV
|
1
|
C Cp
n
C CV
|
0
|
n C CV
C Cp
|
1
|
n C Cp
C C R
p
|
0
|
n C CV
C Cp
|
0
|
C Cp
n
C CV
|
0
|
C R n
1 n1
|
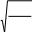   262 262
V2
|
Газдардағы D - диффузия коэффициентініңдұрысформуласы
|
0
|
D 1 l
3
|
0
|
D l
|
0
|
D 1
3
|
1
|
D 1 l 8kT
3 m0
|
1
|
D 1 1
3 2 d2n
|
0
|
D 1 1
3 2 d2n
|
0
|
D l 3
| |
 Скачать 350.43 Kb.
Скачать 350.43 Kb.
 238
238
 239
239 240
240
 241
241

 244
244

 245
245 246
246
 247
247 248
248

 249
249 250
250
 254
254
 256
256



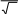 257
257
 258
258



 259
259 260
260 261
261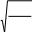

 262
262



