Химия. Электронная формула Ni
 Скачать 68.78 Kb. Скачать 68.78 Kb.
|
|
1 задание. Электронная формула Ni: 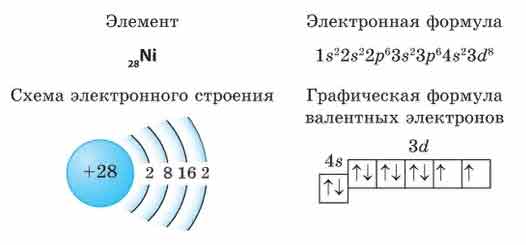 Ваша ошибка заключается в том, что Вы неправильно распределили электроны. На d уровне их 8, как и обозначил преподаватель, а Вы указали 10. Сначала заполняется каждая клетка (орбиталь) одним валентным электроном (стрелка вверх), затем оставшимися, образуя спаянные пары. 2 задание. Степень окисления – это условный заряд атомов химического элемента в соединении, вычисленный из предположения, что все связи имеют ионный тип. У металлов степени окисления в соединениях всегда положительны и = валентности, высшая степень окисления определяется по номеру группу элемента. Высшую отрицательную степень окисления неметаллов можно определить вычитанием из 8 номера группы, в которой находится данный элемент, т.е. высшая положительная степень окисления равна числу электронов на внешнем слое, которое соответствует номеру группы. Степень окисления любого простого одноатомного иона соответствует его заряду. Ион-аммония является производным аммиака (NH3), представляющим собой гидрид. А, как известно, степень окисления водорода в гидридах всегда равна (+1). Степень окисления кислорода равна −2 во всех соединениях, где кислород не образует простой ковалентной связи O—O. Поэтому в молекуле СО степень окисления кислорода -2, а углерода +2. Что касается равенства 0, все соединения в своих составных частях электронейтральны, алгебраическая сумма степеней окисления элементов в молекуле = 0. Не знаю, что хочет от Вас преподаватель, ведь, наверняка, Вам это и так все известно, но Вы написали уравнение электронейтральности, в соответствии с ним – Ваше решение правильно. 3 задание. 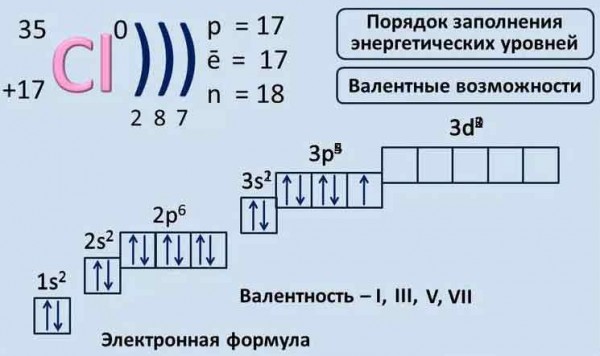 4 задание. Вообще, считается, что в аммиаке полярные ковалентные связи, точнее - донорно-акцепторная связь, исключение жидкий аммиак в нем молекулы связаны между собой водородными связями. Но в Вашем случае связь ковалентная полярная, таким образом, х= 3,04 – 2,20 = 0,84. 5 задание. Молярная концентрация измеряется в моль/л, выше Вы написали правильно. |
