2e Sn, 0,140 В
 Скачать 40.76 Kb. Скачать 40.76 Kb.
|
|
При коррозии окисляется более активный металл, т.е. металл с более низким эл. потенциалом будет служить анодом в образованной гальванической паре и разрушаться (корродировать). Sn2+ + 2e- ⇆ Sn , φº = -0,140 В Cu2+ + 2e- ⇆ Cu , φº = +0,34 В φ°(Cu+2|Cu ) > φ° (Sn2+|Sn ), поэтому в данной паре Cu - катод, а Sn - анод. При этом разрушению будет подвергаться Sn - металл с более низким электростатическим потенциалом. Катодный процесс при контакте двух разных металлов с электролитом зависит от электролита. В водном растворе Na2SiO3 подвергается процессу гидролиза по аниону слабого кислоты : Na2SiO3 → 2Na+ + 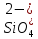 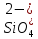 + HOH ⇆ + HOH ⇆ 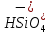 + + 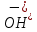 рН>7 рН>7В результате гидролиза в растворе накапливаются ионы водорода 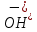 и образуется щелочная среда (pH > 7), следовательно, деполяризатором являются ионы и образуется щелочная среда (pH > 7), следовательно, деполяризатором являются ионы 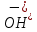 , на катоде идет кислородная деполяризация. , на катоде идет кислородная деполяризация.Процессы: анодный: Sn – 2e- → Sn2+ катодный: 2H2O + O2 + 4e- → 4 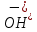 Суммарное уравнение коррозии: Sn + 2 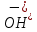 → Sn(OH)2 → Sn(OH)2Вывод: Контактирующих в Sn/Cu конструкции в растворе Na2SiO3 будет подвергаться разрушению Sn! |
