Диаграммы состояния. Документ Microsoft Word111. Пред содержание
 Скачать 260.62 Kb. Скачать 260.62 Kb.
|
Диаграммы состояния сплавов Диаграммы состояния описывают фазовый состав или структуру сплавов (они могут совпадать или отличаться) данной системы (т. е. для определенных компонентов) в зависимости от температуры и концентрации компонентов. Диаграммы состояния играют важную роль в теории и практике металловедения. С их помощью можно исследовать фазовые и структурные превращения сплавов, анализ диаграмм дает возможность предвидеть изменение свойств сплавов и назначать оптимальные режимы термической обработки. Диаграммы строят для равновесного состояния сплавов, которое соответствует минимальному значению свободной энергии системы. Такое состояние достигается при малых скоростях охлаждения или нагрева.  Рис. 9.3. Система координат (ось абсцисс) для построения диаграмм состояния двух- Диаграммы состояния сплавов строят в координатах концентрация компонентов — температура. Температуру откладывают по оси ординат, а концентрацию компонентов — по оси абсцисс. Причем слева направо увеличивается количество компонента В, а справа налево — компонента А. Таким образом, в начале координат находится чистый компонент А (абсцисса равна нулю — содержание компонента В = 0), при значении абсциссы, равном 100 %, имеем чистый компонент В (рис. 9.3). Общее содержание компонентов в сплаве равно 100 %, каждая точка на оси абсцисс соответствует определенному содержанию обоих компонентов. Например, точка С характеризует сплав, в котором содержится 40 % компонента В и 60 % компонента А, а точка D — сплав, в котором 60 % компонента В и 40 % компонента^ (рис. 9.3). Для построения диаграмм состояния сплавов используют данные, полученные с помощью кривых охлаждения, построенных для серии сплавов, состоящих из одних и тех же компонентов, но имеющих неодинаковый химический состав. Кривую охлаждения строят в координатах время — температура, снимая через равные промежутки времени значения температуры. При этом охлаждение сплава должно быть медленным, что обеспечивает его равновесное состояние при всех температурах. С помощью кривых охлаждения определяют критические точки сплава — температуры, при которых происходят структурные превращения в сплавах. На кривых охлаждения сплавов они выявляются в виде перегибов или площадок, свидетельствующих об изменении темпов охлаждения, что связанно с выделением скрытой теплоты кристаллизации. Рассмотрим простейшие диаграммы состояния, компоненты которых в твердом состоянии образуют смеси, твердые растворы и химические соединения. Диаграмма состояния сплавов типа смесь. Приведем построение этой диаграммы на примере системы свинец — сурьма (РЬ — Sb). Кривые охлаждения компонентов и сплавов представлены на рис. 9.4. Критические точки для чистых металлов и сплавов приведены в табл. 9.1. 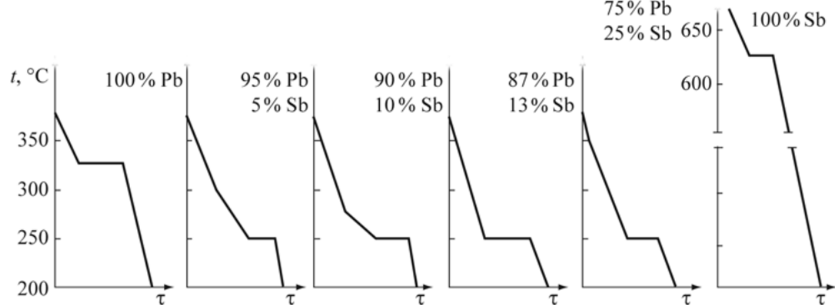 Рис. 9.4. Кривые охлаждения сплавов системы РЬ — Sb Таблица 9.1. Критические точки сплавов системы РЬ—Sb
На основании анализа кривых охлаждения (см. рис. 9.4 и табл. 9.1) построим диаграмму состояния РЬ—Sb (рис. 9.5). Линия диаграммы АВС, выше которой существует только жидкая фаза, называется линией ликвидус. Линия диаграммы DBE, ниже которой существует только твердая фаза, называется линией солидус. Анализ кривых охлаждения показал: • чистые металлы свинец и сурьма кристаллизуются при постоянной температуре; • кристаллизация всех сплавов, кроме одного (его состав — 87 % РЬ, 13 % Sb), протекает в интервале температур от линии ликвидус до линии солидус; • сплав, химический состав которого 87% РЬ, 13 % Sb, кристаллизуется при постоянной температуре и самой низкой температуре. 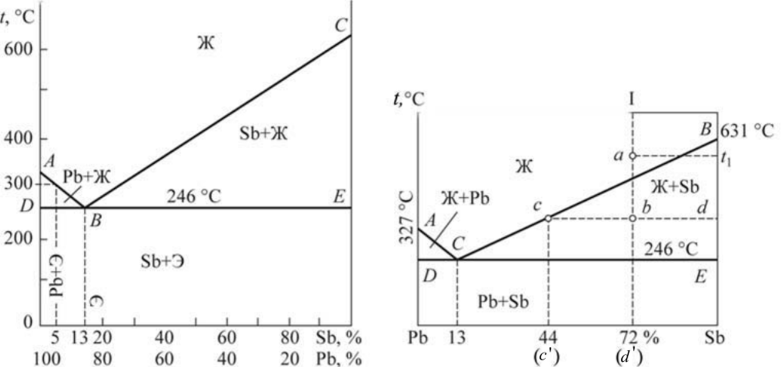 Рис. 9.5. Диаграмма состояния системы РЬ — Sb: а — структурная; б — фазовая Этот наиболее легкоплавкий сплав системы называется эвтектическим сплавом, а его структура — эвтектикой. Особенностью эвтектического сплава является механизм его кристаллизации: жидкость кристаллизуется (затвердевает) с одновременным выделением свинца и сурьмы. Эвтектическое превращение можно описать следующим образом: Ж —» Э [Pb + Sb]. Таким образом, эвтектика — смесь, она состоит из двух фаз — свинца и сурьмы. Эвтектика является структурной составляющей. Сплавы, расположенные слева от эвтектического, называются доэвтекти- ческими, а расположенные справа — заэвтектическими. Первичная кристаллизация таких сплавов начинается с выделения избыточной фазы — фазы, содержание которой в сплаве больше, чем в сплаве эвтектического состава. Таким образом, у доэвтектических сплавов избыточной фазой будет свинец (его содержание в них больше 87 %), а у заэвтектических — сурьма (ее содержание в этих сплавах превышает 13 %). Кристаллизация доэвтектических сплавов начинается с выделения свинца, заэвтектических — с выделения сурьмы, т. е. избыточной фазы. По мерс выделения из жидкости избыточной фазы ее состав меняется. У доэвтектических сплавов в ней увеличивается количество сурьмы за счет выделения из жидкости свинца, у заэвтектических — наоборот, увеличивается количество свинца. По мере охлаждения состав жидкости, таким образом, стремится к эвтектическому. При температуре 246 °С происходит окончательное затвердевание всех сплавов (см. табл. 9.1). При этой температуре состав жидкости любого сплава соответствует эвтектическому и жидкость затвердевает по эвтектическому механизму, образуя смесь. Таким образом, структура доэвтектических сплавов в системе РЬ — Sb состоит из кристаллов свинца и эвтектики (РЬ + Э[РЬ + Sb]), а заэвтектических сплавов — из кристаллов сурьмы и эвтектики (Sb + Э[РЬ + Sb]), что и показано на диаграмме состояния (рис. 9.5, а). Диаграмма, на которой указана структура сплавов называется структурной диаграммой. Диаграмма, на которой указаны только фазы без описания структур, называется фазовой диаграммой (рис. 9.5, б). Напомним, что эвтектика состоит из двух фаз (Э[РЬ + Sb]). Схематично соответствующие структуры показаны на рис. 9.6. 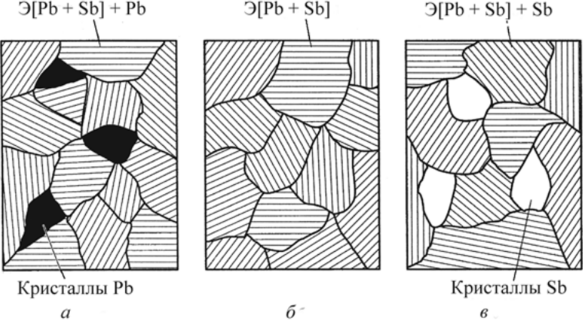 Рис. 9.6. Структуры доэвтектического (а), эвтектического (б) и заэвтектического (в) сплавов системы РЬ — Sb Диаграммы состояния позволяют проводить анализ состояния сплавов. Он заключается в определении фазового состав сплава, химического состава каждой фазы (т. е. содержание в них компонентов), весового соотношения фаз (сколько весит каждая фаза) для любого сплава и при всех температурах его существования. Это выполняется по-разному в однофазных и двухфазных областях. В однофазной области вес фазы равен весу сплава, а ее химический состав соответствует составу сплава. Так, при температуре t сплав I находится в жидком состоянии, т. е. имеет однофазную структуру (см. рис. 9.5, б). Состав жидкости и сплава определяется проекцией точки а на ось концентраций (72 % Sb и 28 % РЬ). Этим приемом нельзя пользоваться при анализе состояния сплавов в двухфазных областях, поскольку при изменении температуры химический состав фаз и их масса не остаются постоянными. Анализ состояния сплавов в двухфазных областях выполняют следующим образом (см. рис. 9.5, б). Через точку Ь, характеризующую положение сплава на диаграмме, проводят горизонталь — коноду — до пересечения с линиями диаграммы, ограничивающими двухфазную область, в которой лежит заданная точка (точка с — пересечение коноды с границей однофазной области существования жидкой фазы; точка d — твердой). Фазовый состав сплава при данной температуре определится фазами тех однофазных областей, с которыми пересекается конода. В данном случае фазовый состав сплава — это жидкость (точка с) и сурьма (точка d). Химический состав фаз соответствует проекциям точек пересечения ко- ноды и линий диаграммы состояния на ось концентраций. Каждая проекция показывает состав той фазы, с которой граничит точка пересечения. Так, точка с' определяет концентрацию компонентов в жидкой фазе (по 44 % Sb и 56 % РЬ), а точка d'— концентрацию компонентов в твердой фазе (это чистый компонент — Sb). Для определения массы фаз пользуются правилом рычага. В любой точке, т. е. при любой температуре, общая масса сплава соответствует длине коноды — отрезку cd. Количество соответствующей фазы определяется противолежащим отрезком: масса жидкости — отрезком bd, а твердой фазы — отрезком cb. Для сплавов типа смеси характерна ликвация по плотности. Ликвация — неодинаковость химического состава по объему сплава. В процессе кристаллизации из жидкости выделяются кристаллы с плотностью, отличной от плотности жидкости. Это приводит к тому, что кристаллы либо всплывают, если их плотность меньше плотности жидкости, либо оседают на дно, если их плотность превышает плотность жидкости. В результате слиток получается неоднородным по составу и свойствам. Для предупреждения этого явления в процессе кристаллизации сплавы интенсивно перемешивают. Диаграммы состояния сплавов типа твердый раствор. При неограниченной взаимной растворимости компонентов они образуют твердый раствор а. Диаграмма состояния сплавов такого типа показана на рис. 9.7. Кристаллизация компонентов (чистых металлов) происходит при постоянной температуре, сплавов — в интервале температур, а именно между линиями ликвидус и солидус. В процессе кристаллизации из жидкости выделяются кристаллы твердого раствора а состава, соответствующего проекциям точек Ь, Ь2, состав жидкости при этом соответствует проекциям точек яь а2 и т. д. на ось абсцисс. Это означает, что состав твердого раствора меняется по линии солидус, а состав жидкости — по линии ликвидус. 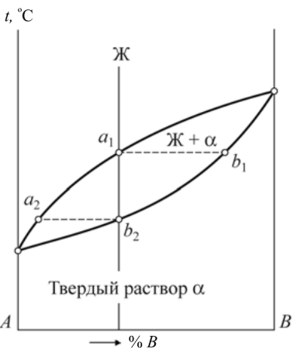 Рис. 9.7. Диаграмма состояния сплавов с образованием твердых растворов с неограниченной растворимостью Для сплавов этого типа характерна вну- трикристаллитная ликвация, проявляющаяся в пределах одного зерна. Центры кристаллизации, образованные на первых стадиях, содержат большее количество тугоплавкого компонента В (компонента с более высокой температурой плавления). В составе следующих слоев, присоединяющихся к выделившемуся центру при понижении температуры, количество этого компонента уменьшается (например, от проекции точки Ь к проекции точки Ь2). Внутризе- ренная ликвация может быть уменьшена путем продолжительной выдержки сплава после его затвердевания при высоких температурах за счет диффузионных процессов. Ограниченная растворимость компонентов в металлических сплавах встречается гораздо чаще, чем неограниченная. На диаграмме состояния с ограниченной растворимостью компонентов (рис. 9.8) линия ЛЕВ — линия ликвидус, линия ADCB — линия солидус. В этой системе образуются фазы, представляющие собой твердые растворы — а (В в А) и (3 (А в В). 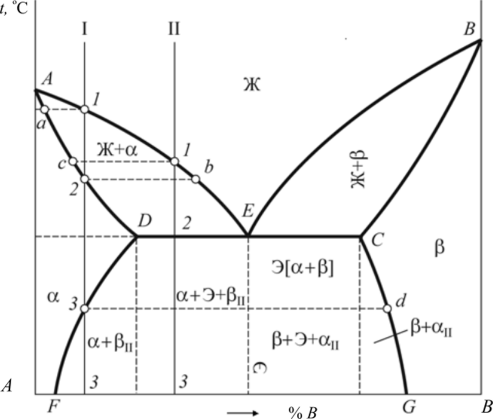 Рис. 9.8. Диаграмма состояния сплавов с образованием твердых растворов с ограниченной растворимостью Предельная растворимость в твердом состоянии определяется линиями: компонента В в А — DF, а предельная растворимость А в В — CG. Процессы кристаллизации сплавов, находящихся на диаграмме левее точки F и правее точки G, такие же как у сплавов, компоненты которых образуют твердые растворы неограниченной растворимости. Эти сплавы имеют однофазную структуру. Кристаллизация сплавов, расположенных на диаграмме в интервалах от точки F до проекции точки D и от точки G до проекции точки С, отличается от описанных ранее. Рассмотрим процесс кристаллизации одного из сплавов, принадлежащего названным областям (сплав I). Выше точки 1 сплав находится в жидком состоянии. В точке 1 начинается кристаллизация сплава с выделения из жидкости кристаллов a-твердого раствора. По мере снижения температуры от точки 1 до точки 2 концентрация компонентов в жидкой фазе изменяется по линии 1—Ь, а в a-твердом растворе по линии а—2, количество жидкой фазы при этом уменьшается, а твердой — возрастает. В точке 2 кристаллизация сплава заканчивается, структура сплава ниже этой точки состоит только из зерен a-твердого раствора, концентрация компонентов в котором такая же как в сплаве (т. е. химические составы сплава и а-твердого раствора совпадают). До точки 3 превращений не происходит, продолжается охлаждение сплава, находящегося в твердом состоянии. Ниже точки 3 из a-твердого раствора начинают выделяться кристаллы |3-твсрдого раствора, которые укрупняются по мере охлаждения сплава. Процесс выделения (3-фазы объясняется тем, что при понижении температуры растворимость компонента В в a-твердом растворе уменьшается, на что указывает линия DF, она составляет примерно 17 % при температуре, соответствующей точке 3; это предельная растворимость (при данной температуре — конода d—3), и менее 10 % после окончательного охлаждения (конода G—F), совпадающая с осью концентраций. Избыток этого компонента выделятся в виде (3-фазы. Структура таких сплавов после окончательного охлаждения состоит из двух фаз — а + (3ц. Кристаллы (3-твердого раствора, выделяющиеся из а-твердого раствора, называются вторичными кристаллами и обозначаются (Зп в отличие от кристаллов, выделяющихся из жидкости, которые называются первичными кристаллами. Аналогичные процессы будут происходить при кристаллизации сплавов, расположенных на диаграмме состояния в интервале G — проекция Е, но здесь вторичными будут кристаллы а-фазы — ап, а структура этих сплавов — Р + Иц. Кристаллизация сплавов, расположенных на диаграмме состояния в интервале D - Е, происходит с образованием эвтектики (аналогично рассмотренной в системе свинец — сурьма). Отличие состоит в том, что в рассматриваемой системе эвтектика состоит из смеси твердых растворов а и (3, а не чистых компонентов. На линии D - Е происходит эвтектическое превращение: Ж —» Э [а + (3]. Сплав, проходящий через точку Е, — эвтектический, его структура — эвтектика Э[а + Р]. Структура доэвтектических сплавов — а + Э, заэвтектиче- ских — р + Э. Диаграммы состояния сплавов с химическим соединением. 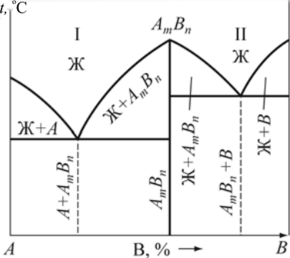 Рис. 9.9. Диаграмма состояния с химическим соединением Диаграмму с химическим соединением можно разделить на две части (рис. 9.9). На одной части диаграммы будут присутствовать сплавы, образованные компонентом А и химическим соединением АтВп , а на другой — химическим соединением А„,В„ и компонентом В. В этом случае химическое соединение выступает в роли одного из компонентов. Каждая часть такой диаграммы представляет собой самостоятельную диаграмму состояния сплавов, компоненты которой образуют в твердом состоянии смеси. Превращения в этих сплавах рассмотрены выше. На практике возможно рассмотрение только части диаграммы состояния в пределах компонент — химическое соединение (А — А1ПВП). В таком виде изучается широко используемая диаграмма состояния железо — углерод, а именно: в пределах Fe — Fe3C; Fe3C — химическое соединение, карбид железа. | ||||||||||||||||||||||||||||||||||||||||
