0,93 30 г неэлектролита растворено в 500 г воды. К(Н2О)1,860С. Раствор замерзает при 1,860С. Определите молярную массу растворенного вещества (гмоль). 60 Ааааааа
 Скачать 139 Kb. Скачать 139 Kb.
|
|
80 г вещества-неэлектролита, имеющего молярную массу 80 г/моль растворено в 2 кг воды. K(H2O)=1,860. Определите температуру замерзания раствора. -0,93 30 г неэлектролита растворено в 500 г воды. К(Н2О)=1,860С. Раствор замерзает при –1,860С. Определите молярную массу растворенного вещества (г/моль).60 ААААААА Азот объемом 11,2 л имеет массу:14 ВВВВВВВВ В 1 литре раствора содержится 98 г H2SO4 (M(H2SO4)=98 г/моль). Какова молярная концентрация раствора?1М В 100 мл раствора содержится 3,4 г AgNO3 (MM=170 г/моль). Какова нормальность раствора? 0,2 Вычислите рОН 0,01М раствора HNO3. 12 Вычислите рН 0,01М раствора КОН. 12 В результате гидролиза какой соли образуется основная соль? FeCl3 В результате гидролиза какой соли образуется кислая соль? К2 S Вычислите массовую долю (%) соли в растворе, содержащем 50 г соли и 200 г воды. 20% В 100 мл раствора содержится 49 г H2SO4. Какова нормальность раствора? 10 В 1 л раствора содержится 34 г AgNO3. (M(AgNO3)=170 г/моль). Какова нормальность раствора?0,2 В растворе какой соли рН будет наибольшим? K2CO3 В 160 г воды растворили 40 г соли. Чему равна массовая доля вещества в растворе? 20 В 1 литре содержится 49 г H2SO4. Какова нормальность раствора. Mr(H2SO4)=98 г/моль. 1 В растворе какой соли рН будет наибольшим? D) Na2CO3 В растворе какого вещества ионов серебра больше (Ag+), если произведение растворимости (ПР) их соответственно равны: В) AgCl 1,710-10 В 1 л раствора содержится 6,3 г HNO3 (М.м.=63 г/моль). Чему равна молярная концентрация раствора?0,1 В растворе какого электролита можно обнаружить хлорид ион? NaCl В растворе какого электролита можно обнаружить хлорид-ионы Cl-? D) NaCl В растворе какого вещества ионов серебра (Ag) больше, если произведение растворимости ПР их соответственно равны: D) AgCl 1,710-10 В каком из приведенных соединений азот проявляет только окислительные свойства? Е) HNO3 В каком из следующих превращений произошла отдача пяти электронов? В) Mn+2Mn+7 В каком из следующих превращений произошло присоединение двух электронов? В) N+5N+3 В каком гальваническом элементе на катоде восстанавливается водород при стандартных условиях? С) Zn/HCl/Cu В каких единицах измеряется ЭДС (Е) гальванического элемента? вольтах В какой паре металлов (условия стандартные) никель будет анодом в гальваническом элементе? С) Ni и Cu В гальваническом элементе самое высокое значение ЭДС (условия стандартные): В) Zn0/Zn2+//Ag+/Ag0 В каком ряду увеличивается основной характер оксидов: А) CaOSrOBaO В каком ряду записаны только амфотерные гидроксиды? В) Be(OH)2, Zn(OH)2, Cr(OH)3 В каком ряду записаны только амфотерные гидроксиды?D) Be(OH)2, Zn(OH)2, Al(OH)3 В результате какой из реакций нельзя получить соль? Е) кислотный оксид + вода В каком направлении сместится равновесие реакции А2(г)+В2(г)2АВ(г), если давление увеличить в 2 раза и одновременно повысить температуру на 10 градусов? Температурные коэффициенты скорости и обратной реакции равны соответственно 2 и 3. влево Во сколько раз изменится скорость реакции 2А+ВА2В, если концентрацию вещества А увеличить в 2 раза, а концентрацию вещества В уменьшить в 2 раза? Возрастёт в 2раза Выражение скорости прямой реакции N2+3Н22NН3 соответствует уравнению: В) =k1C(N2)C3(H2) Во сколько раз следует увеличить концентрацию вещества В2 в системе 2А2(г)+В2(г)=2А2В(г), чтобы при уменьшении концентрации вещества А в 4 раза скорость прямой реакции не изменилась? В 16 раза Во сколько раз увеличится скорость химической реакции: 4HCl(г)+O2(г)2H2O(г)+2Cl2(г) при увеличении концентрации HCl в 2 раза? в 16 Во сколько раз увеличится скорость химической реакции 3H2(г)+N2(г)2NH3(г) при увеличении концентрации водорода в 2 раза?В 8 Во сколько раз увеличится скорость химической реакции, протекающей в газовой фазе, при повышении температуры от 320 до 340 К, если =3? В 9 Во сколько раз увеличится скорость химической реакции, если увеличить в 4 раза давление в системе: 2NO(г)+O2(г)2NO2(г)? В 64 Во сколько раз увеличится скорость химической реакции, при увеличении температуры на 300С, если температурный коэффициент =2? В 8 Во сколько раз увеличится скорость химической реакции: 4NH3(г)+5NO2(г)=4NO(г)+6H2O(п), если увеличить давление в системе в 2 раза? В 512 В какой экзотермической реакции изменение давления не повлияет на смещение равновесия? С) H2(г)+Cl2(г)=2HCl Н3<0 В какой группе находится элемент, электронная формула которого 4s24p3? 5 В какой из перечисленных молекул, связи расположены под углом 1200? D) AlCl3 В максимально-возбужденном атоме кремния 14Si имеются неспаренных электронов: 4 В каком периоде и группе находится элемент, если его электронная формула заканчивается так 4d25s2 5 и 4 В какой из приведенных соединений имеется гибридизация орбиталей? А) SiH4 Водородная связь осуществляется между: атомами В какой из указанных молекул электронные облака перекрываются под углом 1200.С) BF3 ГГГГГГГГГ Гидролиз какой соли идет в три ступени?CrCl3 Гидролиз какой соли идет в три ступени? В) AlCl3 ДДДДДДД Докажите амфотерность свинца, дописав уравнение реакции: Pb(OH)2+2KOH=…+2H2O В) K2PbO2 Докажите, что гидроксид хрома амфотерен, дописав продукт: Сr(OH)3+KOH=…А)K3Cr(OH)6 Для какой из обратимых реакций повышение давления сместит равновесие в направлении прямой реакции D) N2+3H22NH3 ЕЕЕЕЕЕЕЕЕ Если рОН раствора равно 3, то чему равна концентрация ионов водорода? 10-11 Если рОН раствора равен 5, то чему равна концентрация ионов водорода?10-9 ЖЖЖЖЖЖ Железо массой 2,8 г вытесняет из кислоты водород массой 0,1 г. Молярная масса эквивалента металла равна: 28 Железо массой 2,8 г вытесняет из кислоты водород массой 0,1 г. Молярная масса эквивалента металла (г/моль) равна: 0,05 ЗЗЗЗЗЗЗЗЗЗ Закончите уравнение реакции. Поставьте коэффициент перед восстановителем: Mg+HNO3Mg(NO3)2+NH4NO3+H2O 4 Значение электродных потенциалов в гальваническом элементе соответственно равны: ок-ля=+0,54 В, в-ля= -0,73 В. Рассчитать ЭДС системы.1.27 Значение константы скорости реакции зависит:А) от природы реагирующих веществ ИИИИИИИИ Из 400 г 50 %-ного (по массе) раствора H2SO4 выпариванием удалили 100 г воды. Чему равна массовая доля (%) H2SO4 в оставшемся растворе?66,7 КККККККК Как окрасится лакмус в растворе карбоната калия? Синий цвет Какую массу NaNO3 нужно растворить в 400 г воды, чтобы приготовить 20%-ный раствор? 100 Какой газ выделяется при совместном конечном гидролизе солей в реакции: AlCl3+Na2CO3+HOH СО2 Каково математическое выражение ПР сульфата кальция ?6,10*10-5 Концентрация ионов водорода в растворе равна 110-3 моль/л. Определить рН раствора.3 Какую массу (г) поваренной соли (NaCl) надо взять для приготовления 120 г раствора с массовой долей 10%?12 Как надо изменить концентрацию ионов водорода в растворе, чтобы рН раствора увеличился на единицу? Уменьшить в 10 раз Какая из солей не подвергается гидролизу? Na2SO4 Какая из указанных кислот в равных условиях, дает наименьшую концентрацию ионов водорода Н+. А) HClO Kд=2,9510-8 Какой электролит диссоциирует ступенчато?В) H2SO4 Какое из оснований в ионно-молекулярных уравнениях записывается в виде молекулы? А) NH4OH Какая из кислот в ионно-молекулярных уравнениях записывается в виде молекулы С)H2S Какая реакция идет с образованием нерастворимого соединения? D) FeCl3+NaOH Какая реакция имеет кратное ионное уравнение Н++ОН-=Н2О? С) HNO3+NaOH Какая реакция идет с образованием газообразного вещества? А) CaCO3+HCl Какая из солей не подвергается гидролизу? Е) KCl Какое вещество проявляет только окислительные свойства? E) KMnO4 Какое вещество проявляет только восстановительные свойства? C) H2S К какому типу реакции относится: Na2O2+CO2Na2CO3+O2 диспропорционирование Какое соединение хлора проявляет только окислительные свойства? НСlO4 Какое соединение серы проявляет только восстановительные свойства? H2S Какое соединение серы проявляет и окислительные, и восстановительные свойства?K2SO3 Какое вещество содержится в растворе у анода по окончании электролиза раствора AgNO3? HNO3 Какой из катионов металлов будет первым восстанавливаться на катоде при совместном присутствии? E) Cu2+ Какое количество железа выделится на катоде, если через раствор FeCl3 пропустить в течение 2 минут ток силой 1,5 А? 0.03 Какая реакция замещения будет протекать?С) Cu+AuCl3 Какой из указанных металлов вытесняет водород из воды? В) Ca Какой металл первым будет восстанавливаться при электролизе водных растворов солей? Е) Au3+/Au0 Е0= +1,42 В Какой металл не подвергается коррозии? Е) Au Какие вещества выделятся на катоде и аноде при электролизе водного раствора сульфата натрия? Н2,О2 Какие вещества будут выделяться на электродах при электролизе смеси растворов AuCl3 и KCl? Au. Cl2 Какой силы ток должен быть использован для того, чтобы выделить из раствора AgNO3 серебро массой 108 г за 6 мин. 268 Какой из металлов не растворяется в серной кислоте? Е) Au Какой из металлов может вытеснить водород из воды? А) калий Какая реакция замещения будет протекать? В) Ni+Cu(NO3)2 Какие вещества выделяются на катоде при электролизе водного раствора хлорида калия? Н2, Сl2 Какие процессы протекают на катоде при электролизе расплава NaCl. В ответе укажите массу (г) на катоде при электролизе расплава, если условия электролиза следующие: I=10A, =1час, F=96500 Кл. 8.58 Какая из указанных солей не подвергается гидролизу? D) LiCl Какой из катионов металлов будет первым восстанавливаться на катоде при совместном присутствии? А) K+ Какое уравнение соответствует образованию основной соли? В) Zn(OH)2+HNO3 Какое уравнение соответствует образованию кислой соли С) NaOH+H2SO3 Какая из перечисленных солей основная? Е) FeOHCl2 Какое уравнение соответствует образованию основной соли? А) Al(OH)3+HCl Какое уравнение соответствует образованию основной соли? В) CuSO4+KOH Какая из перечисленных солей кислая? С) NaHCO3 Какое уравнение соответствует образованию кислой соли? В) NaOH+H2S Какой оксид при взаимодействии с водой образует кислоту? SO4 Какой оксид растворяется в воде с образованием гидроксида основания? Na2O Какая из перечисленных солей называется дигидроортофосфат калия? А) KH2PO4 Как называется соль (MnOH)2SO3? Гидроксосульфит марганца Какие из оксидов относятся к кислотным? А) SO3, SiO2, CO2 Какое взаимодействие приведет к получению нормальной соли из гидроксохлорида магния? D) MgOHCl+HCl Какая формула выражает закон эквивалентов? Какое количество вещества (моль) находится в 11,2 л оксида углерода (IV) CO2 при нормальных условиях? 0,5 Какое количество вещества (моль) находится в 5,6 л оксида азота NO при н.у.? 0,25 Какова молярная масса газа, если его относительная плотность по воздуху равна 1,5, если Мвозд.=29 г/моль 43,5 Какая формула выражает закон Бойля-Мариотта: Какую массу нитрата натрия надо взять, чтобы приготовить 200 г раствора его с массовой долей 25%? 50 Какое выражение закона действия масс для гомогенной реакции 2NO(г)+Cl2(г)2NOCl(г) Какое выражение закона действия масс для гетерогенной реакции S(к)+O2(г)SO2(г) является верным? В) = k Как правильно сказать: “1 моль вещества содержит”:В) 6,021023 структурных единиц Какова размерность молярной массы эквивалента вещества Х. Какой объем при н.у. займет аммиак (NH3) массой 1,7 кг? 22,4 м3 Какой объем (л) при нормальных условиях займет аммиак (NH3) массой 34 г. 44,8 Какая из указанных величин характеризует массу молекулы воды.С) mM(H2O)=2,99*10- 24 Какой объем займут 32 г метана (СН4) при н.у.? 44,8 Какое количество вещества (моль) находится в 5,6 л углекислого газа (СО2) при н.у.? 0,25 Как изменится скорость реакции 2NO(г)+O2(г)=2NO2(г), если уменьшить объем реакционного сосуда в 3 раза? Возрастёт в 27 раз Как изменится скорость реакции N2(г)+3Н2(г) 2NН3(г), если увеличить давление в системе в 3 раза? 81 Катализатор ускоряет химическую реакцию благодаря:D) снижению энергии активации Как сместить равновесие реакции 2NO+O22NO2+Q влево? В) повысить температуру Как изменится скорость реакции, если уменьшить в 2 раза давление в системе: 2SO2(г)+O2(г)2SO3(г)? Уменьш. в 8 раз Какой оксид может быть восстановлен водородом до свободного металла при 298 К ? G0298, кДж/моль. Н2О(г)= -285,8 С) NiO G0298 = -211,6 Как сместить равновесие реакции влево: 2CO(г)+O2(г)2CO2(г)+Q?Повысить температуру Какая из приведенных формул соответствует алюминию ( Какую отрицательную степень окисления может проявить атом, имеющий внешний энергетический уровень: 3s23p4? 3 Какая электронная формула соответствует иону S2-? А) 3s23p6 Какой подуровень заполняется в атоме электронами после заполнения подуровня 4р? D) 5s Какое максимальное число электронов может содержать атом в электронном слое с главным квантовым числом n=4? 32 Как изменяются значения первых потенциалов ионизации в ряду элементов: Li, Be, B, C, N, F, Ne?С) изменяются нерегулярно, но имеют тенденцию к возрастанию Как изменяется прочность связи в ряду H2O – H2S – H2Se – H2Te?В) уменьшается Какой атом или ион служит донором электронной пары при образовании иона NH4+.С) N Квантовое число, определяющее форму электронного облака называется: магнитным Ковалентная связь, возникающая при перекрывании атомных орбиталей, вдоль оси, соединяющей ядра взаимодействующих атомов называется: -связью Какая из молекул типа АВ2 имеет линейную форму? А) CaCl2 К  акой из указанных способов перекрывания электронных облаков соответствует образованию -связи. акой из указанных способов перекрывания электронных облаков соответствует образованию -связи.D) Какому элементу принадлежит конец электронной формулы: …5s24d105p3 В) ММММММ Между какими парами веществ произойдет химическая реакция? Zn, HCl Молярная концентрация это: количество вещества (молей) в 1л. раствора Массовая доля (, %) гидроксида натрия в 9,28Н растворе NaOH (=1,310 г/мл) равна:28,3 Масса 5 л газа (х) равна 7,15 г при нормальных условиях. Найти плотность этого газа по азоту. 1,14 Массовое число элемента отражает: В) массу электронов ННННННН Нормальная концентрация раствора, содержащего 10,5 г фтористого натрия MNaF=42г/моль в 250 мл водного раствора равна: 1 На сколько градусов повысится температура кипения раствора сахара, если в 200 г Н2О растворить 40 г сахара С12Н22О11. (М(С12H22O11)=342 г/моль). Е(Н2О)=0,520 0,30 С На сколько градусов понизится температура замерзания раствора глицерина, если в 100 г Н2О растворить 10 г глицерина С3Н8О3 (М(С3Н8O3)=92 г/моль). К(Н2О)=1,860С. 2,020С Низшая и высшая степень окисления азота равна: -3,+5 На железной пластинке, опущенной в раствор сульфата меди, выделилось 1,5 г меди. На сколько грамм растворилась железная пластинка? АFe=55,84 г/моль, АCu=63,54 г/моль.1.32 Найти массу серебра, выделившегося на катоде, если через раствор соли AgNO3 пропустили ток силой 1,5 А в течение 1 мин.0,1г Низшая и высшая степень окисления хлора равна: -14,+7 На сколько градусов надо понизить температуру, чтобы уменьшить скорость реакции в 81 раз, если =3? На 40 Некоторое избыточное количество энергии, необходимое для вступления в акт химического взаимодействия называется энергией: С) активации На сколько градусов нужно понизить температуру, чтобы скорость реакции уменьшилась в 32 раза, при температурном коэффициенте равном 2? На 500 С На сколько градусов нужно повысить температуру, чтобы скорость реакции увеличилась в 81 раз при температурном коэффициенте равном 3? На 400 С ООООООО Определите эквивалентную концентрацию раствора HNO3, содержащего 6,3 г HNO3 в 100мл раствора. 1,0 Определите титр 0,25 M раствора NaOH 0,01 Определите эквивалентную массу этого металла. 29,5 Отношение количества растворенного вещества к массе растворителя называется: моляльная концентрация Отношение числа эквивалентов растворенного вещества к объему раствора называется: эквивалентная концентрация Определите число электронов, участвующих в данной ОВР: KMnO4+NaNO2+H2SO4MnSO4+NaNO3+K2SO4+H2O 10 Определите число молей окислителя в следующей ОВР: KMnO4+NaNO2+КОНК2MnO4+NaNO3+H2O 2 Определите число молей окислителя в следующей ОВР: NaBr+NaBrO3+H2SO4Br2+Na2SO4+H2O 1 Определите число молей восстановителя в следующей ОВР. NaCrO2+PbO2+NaOH Na2PbO2+Na2CrO4+H2O 2 Определите электродный потенциал (В) цинка в 0,01М растворе соли ZnSO4. E0Zn2+/Zn=-0,76B. -0,82 Определите силу тока, при которой на катоде выделилось 0,5 г Au в течение 30 минут из раствора AuCl3. 0.4 Определите электродный потенциал (В) меди в 0,01М растворе соли CuSO4: E0Cu2+/Cu=+0,34B.+0.28 Определить электродвижущую силу (ЭДС) гальванического элемента состоящего из свинцовой и магниевой пластинок, опущенных в растворы соответственных солей, если Pb2+=Mg2+=0,01 моль/л. E0Mg2+/Mg= -2,36 B; E0Pb2+/Pb= -0,13 B.+2,23 Определить ЭДС гальванического элемента состоящего из магниевой и медной пластинок, опущенных в растворы соответственных солей, если Mg2+=Cu2+=0,01 моль/л. E0Mg2+/Mg= -2,34 B; E0Cu2+/Cu=+0,34 B. +2,68 Определить ЭДС гальванического элемента Zn/Zn2+(0,01моль/л)//Cd2+/Cd(0,01моль/л), если E0Cd2+/Cd= -0,43 B; E0Zn2+/Zn= -0,76 B.0,33 $$$ 156 Определить ЭДС гальванического элемента Zn/Zn2+(0,01 моль/л)//Ag+/Ag(0,01 моль/л), если E0Zn2+/Zn= -0,76 В; E0Ag+/Ag= +0,80 B. 1,50 Определите массу цинка, выделившегося на катоде при электролизе раствора сульфата цинка в течение 1 часа при токе 26,8 А, если выход цинка по току равен 50 %.16,34 Определить выход по току кадмия, если при электролизе в течение 1 часа на катоде выделился кадмий массой 5,62 г, а ток был равен 5,36 А. 50 Определить ЭДС гальванического элемента (В) Ag/AgNO3 (0,001M)//AgNO3 (0,1M)/Ag, если E0Ag/Ag+= +0,80В 0.12 Объем (л), занимаемый 0,5 моль водорода при н.у.: 11,2 Объем (л) занимаемый 2 моль хлора при нормальных условиях: 44,8 Определите количество молей в 56 г N2 при н.у. 2,0 Относительная плотность газа (х) по водороду равна 22. Какова масса 1 л этого газа при нормальных условиях? 1,96 Относительная плотность газа (Х) по водороду равна 40. Какова его относительная молекулярная масса, если М2(Н2)=2. 80 Определить эквивалентную массу этого металла.4 Определите массовую долю (в процентах) гидроксида кальция , % Ca(OH)2, если в 100 г раствора находится 5 г. 5 Определите в ОВР число молей окислителя: KMnO4+H2S+H2SO4MnSO4+K2SO4+S+H2O 2 Определите молярную массу эквивалента (г/моль) кислоты в реакции: Н3РО4+КОНКН2РО4+Н2О. 98 ППППППП Проходя через раствор электролита, ток силой 0,5 А за 1 ч выделяет 0,55 г металла. При полной диссоциации Na3PO4 образуется ионов: 4 При гидролизе какой соли происходит образование основной соли? FeCl3 Проходя через раствор электролита, ток силой 2 А за 44 мин выделяет 2,3 г металла. При растворении 5,0 г вещества в 200 г воды получается не проводящий тока раствор, кристаллизующийся при –1,450С. Определить молекулярную массу растворенного вещества (г/моль).(KkH2O=1,860) 32 При диссоциации какого электролита получается гидроанион? Na2HPO4 При диссоциации какого электролита получается гидроксокатион? CuOHCl Пластинка из какого металла быстрее растворится в растворе CuSO4? D) Fe При взаимодействии с каким из растворов солей масса свинцовой пластинки уменьшится? B) CuSO4 По закону Фарадея, масса веществ при электролизе определяется по формуле: m Пластинка цинка, опущенная в раствор дихлорида олова (SnCl2), уменьшилась на 0,2 г. Сколько грамм олова выделилось? АSn=118 г/моль, АZn=65,4 г/моль.0.36 При электролизе раствора какой соли будет выделяться на аноде О2. С) K2SO4 При электролизе раствора CuSO4 на электродах (катоде и аноде) выделяются вещества: Сu, O2 При электролизе водного раствора какой соли на катоде выделяется только металл? С) Hg(NO3)2 При электролизе раствора NaNO3 на катоде и аноде выделяются вещества: H2, O2 При электролизе раствора Cu(NO3)2 на электродах (катоде и аноде) выделяются вещества: Сu, O2 При электролизе раствора MgCl2, на катоде выделяется: H2 При электролизе раствора CuCl2 на катоде выделяется: Cu При растворении какого оксида в воде образуется гидроксид-основание? В) Na2O Плотность газа по воздуху равна 2,2. Какова относительная молекулярная масса газа? Мвозд=29 г/моль. 64 При увеличении концентрации реагирующих веществ, скорость химической реакции: В) увеличивается При повышении давления равновесие реакции: Fe3O4(тв)+4CO(г)3Fe(тв)+4CO2(г) В) не сместится Протекание какой реакции получения железа наиболее вероятно? D) 2FeO(к)+Si(к)=2Fe(к)+SiO2(к) G4 = -368,1 кДж При увеличении температуры от 30 до 600С и температурном коэффициенте =3, скорость реакции: увел. в 27 раз При увеличении концентрации СО и Н2О в 2 раза, скорость реакции CO(г)+Н2O(г)=CO2(г)+Н2(г): увел. В 4 раза При увеличении концентрации реагирующих веществ скорость химической реакции: В) увеличивается РРРРРРРРРРР Раствор массой 120 г содержит 24 г гидроксида калия (КОН). Какова массовая доля вещества в растворе (, %)? 20 Раствор массой 125 г содержит 25 г гидроксида натрия (NaOH). Какова массовая доля вещества в растворе (, %)?20 рН раствора равен 6, то чему равна концентрация ионов водорода в этом растворе?10-6 Рассчитайте стандартную ЭДС (В) цинково-серебряного гальванического элемента. Е0Zn2+/Zn=-0,76B. E0Ag+/Ag=+0,80B. +1.56 СССССССС С каким веществом будет взаимодействовать оксид алюминия? NaOH Сколько граммов (г) Na2CO3 cодержится в 500 мл 0,25Н раствора? 6,63 Среди приведенных, укажите процесс восстановления.C) MnO4-MnO2 Среди приведенных, укажите процесс окисления.A) NO2-NO3 Стандартный потенциал какого электрода принят равным 0? водородного Сколько времени (в час) потребуется для полного разложения 2 молей воды током силой 2А? 53.6 Согласно правилу Вант-Гоффа как изменится скорость реакции при повышении температуры на 100С? Возрастет в 2–4 раза Сколько -связей в молекуле (N) азота? 2 Связь, образованная перекрыванием чистых s- и p- облаков имеется в молекуле: С) HCl Связь, образованная общей парой электронов называется: ковалентной Сколько нейтронов содержится в ядре атома золота Сколько подуровней находится на 4 энергетическом уровне?1 ТТТТТТТТ Ток силой 2,5 А, проходя через раствор электролита, за 30 мин выделяет из раствора 2,77 г металла. Найти эквивалентную массу металла.59.4 Ток силой 2,5 А, проходя через раствор электролита, за 30 мин выделяет из раствора 2,77 г металла. Найти эквивалентную массу металла. 59.4 Температурный коэффициент скорости реакции равен 2,8. Во сколько раз возрастает скорость реакции при повышении температуры от 20 до 750С? 172 Тепловой эффект какой реакции является теплотой образования? С) 2Н2(г)+ЅО2(г)=Н2О(ж) Н3 = - 285,8 кДж УУУУУУУУ Укажите соль, раствор которой имеет щелочную среду. K2CO3 Укажите соль, не подвергающуюся гидролизу. KNO3 Укажите слабый электролит. Al(OH)3 Укажите раствор какой соли при гидролизе имеет щелочную среду рН>7 CH3COONa+HOH Укажите раствор какой соли при гидролизе имеет кислую среду (рН<7). CuCl2 Укажите раствор какой соли при гидролизе имеет щелочную среду рН>7. CH3COONa+HOH Укажите рН раствора хлороводородной кислоты, если концентрация Н+=110-3 3 Укажите сильный электролит. С) NaNO3 Укажите реакцию гидролиза. Zn(NO3)2+H2O Укажите раствор какой соли при гидролизе имеет щелочную реакцию среды, т.е. рН>7. NaCN Укажите раствор какой соли при гидролизе имеет нейтральную реакцию среды, т.е. рН=7? NH4CN Укажите вещество электролит.D) CuSO4 Укажите вещество неэлектролит. D) MnO Укажите сильный электролит. А) HNO3 =94 % Укажите молярную концентрацию серной кислоты СМ(H2SO4), если в 1 л раствора находится 9,8 г серной кислоты.0,1 Укажите рН раствора щелочи NaOH, если С(ОН-)=10-5 моль/л.9 Укажите реакцию гидролиза соли. С) Zn(NO3)2+H2O Укажите раствор какой соли при гидролизе имеет кислую среду (рН<7). В) MgCl2 Укажите соединение, содержащий атом в степени окисления “+4”. D) Na2SO3 Укажите соединение, в котором степень окисления центрального атома равна “+6”. C) K2Cr2O7 Укажите окислитель: A) KMnO4 Укажите процесс окисления.А) H3AsO3H3AsO4 Укажите процесс восстановления.А)MnO4-MnO2 Укажите процесс окисления. С) P2O3H3PO4 Укажите вещество с нулевой степенью окисления атома.Al Укажите соединение, в котором кислород имеет положительную степень окисления +2. OF2 Укажите соединение со степенью окисления хлора +1.HClO Укажите окислительно-восстановительную реакцию. А) Zn+SZnS Укажите процесс восстановления (принятие электронов).А) Сl+1Cl-1 Уравняйте реакцию Са+Н2ОСа(ОН)2+Н2. В ответе укажите число молей окислителя.2 Уравняйте реакцию H2S+H2SO3H2O+S. В ответе укажите число молей восстановителя.2 Укажите вещество, которое будет выделяться на аноде при электролизе соли Mg(NO3)2. O2 Укажите возможную реакцию.D) Cu+AgNO3 Укажите схему гальванического элемента, в котором никелевая пластинка служит анодом. С) Ni0/Ni2+//Pb2+/Pb0 У какого элемента металлические свойства выражены сильнее? А) Na 0= -2,71 B У какого из металлов образуется на поверхности плотная оксидная защитная пленка? Al Укажите соль, раствор которой имеет кислую среду (рН<7). С) MgCl2 Укажите вещество, взаимодействующее с NaOH с образованием воды Е) HCl Укажите реакцию образования гидроксида бериллия: D) Be(NO3)2+Ca(OH)2 Укажите формулу хлорной кислоты: HClO4 Укажите вещество, с которым будет взаимодействовать гидроксид натрия: С) SO3 Укажите вещество, с которым будет реагировать гидроксид калия.В) SO3 Укажите оксид кальция.С) CaO Укажите основной оксид.В)BaO Укажите кислотный оксид.D) CO2 Укажите амфотерный оксид.С) Al2O3 Укажите реакцию образования силиката кальция.А) Ca(OH)2+SiO2 Укажите реакцию образования угольной кислоты.D) CaCO3+HCl Укажите реакцию образования оксида железа (III). В) Fe(OH)3 Укажите ряд веществ, с которыми реагируют основания. В) SO3, H2SO4, Zn(OH)2 Укажите формулу, с помощью которой можно привести объем газа к нормальным условиям. Укажите формулу, с помощью которой можно определить молярный объем. 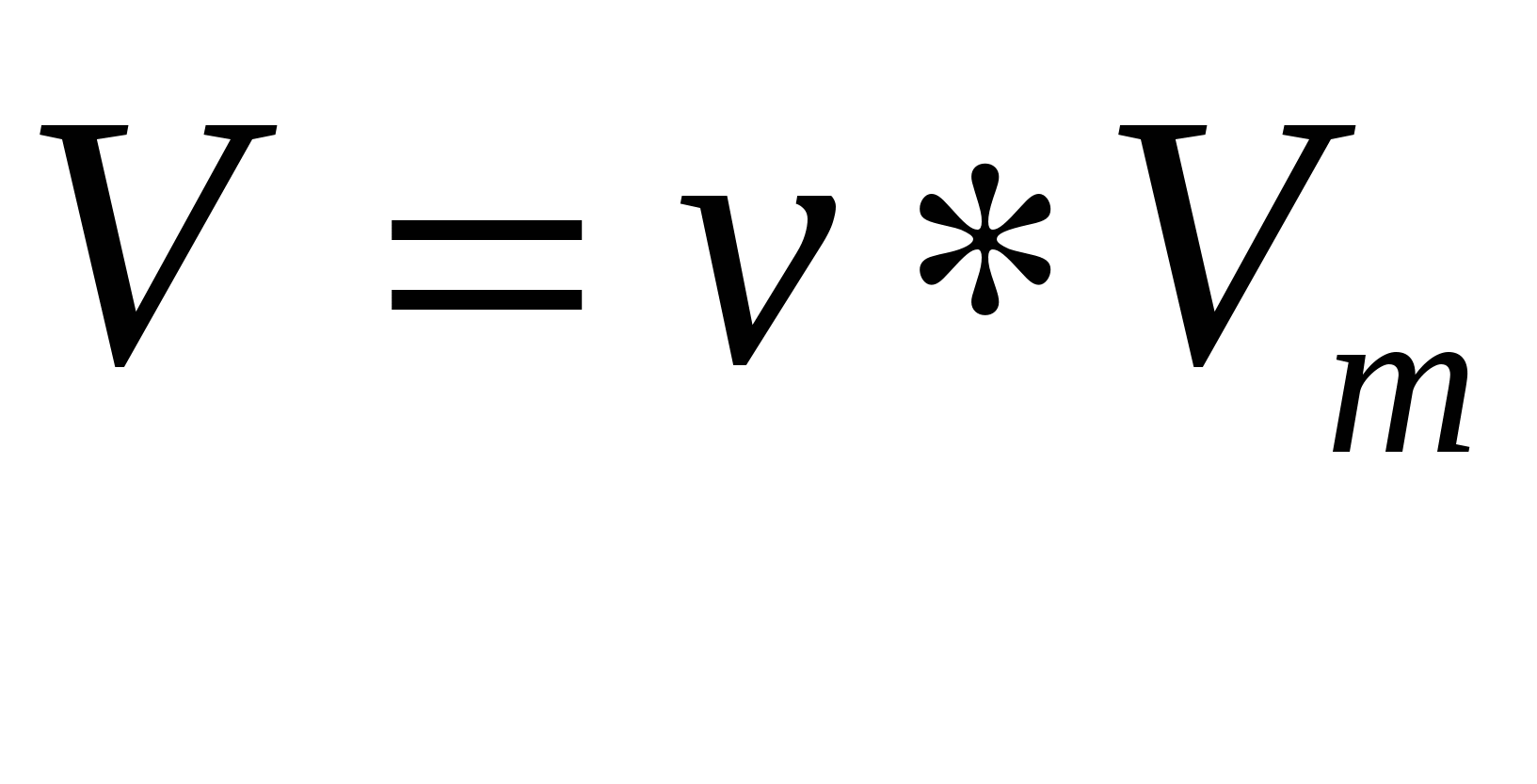 Укажите значение относительной плотности триоксида серы (SO3) по водороду.В) 40 Укажите значение молярной массы гидроксида кальция M(Ca(OH)2) 74 г/моль Укажите значения молярных объемов водорода и кислорода при н.у. D) 22,4 л/моль и 22,4 л/моль Укажите формулу приведения объема газа к н.у. Укажите, в каком случае содержится больше молекул при н.у. С) 10 г NH3 Укажите молярную массу эквивалента ортофосфорной кислоты в реакции: Н3РО4+Са(ОН)2=СаНРО4+2Н2О 49 Укажите значение универсальной газовой постоянной. R=8.314 дж/моль*К Укажите молярный объем газа при нормальных условиях. 22,4 л/моль Укажите значение молярной массы серной кислоты H2SO4. 98 г/моль Укажите значение молярной массы ацетата натрия NaCH3COO 82 г/моль. Укажите значение массы эквивалента гидроксида кальция Са(ОН)2. 37 г/моль Укажите какое вещество имеет наименьший эквивалент. С) O2 Укажите какое вещество имеет наибольший эквивалент. D) Na2SO4 Укажите в каком случае содержится больше молекул Н2 при нормальных условиях. А) 11,2 г Н2 Укажите массу (г) серной кислоты количеством 0,5 моль. М(H2SO4)=98 г/моль. 49 Укажите формулу, выражающую закон эквивалентов. Укажите молярную массу гидросульфита натрия NaHCO3.104 г/моль Укажите массу (г) 67,2 л аммиака (NH3) при н.у. 51 Укажите число молекул в 3,4 г сероводорода (Н2S). 6,02*1023 Укажите равенство, выражающее закон эквивалентов. Укажите молярную массу газа (г/моль), если 11 г этого газа занимают объем 5,6 л при н.у. 44 Укажите массу (г) и число молекул, содержащихся в 2 молях фтороводорода. 40г, 12,04*1023 молекул Укажите значение постоянной Авогадро. 6,02*1023 моль-1 Укажите единицу измерения теплового эффекта. кДж Укажите единицу измерения теплоты образования (энтальпии)-Н0f, 298. кДж/моль). С) NH3(г) – 46,19 Укажите наиболее реакционноспособное вещество, т.е. менее прочное (Н0298 обр., Укажите максимальное число “f” орбиталей на данном уровне. D) 7 Укажите валентность фосфора в нормальном состоянии, если электронная формула s2p3.3 Укажите тип химической связи в молекуле HCl. Ковалентная , полярная Укажите максимальную степень окисления хлора. +7 Укажите число неспаренных электронов в атоме 24Cr в нормальном состоянии. 6 Укажите какие ионы сходны по строению своих внешних электронных оболочек. Е) C+4- Si+4 Укажите min и max степени окисления элемента, электронная формула валентных электронов которого имеет вид: …s2p5 (-11)-(+7) Укажите в каком случае ЭДС гальванического элемента будет наименьшей? В) Mg0/Mg2+//Al3+/Al0 E0Al/Al3+= +1,67 B Укажите соль, раствор которой имеет щелочную среду (рН>7).В) Na2S Укажите кислоту, соответствующую оксиду хлора со степенью окисления хлора -1. В) HClO Укажите гомогенную реакцию. D) N2(г)+3Н2(г) 2NН3(г) ЧЧЧЧЧЧЧЧЧЧ Чему равна концентрация гидроксид-ионов в растворе, рН которого равен 10. 10-3 Что получается при взаимодействии разбавленной азотной кислоты с марганцем?Mn(NO3)2+No+H2O Чему равно осмотическое давление (мПа) 0,5М раствора глюкозы (С6Н12О6) при 250С? 1,24 Чему равно рН раствора, если концентрация ионов водорода СН+=110-3 (рН=-lgCH+). 3 Чему равен эквивалент восстановителя в реакции: K2Cr2O7+SnCl2+H2SO4Sn(SO4)2+CrCl3+K2SO4 (M(K2Cr2O7)=294 г/моль; M(SnCl2)=190 г/моль).190/2 Число моль Н+, участвующих в восстановлении иона ClO3- в ион Cl- равно: 6 Чему равен эквивалент окислителя в реакции: HNO3+H2SNO+S+H2S M(HNO3)=63 г/моль; M(H2S)=34 г/моль 63/3 Чему равна степень окисления галогенов F2, Cl2, I2, Br2 в свободном состоянии?0 Чему равна масса алюминия, полученного за 1 час при электролизе расплава AlCl3 током силой 13,4 А. 4,5 Через раствор нитрата серебра пропускали ток силой в 5 А в течение 15 минут. Масса выделившегося серебра 5,04 г. Какому выходу по току это соответствует? 100 Что выделяется на аноде в результате окисления ОН--гидроксид-ионов? O2 Чему равна ЭДС гальванического элемента, составленного из полуэлемента Zn/Zn+2 0=-0,76 B и водородного электрода 0= 0,00 В (условия стандартные)? +0.76 Чему равен электродный потенциал (Е, В) цинка, погруженного в раствор ZnSO4 c концентрацией ионов цинка, равной 0,01 моль/л? Е0Zn2+/Zn0= -0,76B. -0.79 Чему равна молярная масса эквивалента фосфорной кислоты М(Н3РО4)=98 г/моль в реакции (г/моль)? Н3РО4+Са(ОН)2=СаНРО4+2Н2О 49 Что принимается за единицу количества вещества в системе СИ? моль Чему равен температурный коэффициент скорости реакции, если при увеличении температуры на 400С скорость возрастает в 81 раз? 3 Чтобы сместить равновесие системы 2CO(г)+O2(г)2CO2(г)+Q влево (в сторону исходных веществ) необходимо: D) увеличить температуру Число нейтронов в атоме магния ( ЩЩЩЩЩЩЩЩ Щелочная среда pH>7 получается при растворении в воде соли: А) Na2CO3 Щелочная среда получается при растворении в воде соли: D) K2S ЭЭЭЭЭЭЭЭЭЭЭ Электродвижущая сила (В) гальванического элемента Zn0/Zn2+//Mg2+/Mg равна, если E0Zn/Zn2+=-0,76B;E0Mg/Mg2+= 2,37B.1.607 |
