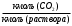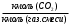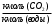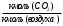абсорбция 14 вариант. 1. 1Теоретические основы абсорбции 3
 Скачать 0.72 Mb. Скачать 0.72 Mb.
|
3. РАСЧЕТ АБСОРБЕРА3.1 Определение условий равновесия процессаОпределяем равновесные концентрации диоксида углерода в воде. Если поглощается труднорастворимый газ, то расчет равновесных концентраций ведут по закону Генри /1/: 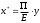 , (3.1) , (3.1)где ‑ давление в абсорбере, Па; E‑ константа растворимости, Па; x* ‑ равновесная концентрация СО2 в воде, 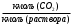 ; ;у ‑ концентрация СО2 в воздухе, 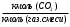 . .E = 1,02106 мм рт. ст. = 1,36108 Па при температуре абсорбции 18 С /4/. 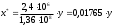 , (3.2) , (3.2)Величины равновесных концентраций в жидкости достаточно рассчитать для диапазона значений концентраций в газовой фазе от нуля до величины, которая в 1,2-1,5 раз превышает начальную концентрацию абсорбтива. 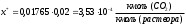 Для упрощения расчетов материального баланса необходимо сделать пересчет абсолютных концентраций в относительные. Связь между относительной концентрацией и абсолютной выражается следующей формулой /1, стр. 385/: 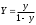 , (3.3) , (3.3)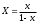 , (3.4) , (3.4)где у ‑ абсолютная концентрация СО2 в газовой фазе, 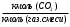 ; ;Y ‑ относительная концентрация СО2 в газовой фазе, 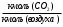 ; ;x ‑ абсолютная концентрация СО2 в жидкой фазе, 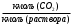 ; ;X ‑ относительная концентрация СО2 в жидкой фазе, 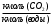 ; ;х= 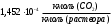 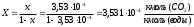 Таблица 3.1. Расчет равновесной линии.
По определенным значениям концентраций строится линия равновесия (рис. 3.1). Линия равновесия     Yн X*кmaxmam 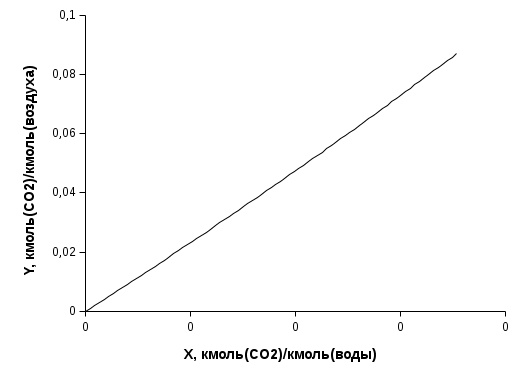 Рисунок 3.1 Рис. 3.1. |