Ферменты (тесты). 1. Что такое ферменты и какую роль они выполняют в организме
 Скачать 1.49 Mb. Скачать 1.49 Mb.
|
|
3. Напишите формулу ФАД в окисленной и восстановленной форме. 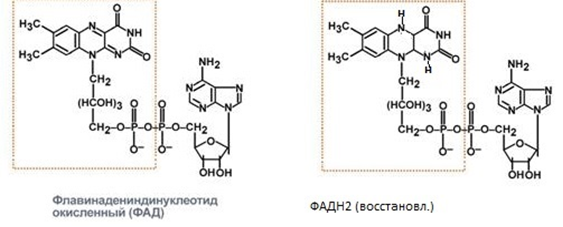 4. Какова судьба протонов и электронов, поступающих из матрикса митохондрии в межмембранное пространство? Электроны последовательно проходят по дыхательной цепи. При этом протоны высвобождаются в межмембранное пространство. Если рассматривать теорию Митчелла, то перенос электронов по цепи обеспечивает перекачку протомов. В обычном состоянии мембраны для Н+ проницаема только в области АТФ-синтетазы, через который протоны по электро-химическому градиенту устремляются внутрь. В синтетазе энергия движения протонов использует для синтеза АТФ. 5. Каков принцип определения активности каталазы крови по Баху и Зубковой и в каких единицах выражается ее активность? Каталаза - фермент, разлагающий перекись до воды и кислорода. Принцип определения активности каталазы по Баху и Зубковой основан на измерении количества Н2О2, которое может быть разрушено ферменты за определенное время в определенных условиях. Количество разложившейся перекиси определяется по разности между ее количеством в контрольной пробе, где феомент не работал, и в опытной пробе. Определяется путем титрования перманганатом в кислой среде. Активность фермента выражается каталазным числом (мг перекиси, разлагаемое 1 мкл крови) и показателем каталазы (отношение каталазного числа к количеству миллионов эритроцитов в 1 мкл крови). 11 билет: 1.стандартная единица активности ферментов 2.шестой класс ферментов, реакции, ими катализируемые 3.формула ФАД окисленного и восстановленного 4.количество АТФ, если протоны и электроны поступают на 1ый комплекс 5.диагностическое значение определения активности ферментов, примеры 1.Что представляет стандартная единица активности фермента? Стандартная международная единица (Е или U): за единицу активности любого фермента принимается то количество его, которое в оптимальных условиях катализирует превращение 1 микромоля субстрата или образование 1 микромоля продукта в минуту (мкмоль/мин). 2. Шестой класс ферментов и реакции, которые они катализируют. Лигазы (синтетазы) -фермент, катализирующий соединение двух молекул с образованием новой химической связи (лигирование). При этом обычно происходит отщепление (гидролиз) небольшой химической группы от одной из молекул. К лигазам, катализирующим р-ции, в к-рых образуются связи С—О, относятся аминоацил-тРНК-синтетазы, катализирующие ацилированиетранспортных РНК соответствующими аминокислотами. Образование связи С—S катализируют ферменты, участвующие в синтезе ацильных производных кофермента А (см.Пантотеновая кислота). К ферментам, участвующим в образовании связи С—N, относятся амидсинтетазы (катализируют образование амидов из к-т и NH3 или аминов, напр.глутаминсинтетаза), пептидсинтетазы (катализируют образование пептидной связи, напр. L-глутамилцистеинсинтетаза), цикло-лигазы (катализируют образование гетероциклов, содержащих в кольце атом N, напр. фосфорибозиламиноимидазол - синтетаза) и нек-рые другие. Р-ции, в результате к-рых образуется связь С—С, катализируют карбоксилирующиеферменты, содержащие в качестве кофактора биотин, напр. пируваткарбоксилаза. Ряд лигаз (напр., полидезоксирибонуклеотид-синтетаза) катализирует образование фосфодиэфирных связей в нуклеиновых к-тах (т. наз. репарирующие ферменты). 3. Напишите формулу ФАД в окисленной и восстановленной форме.  4. Укажите, какое количество молей АТФ образуется в результате тканевого дыхания, если протоны и электроны поступают на I комплекс дыхательной цепи. При одном цикле работе NAD/H-дегидрогеназ на одну молекулу кислорода приходится образование 3 АТФ. 5.Диагностическое значение определения активности ферментов. Приведите примеры.Энзимодиагностика заключается в постановке диагноза заболевания (или синдрома) на основе определения активности ферментов в биологических жидкостях человека. Принципы энзимодиагностики основаны на следующих позициях: при повреждении клеток в крови или других биологических жидкостях (например, в моче) увеличивается концентрация внутриклеточных ферментов повреждённых клеток; количество высвобождаемого фермента достаточно для его обнаружения; активность ферментов в биологических жидкостях, обнаруживаемых при повреждении клеток, стабильна в течение достаточно длительного времени И отличается от нормальных значений; ряд ферментов имеет преимущественную или абсолютную локализацию в определённых органах (органоспецифичность); существуют различия во внутриклеточной локализации ряда ферментов. Пример: При инфаркте миокарда наблюдают достоверные изменения в крови активности ферментов КК, ЛДГ и аспартатаминотрансферазы - ACT 12 билет 1. Общая специфичность ферментов 2.написать формулу НАД окисленную и восстановленную 3.Единица активности 4.Ферментативная реакция.Каждый этап расписать 5.трансфера 1. 2.Напишите формулу НАД в окисленной и восстановленной форме. 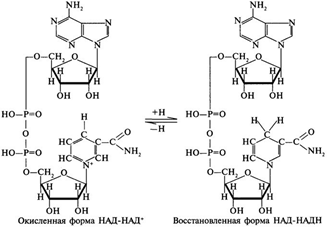 3.В каких единицах измеряется активность ферментов в системе СИ? Единица активности в системе СИ (катал) — соответствует количеству фермента, которое катализирует превращение 1 моля субстрата в 1 секунду 4. Ферментативная реакция .Каждый этап расписать. Ферменты специфически связывают реагенты (свои субстраты) в активном центре. При этом субстраты ориентируются таким образом, что приобретают оптимальное положение для образования переходного состояния (1-3). Сближение и необходимая ориентации реагентов значительно повышают вероятность образования продуктивного комплекса A--B. Кроме того, связывание субстрата в активном центре приводит к удалению гидратной оболочки субстрата. В результате удаления молекул воды в активном центре фермента во время катализа создаются совершенно другие условия, чем в растворе (3-5). Еще одним важным фактором является стабилизация переходного состояния вследствие взаимодействия между аминокислотными остатками белка и субстратом (4). Таким образом, переходное состояние в случае ферментативной реакции требует меньшей энергии активации. Кроме того, многие ферменты во время катализа переносят специфические группировки с субстрата или на субстрат. Особенно часто осуществляется перенос протонов. Этот ферментативный кислотно-основной катализ значительно более эффективен, чем обмен протонов с кислотами и основаниями в растворе. Часто химические группировки ковалентно присоединяются к остаткам фермента. Это явление называют ковалентным катализом. 5. Второй класс ферментов и реакции, которые они катализируют. Согласно международной классификации и номенклатуре ко 2 классу ферментов относятся трансферазы. Трансферазы катализируют реакции переноса функциональных групп и молекулярных остатков с одной молекулы на другую. Реакции, катализируемые трансферазами, в общем случае выглядят так: A—X + B ↔ A + B—X. В зависимости от характера переносимых групп выделяют: 1)Фосфотрансферазы - это ферменты, катализирующие перенос остатка фосфорной кислоты. 2)Аминотрансферазы ускоряют перенос аминогруппы. 3)Гликозилтрансферазы ускоряют реакции переноса гликозильных остатков, 4)Ацилтрансферазы катализируют процессы переноса ацилов (радикалов карбоновых кислот) на спирты, амины, аминокислоты и другие соединения. и др. 13 билет  1. 2.Напишите формулу КоQ (убихинона) в окисленной и восстановленной формах 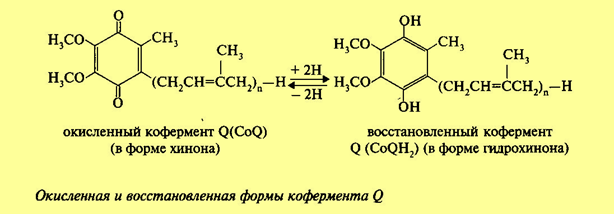 3.Как можно определить специфичность ферментов на примере альфа-амилазы слюны и сахаразы дрожжей? опыт5.1.4 4.В каких единицах измеряется активность ферментов в системе СИ? Единица активности в системе СИ (катал) — соответствует количеству фермента, которое катализирует превращение 1 моля субстрата в 1 секунду 5. Представление о конкурентном ингибировании ферментов. Приведите примеры. В этом случае вещество, близкое по своей структуре к обычному субстрату фермента, соединяется с активным центром фермента, но не может прореагировать с ним. Находясь здесь, оно преграждает доступ к активному центру любой молекуле настоящего субстрата. Для конкурентного ингибирования характерно, что, если концентрация субстрата увеличивается, то скорость реакции возрастает, т. е. это ингибирование обратимо. Классическим примером подобного типа ингибирования является торможение сукцинатдегидрогеназы (СДГ) малоновой кислотой. Этот фермент катализирует окисление путем дегидрирования янтарной кислоты (сукцината) в фумаровую 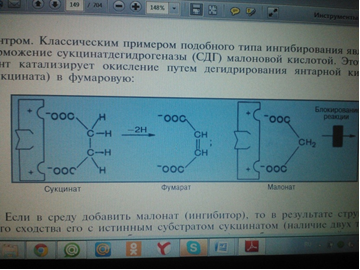 14 билет 1)регуляция активности ферментов по примеру обратной связи 2)классификация и номенклатура ферментов 3)окислительное фосфорилирование,коэффициент р/о 4)формула субстрата окислительного фосфорилирования 5)написать реакцию,катализируемую каталазой 1.Регуляция активности ферментов по принципу обратной связи. Во многих строго биосинтетических реакциях основным типом регуляции скорости многоступенчатого ферментативного процесса является ингибирование по принципу обратной связи. Это означает, что конечный продукт биосинтетической цепи подавляет активность фермента, катализирующего первую стадию синтеза, которая является ключевой для данной цепи реакции. Поскольку конечный продукт структурно отличается от субстрата, он связывается с аллостери-ческим (некаталитическим) центром молекулы фермента, вызывая ингиби-рование всей цепи синтетической реакции. 2. классиф и номенкл.фермен-в В основе классификации лежит тип катализируемой реакции, который является специфич- ным для действия любого фермента. 1)Оксидоредуктазы, катализирующие окисление или восстановление. Пример: каталаза, алкогольдегидрогеназа. 2)Трансферазы, катализирующие перенос химических групп с одной молекулы субстрата на другую. Среди трансфераз особо выделяют киназы, переносящие фосфатную группу, как правило, с молекулы АТФ. 3) Гидролазы, катализирующие гидролиз химических связей. Пример: эстеразы, пепсин, трипсин, амилаза, липопротеинлипаза. 4)Лиазы, катализирующие разрыв химических связей без гидролиза с образованием двойной связи в одном из продуктов. 5) Изомеразы, катализирующие структурные или геометрические изменения в молекуле субстрата. 6)Лигазы, катализирующие образование химических связей между субстратами за счёт гидролиза АТФ. Пример: ДНК-полимераза. 3.Дайте определение окислительномуфосфорилированию. Коэффициент Р/О. Окислительноефосфорилирование - осуществляющийся в живых клетках синтез молекул аденозинтрифосфорной кислоты (АТФ) из аденозиндифосфорной (АДФ) и фосфорной кислот за счёт энергии окисления молекул органических веществ (субстратов). Отношение количества фосфорной кислоты (Р), использованной на фосфорилирование АДФ, к атому кислорода (О), поглощённого в процессе дыхания, называют коэффициентом окислительного фосфорилирования и обозначают Р/О. Окисление молекулы NADH в ЦПЭ сопровождается образованием 3 молекул АТФ; электроны от FAD-зависимых дегидрогеназ поступают в ЦПЭ на KoQ, минуя первый пункт сопряжения. Поэтому образуются только 2 молекулы АТФ. Следовательно, для NADH Р/О = 3, для сукцината Р/О - 2. Эти величины отражают теоретический максимум синтеза АТФ, фактически эта величина меньше. 4.Назовите и напишите формулу субстрата окислительного фосфорилирования. Субстратами окислительного фосфорилирования служат продукты расщепления органических соединений — белки, жиры и углеводы. Но D-глюкоза является универсальным субстратом. 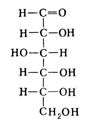 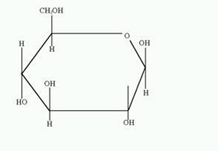 5.Напишите уравнение реакции, катализируемой каталазой  15 билет 1)понятие о неконкурентном ингибировании. Примеры. 2)строение АТФ синтетазногокомплекса,формула АТФ 3)Принципы количественного и качественного определения ферментов 4)Ключевое значение для р/о НАДФН+Н,р/о ФАДН2. 5)Аллостерический центр фермента,биологическое значение. 1.Представление о неконкурентном ингибировании ферментов. Приведите примеры. Ингибиторы этого типа не родственны по своей структуре субстрату данного фермента; в образовании комплекса с ингибитором участвует в этом случае не активный центр фермента, а какая-нибудь другая часть его молекулы. Это не препятствует соединению субстрата с ферментом, но делает невозможным катализ. С повышением концентрации ингибитора скорость реакции все более снижается. К моменту насыщения ингибитором она оказывается практически равной нулю. В отличие от конкурентного инги-бирования в этом случае повышение концентрации субстрата на скорость реакции не влияет. Неконкурентное ингибирование вызывается веществами, не имеющими структурного сходства с субстратами и часто связывающимися не с активным центром, а в другом месте молекулы фермента. Степень торможения во многих случаях определяется продолжительностью действия ингибитора на фермент. При данном типе ингибирования благодаря образованию стабильной ковалентной связи фермент часто подвергается полной инактивации, и тогда торможение становится необратимым. Примером необратимого ингибирования является действие йодацетата, ДФФ, а также диэтил-n-нитрофенилфосфата и солей синильной кислоты. Это действие заключается в связывании и выключении функциональных групп или ионов металлов и молекуле фермента. 2.Строение АТФ-синтазного комплекса. Напишите формулу АТФ 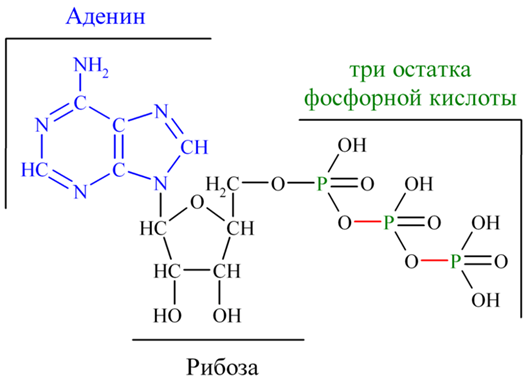 3.Принципы качественного и количественного определения ферментов. Определение количественного содержания ферментов в биологических объектах представляет известные трудности, поскольку, за редким исключением, ферменты в тканях присутствуют в ничтожно малых концентрациях. Поэтому о количестве ферментов судят по скорости катализируемой реакции в определенных, согласованных условиях измерения. При оптимальных условиях температуры, рН среды и полном насыщении фермента субстратом скорость катализируемой реакции пропорциональна концентрации фермента. О скорости ферментативнойреакции судят или по скорости убыли субстрата, или по скорости образования продукта реакции. Для выражения концентрации фермента и количественной оценки его активности в условных единицах Комиссией по ферментам Международного биохимического союза была рекомендована стандартная международная единица (Е или U): за единицу активности любого фермента принимается то количество его, которое в оптимальных условиях катализирует превращение 1 микромоля субстрата или образование 1 микромоля продукта в минуту (мкмоль/мин). В связи с введением Международной системы единиц (СИ) предложено новое выражение активности фермента в каталах (кат, kat): 1 кат есть каталитическая активность, способная осуществлять реакцию со скоростью, равной 1 молю в 1 с (1 моль/с). Отношение международной единицы (U) к каталу можно выразить следующим образом: 1 кат = 1 моль•с–1 = 60 моль•мин–1 = 60•106 мкмоль•мин–1 = 6•107 U, или: 1 U = 1 мкмоль•мин–1 = (1/60) мкмоль•с–1 = (1/60) мккат = 16,67 нкат. Таким образом, 1 U фермента соответствует 16,67 нкат. Рекомендовано, кроме того, измерять активность фермента при температуре 25°С, оптимуме рН и концентрации субстрата, превышающейконцентрацию насыщения. В этих случаях скорость соответствует нулевому порядку реакции в отношении субстрата и будет зависеть только от концентрации фермента. Для выражения активности в практической работе с ферментами часто пользуются произвольными понятиями удельной и молярнойактивности. Удельную активность фермента принято выражать числом единиц ферментативной активности на 1 мг белка (или числом каталов на 1 кг активного белка). Количество молекул субстрата, подвергающихся превращению одной молекулой фермента в продукт в процессереакции в единицу времени при полном насыщении фермента субстратом, принято называть числом оборотов фермента, или молярнойактивностью (молярная каталитическая активность выражается в каталах на 1 г-моль фермента). Одна молекула каталазы эритроцитовспособна, например, расщепить в 1 с 44000 молекул перекиси водорода. 4.Каково числовое значение для Р/ОНАДН + Н+ и для Р/ОФАДН2. для Р/ОНАДН + Н+ =3; для Р/ОФАДН2=2. 5. Дайте определение аллостерическому центру ферментов. Каково его биологическое значение. Аллостерический центр представляет собой участок молекулы фермента, в результате присоединения к какого определенного низкомолекулярного (а иногда - и высокомолекулярного) вещества изменяется третичная структура белковой молекулы. Вследствие этого изменяется конфигурация активного центра, сопровождающаяся либо увеличением, либо понижением каталитической активности фермента. Это явление лежит в основе аллостерической регуляции каталитической активности ферментов. |
