Ферменты (тесты). 1. Что такое ферменты и какую роль они выполняют в организме
 Скачать 1.49 Mb. Скачать 1.49 Mb.
|
|
1 билет  1.Что такое ферменты и какую роль они выполняют в организме?-высокоспециализированный класс веществ белковой природы, используемый живыми организмами для осуществления с высокой скоростью многих тысяч взаимосвязанных химических реакций, включая синтез, распад и взаимопревращение огромного множества разнообразных химических соединений. Жизнь и многообразие ее проявлений – сложная совокупность химических реакций, катализируемых специфическими ферментами. 2.Что является общим для ферментов и неорганических катализаторов? 1)катализируют только энергетически возможные реакции; 2)не изменяют равновесия в обратимых реакциях; 3)не изменяют направление реакции; 4)не расходуются в результате реакции. 3.Строение и характеристика цитохромов. Цитохромы (гемопротеины) — это маленькие глобулярные белки (в первом приближении их структура может быть представлена в виде шара или вытянутого эллипсоида), которые содержат ковалентно связанный гем, расположенный во внутреннем кармане, образованном аминокислотными остатками. Цитохромы присутствуют во всех клетках организмов. В клетках эукариот они локализованы в митохондриальных мембранах. Цитохромы катализируют окислительно-восстановительные реакции. Известно около 30 видов цитохромов. Все они содержат гем в качестве простетической группы и различаются структурами боковых и полипептидных цепей. В зависимости от типа гема выделяют 8 классов цитохромов. В зависимости от спектров поглощения, цитохромы делят на группы a, b, c. 4.Роль АТФ-синтазы в тканевом дыхании. АТФ-синтаза производит АТФ за счёт энергии электрохимического потенциала, создаваемого электронной транспортной цепочкой. В целом данный процесс называется окислительным фосфорилированием. Он протекает и в митохондриях эукариот, на внутренней мембране которых расположены молекулы АТФ-синтазы, причём компонент F1находится в матриксе, где и протекает процесс синтеза АТФ из АДФ и фосфата. электрохим. потенциал вынуждает протоны двигаться с наружнойпов-сти вовнутрь. Но мембрана не проницаема для них, за исключением тех участков, где расположен фермент Н+ АТФ -синтетаза. Протоны движутся через канал АТФ-синтазы, и энергия этого движения используется для образования АТФ. 5.Как можно доказать специфичность действия альфа-амилазы слюны? Специфический субстрат для а-амилазы -полисахариды: крахмал (и гликоген). Доказательство: 1.проба Троммера с крахмалом отрицательна, т.к. не свободных кетонных и альдегидных групп. 2.р-р крахмала+разбавл.р-р слюны, Т=37'С на 10 минут. 3.+проба Троммера. Положительная. Происходит восстановление гидрата окиси меди, можно сделать вывод, что крахмал гидролизовался. 4. При проведении аналогичного опыта с сахарозой -проба Троммера отрицательна на начало и на конец эксперимента, т.е. под воздействием а-амилазы она не гидролизуется. 2 билет. 1.Хим природа ферментов. Как это можно доказать? 2. Разница между простетической группой и коферментом. 3 расположить в правильной последовательности комплексы в тканевом дыхании. Расшифровать каждый комплекс. 4. Какова хмм природа оксидоредуктаз? 5. Какие реакции позволяют доказать специфичность сахаразы. Напишите уравнение реакции гидролиза сахарозы с сахаразой 1.Какова химическая природа ферментов и как это можно доказать? Белковая. Доказательства: 1) гидролиз до аминокислот; 2) амфотерные свойства, способность к электрофорезу; 3) денатурация при УФ, рентгеновском облучении, действии ультразвука, кислот, щелочей, тяжелых металлов; 4) высокая мол.масса; 5) осаждение под действием солей без потери каталитических свойств; 6) потеря активности при кипячении. 2.В чем заключается разница между простетической группой ферментов и коферментом? Простетическая группа прочно, ковалентно связана с апоферментом. Кофермент слабо, нековалентно связан с апоферментом. 3.Расположите в правильной последовательности комплексы тканевого дыхания. I комплекс (НАДН-КоQН2-редуктаза) – принимает электроны от митохондриального НАДН и транспортирует их на КоQ. Протоны транспортируются в межмембранное пространство. Промежуточным акцептором и переносчиком протонов и электронов являются ФМН и железосерные белки. I комплекс разделяет поток электронов и протонов. II комплекс – сукцинат – КоQ - редуктаза – включает ФАД- зависимые дегидрогеназы и железосерные белки. Он транспортирует электроны и протоны от флавинзависимых субстратов на убихинон, с образованием промежуточного ФАДН2. Убихинон легко перемещается по мембране и передает электроны на III комплекс. III комплекс – КоQН2 - цитохром с - редуктаза – имеет в своем составе цитохромы b и с1, а также железосерные белки. Функционирование КоQ с III комплексом приводит к разделению потока протонов и электронов: протоны из матрикса перекачиваются в межмембранное пространство митохондрий, а электроны транспортируются далее по ЦТД (цепь тканевого дыхания). IV комплекс – цитохром а - цитохромоксидаза – содержит цитохромоксидазу и транспортирует электроны на кислород с промежуточного переносчика цитохрома с, который является подвижным компонентом цепи. Существует 2 разновидности ЦТД: Полная цепь – в нее вступают пиридинзависимые субстраты и предают атомы водорода на НАД-зависимые дегидрогеназы Неполная (укороченная или редуцированная) ЦТД в которой атомы водорода передаются от ФАД-зависимых субстратов, в обход первого комплекса. 4. Какова химическая природа оксидоредуктаз? По химической природе двухкомпонентны. Белковый компонент и небелковый(НАД, НАДФ, ФАД, ФМН, убихинон, глутатион, липоевая кислота). 5.Какие реакции позволяют доказать специфичность действия сахаразы? Напишите уравнение реакции гидролиза сахарозы сахаразой. Для выявления специфичности сахаразы наливают в одну пробирку 10 капель 1% р-ра крахмала, в другую-10 капель 2% р-ра сахаразы. В обе пробирки добавляют по 5 капель сахаразы дрожжей, ставят в термостат на 10-15 мин. Проделывают пробу Троммера. Там, где в качестве субстрата была сахароза наблюдается восстановление гидрата окиси меди, что указывает на расщепление сахарозы под влиянием сахаразы. В пробирке с крахмалом проба Троммера отрицательная; следовательно крахмал не является субстратом для сахаразы. 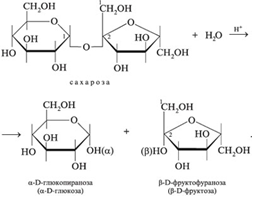 3билет. 1) Активный центр. 2)Изоферменты. 4)Дегидрогеназы. 5)Общие свойства ферментов. 6)Проба троммера на сахарозу и почему эта проба положительна только после гидролиза сахарозы 1.Как построен и функционирует активный центр ферментов? Образован боковыми группами аминокислотных остатков пептидной цепи. Структура АЦ фермента комплементарна структуре его субстрата, вследствие чего данный фермент из множества веществ присоединяет только свой субстрат. В АЦ условно различают каталитический центр, непосредственно вступающий в химическое взаимодействие с субстратом, и связывающий центр (контактная -"якорная"- площадка). СЦ обеспечивает специфическое сродство к субстрату и формирование его комплекса с ферментом 2.Дайте определение изоферментам и приведите примеры. Изоферменты, или изоэнзимы — это различные по аминокислотной последовательности изоформы или изотипы одного и того же фермента, существующие в одном организме, но, как правило, в разных его клетках, тканях или органах.Они катализируют одну и ту же реакцию, но отличаются по некоторым функциональным свойствам в силу отличий по: - аминокислотному составу; - электрофоретической подвижности; - молекулярной массе; - кинетике ферментативных реакций; - способу регуляции; - стабильности и др. Примеры изоферментов: глюкокиназа и гексокиназа. 3. В чем заключается действие дегидрогеназ? Приведите примеры. Дегидрогеназы-группа ферментов из класса оксидоредуктаз, катализирующих перенос протонов от субстрата и пары электронов - к акцептору. Дегидрогеназы представлены в реакциях углеводного (цикл Кребса, пируватдегидрогеназа) и жирового обмена, окисления изоцитратдегидрогеназа, альфакетоглутаратдегидрогеназа. 4.Каковы общие свойства ферментов? 1) ускорение течения реакций; 2) строгая специфичность действия; 3) термолабильность (зависимость от температуры); 4) зависимость от рН среды. 5. Почему сахароза до гидролиза не открывается пробой Троммера? Сахароза не дает пробу Троммера, т.к. в ее молекуле нет свободной альдегидной или кетоннойкруппы вследствие дигликозидной связи между остатками глюкозы и фруктозы. После гидролиза сахарозы освобождается альдегидная группа глюкозы и кетонная группа фруктозы.ю которые и обуславливают положительную реакцию Троммера билет № 4 1) Классификация ферментов.примеры 2)к какому классу относят альфа-амилазу слюны? 3)Какие соединения могут быть коферментами дегидрогеназы? примеры. 4)Что такое донаторы и акцепторы водорода (электронов и протонов) 5)Каково значение альфа-амилазы и сахаразы для пищеварения? 1. Как классифицируют ферменты? Приведите примеры. В основе классификации лежит тип катализируемой реакции, который является специфич- ным для действия любого фермента. 1)Оксидоредуктазы, катализирующие окисление или восстановление. Пример: каталаза, алкогольдегидрогеназа. 2)Трансферазы, катализирующие перенос химических групп с одной молекулы субстрата на другую. Среди трансфераз особо выделяют киназы, переносящие фосфатную группу, как правило, с молекулы АТФ. 3) Гидролазы, катализирующие гидролиз химических связей. Пример: эстеразы, пепсин, трипсин, амилаза, липопротеинлипаза. 4)Лиазы, катализирующие разрыв химических связей без гидролиза с образованием двойной связи в одном из продуктов. 5) Изомеразы, катализирующие структурные или геометрические изменения в молекуле субстрата. 6)Лигазы, катализирующие образование химических связей между субстратами за счёт гидролиза АТФ. Пример: ДНК-полимераза. 2. К какому классу ферментов относится альфа-амилаза слюны? Класс гидролаз. 3. Какие соединения могут быть коферментами дегидрогеназ? Приведите примеры. Дегидрогеназы - это оксидоредуктазы, катализирующие процесс отщепления атомов водорода. Все дегидрогеназы являются холоферментами, коферментами которых служат следующие соединения: никотинамидаденинди-нуклеотид (НАД), никотинамидадениндинуклеотид (НАДФ), флавинмононуклеотид (ФМН), флавинадениндинуклеотид (ФАД), хиноны. Наиболее распространены в природе дегидрогеназы, содержащие в качестве кофермента НАД: 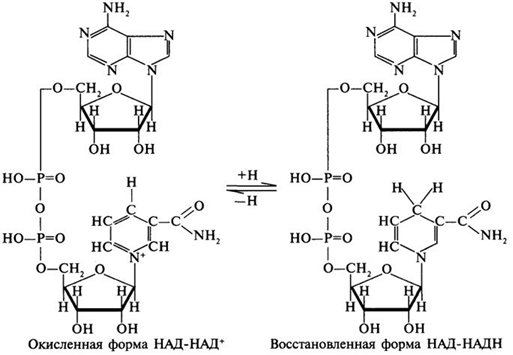 4. Что такое донаторы и акцепторы водорода (электронов и протонов)? Окислительно-восстановительные ферменты осуществляют перенос водорода и кислорода в процессе дыхания. Вещество, отдающее водород, называется донатором водорода, а вещество, принимающее водород, - акцептором. Отдающее водород (электрон) вещество окисляется, получающее водород (электрон) - восстанавливается. Из окислительно-восстановительных ферментов дегидразы активизируют водород и переносят его от одной молекулы органического вещества к другой. Оксидазы активизируют и переносят молекулярный кислород 5.Каково значение альфа-амилазы и сахаразы для пищеварения? Альфа-амилаза является гидролитическим ферментом и расщепляет 1,4-глюкозидные связи в молекулах крахмала и гликогена с образованием декстринов, а затем мальтозы и сахарозы. У человека α-амилаза являет-ся основным пищеваритель-ным ферментом. Амилаза обеспечивает переваривание углеводов пищи, расщепляя их и преобразуя в глюкозу. Благодаря этому же ферменту глюкоза усваивается организ-мом. Амилаза слюнных желез начинает этот процесс и может фактически совершить переваривание значительной части крахмала до поступ-ления его в тонкую кишку и контакта с панкреатической амилазой. Основное переваривание углеводов происходит в тонком кишечнике, где для этого имеются все необходи-мые условия: слабощелочная среда и ферменты, катали-зирующие распад гликозидных связей в углеводах Сахараза является ферментом тонкой кишки и расщепляет сахарозу до глюкозы и фруктозы. 5 билет 1.специчность белков. Примеры. 2. Почему проявляется проба троммера с мальтозой 3.ферменты цитохромной системы 4.второй класс ферментов 5.конечный акцептор электронов и протонов в тканевом дыхании 1. 2.На основании каких свойств мальтозы она открывается пробой Троммера? Мальтоза имеет свободные альдегидные группы, вследствие чего она обладают восстановительной способностью и открывается пробой Троммера. 3. Какие ферменты входят в состав цитохромной системы? Железосодержащие ферменты. Цитохромная система относится к оксидазам. Цитохромная система состоит из цитохромов, а также фермента цитохромоксидазы. Цитохромы — это протеиды, активной группой которых является гемин (по своим свойствам и строению близка к простетической группе гемоглобина крови). Цитохромывыполняют роль акцепторов (приемщиков) и переносчиков электронов. Цитохромоксидаза активирует молекулярный кислород, при помощи которого окисляется восстановленный цитохром. 4. Второй класс ферментов и реакции, которые они катализируют. Согласно международной классификации и номенклатуре ко 2 классу ферментов относятся трансферазы. Трансферазы катализируют реакции переноса функциональных групп и молекулярных остатков с одной молекулы на другую. Реакции, катализируемые трансферазами, в общем случае выглядят так: A—X + B ↔ A + B—X. В зависимости от характера переносимых групп выделяют: 1)Фосфотрансферазы - это ферменты, катализирующие перенос остатка фосфорной кислоты. 2)Аминотрансферазы ускоряют перенос аминогруппы. 3)Гликозилтрансферазы ускоряют реакции переноса гликозильных остатков, 4)Ацилтрансферазы катализируют процессы переноса ацилов (радикалов карбоновых кислот) на спирты, амины, аминокислоты и другие соединения. и др. 5. Что является конечным акцептором электронов и протонов, переносимых от окисляемых веществ? кислород-конечный акцептор протонов и электронов, переносимых от окисляемых веществ. Образуется вода. билет 6: 1.Факторы влияющие на активность ферментов, 2. 3класс ферментов и реакции ,которые они катализируют, 3. формула кофермента дегидрогеназ, в состав которых входит витамин ниацин, 4. комплексы дыхат цепи и где они локализованы, 5. активаторы и ингибиторы ф, привести примеры активатора и ингибитора амилазы слюны 1. Укажите факторы, влияющие на активность ферментов. 1) рН 2) Т 3) Силы, действующие в текучих средах (гидродинамические силы, гидростатическое давление и поверхностное натяжение) 4) Химические агенты ( мочевина, спирт, пероксид водорода) 5) Облучение (свет, звук, ионизирующая радиация) 2. Третий класс ферментов и реакции, которые они катализируют. Гидролазы катализируют гидролиз химических связей. Гидролиз сложноэфирных связей (эстеразы), связи С—N в пептидах и белках (пептидгидролазы), связей С—Nв амидах, амидинах и нитрилах, олиго- и полисахаридов, связи элемент-кислород в ангидридах, |
