Биохимия. Ответы на итог по ферментам и белкам. биохим. 1. Дать определение и характеризовать первичную структуру белка
 Скачать 1.03 Mb. Скачать 1.03 Mb.
|
|
1. Дать определение и характеризовать первичную структуру белка. Первичная структура – последовательность аминокислотных остатков, соединенных пептидной связью. Начинается со свободной аминогруппы (N-конец), завершается свободной карбоксильной группой (С – конец). К первичной структуре можно отнести дисульфидные мостики, образованные остатками цистеина. – S – S – Следовательно, первичная структура стабилизируется ковалентными связями между аминокислотными остатками. 2. Дать определение вторичной структуре белка. Охарактеризовать связи, стабилизирующие структуру. Вторичная структура белка – это способ укладки полипептидной цепи в более компактную структуру, при которой происходит взаимодействие пептидных групп с образованием между ними водородных связей. α – спираль – поддерживается водородными связями между пептидными связями. Водородные связи играют роль во взаимодействии между молекулами Н2О, поддержании структуры белков, нуклеиновых кислот. Они всегда возникают между электроотрицательным атомом (N или О) и Н, который связан ковалентной связью с электроотрицательным атомом. 3. Дать определение и характеризовать третичную структуру белка. Определение нативной конформации. Третичная - специфичная для каждого белка пространственная упаковка молекулы. Имеющие гидрофобный характер радикалы аминокислотных остатков ориентированы внутрь молекулы, а гидрофильные ( О+, NН3+, СОО- ) – на поверхности молекулы. Структуру поддерживают гидрофобные взаимодействия межу углеводородными радикалами аминокислот. Нативная конформация опеределяется инструкциями, заключенными в аминокислотной последовательности. 4. Дать определение и характеризовать четвертичную структуру белка. Что такое олигомерные белки? Четвертичная – нежесткое соединение отдельных третичных образований, которые называются субъединицами. Поддерживается водородными связями. Классический пример – гемоглобин, состоит из 4 субъединиц. Олигомерные белки – состоят из 2 и более полипептидных цепей (субъединиц). 5. Правила образования полипептидной цепи и пептидной связи. 1) соединяем фрагменты N-C-C последовательно. Число фрагментов=числу амк. 2) обозначаем концы; слева N- конец, справа COOH-. 3) находим α-углеродный атом. К каждому 1-му атому С добавляем H и радикалы в транс-положении. 4) записываем к С – кислород (второй атом С), к N –водород. 5) называем пептид. Все аминокислоты с окончанием «ил», кроме последней – «ин». 6. Дать определения: олигомерные белки, нативная конформация. Привести примеры. Дать определение понятиям простой и сложный белок. Привести примеры. Олигомерные белки – состоят из 2 и более полипептидных цепей (субъединиц). (прим. Гемоглобин). Функционально активная конформация белка называется нативной конформацией. Нативная конформация опеределяется инструкциями, заключенными в аминокислотной последовательности. Сложные белки или протеиды состоят в отличие от простых из белковой части и небелковой, которая называется простетической группой. Простой белок состоит только из аминокислотных остатков. 7. 8. (самостоятельно 20 амк). 9.. Что такое денатурация? Перечислите факторы, вызывающие денатурацию. Перечислите 20 аминокислот и записать формулу в общем виде. Денатурация – утрата трехмерной конформации белка. Бывает обратимая и необратимая.    10. Какую реакцию необходимо провести для обнаружения белка? Как известно, белок молока (казеин) сворачивается, выпадая в осадок при кипячении, если молоко кислое. Чем это можно объяснить? Присутствие белка в растворе можно обнаружить с помощью качественных реакций, в результате которых образуются окрашенные продукты. Если к раствору белка добавить раствор щёлочи и несколько капель раствора сульфата меди(II), то появляется красно-фиолетовое окрашивание. При кипячении молока казеин всегда денатурирует, но выпадает в осадок тогда, когда лишен заряда, а это происходит в кислом молоке. Следовательно, ИЭТ казеина находится в кислой среде, т.е. суммарный заряд белка=0. 11. Растворимость белков: факторы, влияющие на растворимость белков. Растворимость белков зависит от их структуры, величины рН, солевого состава раствора, температуры и других факторов и определяется природой тех групп, которые находятся на поверхности белковой молекулы. 12. Методы очистки и методы разделения белков. Для разделения белков часто используют хроматографические методы, основанные на распределении веществ между двумя фазами, одна из которых подвижная, а другая неподвижная. Электрофорез основан на свойстве заряженных молекул белка перемещаться в электрическом поле со скоростью, пропорциональной их суммарному заряду. 13.Методы выделения и очистки белков: охарактеризовать метод гель-фильтрации, ультрацентрифугирования. Единицы седиментации. Гель-фильтрация основана на разделении белков по величине и форме молекулы. Разделение проводят в хроматографических колонках, заполненных гранулами пористого геля (сефадекса, агарозы), в буферном растворе с определенным значением рН. Ультрацентрифугирование - метод разделения жидких дисперсных сред на компоненты под действием центробежной силы. Единицей константы седиментации является сведберг. 14. Что такое ИЭТ? Необходимо из смеси белков сконцентрировать один из белков с известным значением ИЭТ. Как действовать располагая набором кислот, оснований и этанолом? Изоэлектрическая точка – значение рН, при котором белок теряет заряд. В изоэлектрической точке белки наименее устойчивы в растворе и легко выпадают в осадок. Например, при рН 1,5 пепсин теряется как фермент. РН раствора – это и будет иэт. Заряд р-ра белка в иэт и заряд самого белка противоположны. (заряд р-ра = «-», т.е. заряд среды будет «+») 15. Методы выделения и очистки белков: перечислить и охарактеризовать диализ и гель- фильтрацию. Гель-фильтрация основана на разделении белков по величине и форме молекулы. Разделение проводят в хроматографических колонках, заполненных гранулами пористого геля (сефадекса, агарозы), в буферном растворе с определенным значением рН. Метод диализа используется для очистки высокомолекулярных соединений от низкомолекулярных, а также концентрирования растворов полимеров. Используют диализную мембрану, которая является полимером и имеет поры определенной величины. Малые молекулы (низкомолекулярные примеси) проходят через поры в мембране, а крупные (белки) задерживаются. 16. 17. Строение гема. Охарактеризовать связи Fe в геме. Гем – структура, включающая в себя порфириновое кольцо (состоящее из 4 пиррольных колец) и иона Fe2+. Железо связывается с порфириновым кольцом двумя координационными и двумя ковалентными связями. Железо в геме находится в восстановленном состоянии (Fe+2) и связано двумя ковалентными и двумя координационными связями с атомами азота пиррольных колец. Гем соединяется с белковой частью (глобином) гидрофобными связями между пиррольными циклами и гидрофобными радикалами аминокислот. 18. Строение гемоглобина А человека. 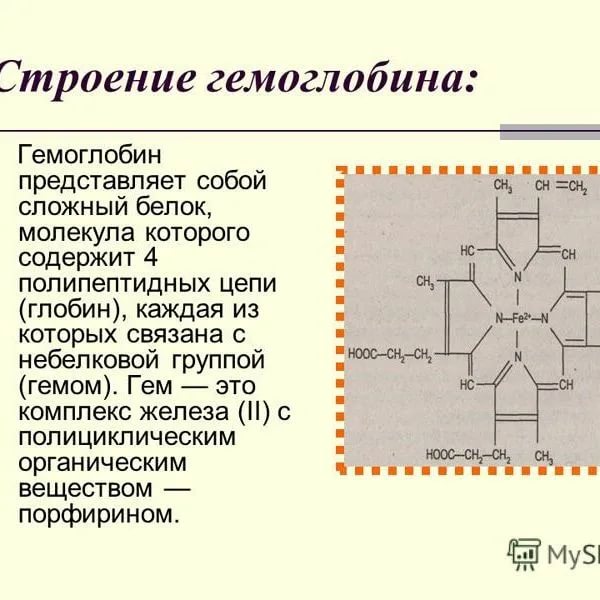 19. Строение одного протомера гемоглобина. Связи между белковой частью и простетической группой. Сложные белки или протеиды состоят в отличие от простых из белковой части и небелковой, которая называется простетической группой. Гемоглобин является сложным белком хромопротеином, состоит из простого белка глобина и небелковой части: четырех молекул гема. Строение одного протомера. Каждый протомер имеет белковую часть и небелковую – гем.  20. Охарактеризовать класс сложных белков: нуклеопротеинов на примере рибонуклеопротеинов (рибосома). Нуклеопротеины – сложные белки, которые в качестве простетической группы содержат нуклеиновые кислоты: ДНК и РНК. Простетическая группа РНК – рубонуклеопротеины. Пример, рибосома эукариот. Рибосма состоит из двух субъединиц – большой и малой. Белковая часть большой субъединицы представлена около 50 молекул различных белков, небелковая – тремя молекулами РНК (двух «легкой» и одной «тяжелой»). Белковая часть малой субъединицы представлена 33 белками и одной «средней» молекулой РНК. 21. Механизм присоединения кислорода к гемоглобину. Присоединение кослорода к гемоглобину носит кооперативный характер (труднее всего присоединяется первая молекула кислорода, а каждая последующая все легче). Присоединение первой молекулы О2 с -протомером происходит трудно, происходит изменение конформации -протомера (атом железа входит в плоскость гемма и «тянет за собой ППЦ»). При этом рвутся две ионные связи между и субъединицами. Субъединицы приобретают большую подвижность, что облегчает присоединение второй молекулы О2 к гему -субъединицы. Оставшиеся две - ионные связи при этом также разрываются, что дает возможность остальным гемам принять выгодное положение для присоединения кислорода. третья молекула кислорода соединяется с субъединицей. Одна из ионных связей - разрываются. облегчая доступ кислороду к последнему атому железа гема . при этом разрывается последняя ионная связь -. В итоге 4-я молекула кислорода присоединяется к О2 примерно в 300 раз легче, чем 1-я. 22. Структура одного протомера гемоглобина в Т-форме. Связи между протомерами, связи железа в протомере, связи гема с глобином. Молекула гемоглобин существует в двух формах: «напряженной» (Т) и « релаксированной» (R) . Первая характерна для дезоксигемоглобина. Т- форма более жесткая, в отличие от R-формы она имеет 8 солевых мостиков: 1. Четыре солевых мостика между -протомерами. 2. Два солевых мостика между разными протомерами: между и и между и . 3. По одному солевому мостику внутри каждого -протомера. В образовании четырех солевых мостиков участвуют С-концевые карбоксильные группы и боковые аминогруппы четырех лизинов, находящихся внутри -цепей. В образовании других четырех солевых мостиков участвуют боковые карбоксильные группы четырех аспарагиновых кислот, с одной стороны, и боковые группы двух аргининов и двух гистидинов - с другой. При присоединении кислорода солевые мостики разрушаются, и Т- форма переходит в более компактную форму. Связь гема и глобина осуществляется, во-первых, за счет координационной связи атома железа с гистидином глобина, а во-вторых, за счет гидрофобных взаимодействий радикалов аминокислот глобина с метильными и винильными радикалами гема. 23. Сходство и различия структур и функций миоглобина и гемоглобина. Ключевое различие между гемоглобином и миоглобином состоит в том, что гемоглобин обнаружен в эритроцитах, и он имеет тетрамерную структуру, в то время как миоглобин находится в мышцах и имеет мономерную структуру. Как гемоглобин, так и миоглобин являются белками, которые обладают способностью переносить кислород. 24. Охарактеризовать класс сложных белков: фосфопротеинов. Фосфопротеины – сложные белки, содержащие в качестве небелковой части остатки фосфорной кислоты (0,5-0,9 %). Например, казеиноген (казеин) молока является полноценным белком, содержащим все незаменимые аминокислоты, выполняет питательную функцию. В молоке он связан не только с остатками фосфорной кислоты, но и с ионами кальция (кальций и фосфор находятся в физиологически оптимальном соотношении, поэтому они хорошо усваиваются). 27. Охарактеризовать класс сложных белков: нуклеопротеинов (на примере нуклеосомы). Структурная единица хроматина – нуклеосома – обеспечивает ультракомпактность упаковки ДНК. Белковая часть представлена гистонами. Это небольшие белки с высоким содержанием лизина и аргинина. По относительному содержанию лизина и аргинина их делят на пять типов: Н1, Н2А, Н2В, Н3 и Н4. каждая нуклеосома состоит из четырех пар молекул гистонов – 2 Н2А, 2 Н2В, 2Н3, 2Н4, обвитые снаружи суперспиралью ДНК со 150 оснований. Положительнозаряженные группы лизина и аргинина белковой части взаимодействуют с отрицательнозаряженными группами остатков фосфорной кислоты ДНК. Между нуклеосомами находиться участок ДНК (30 пар оснований) – линкерный участок, которая связана лишь с одной молекулой белка Н1. 29. Гемоглобинопатии. Гемоглобинопатии – это группа тяжелых наследственных заболеваний крови, обусловленных нарушением структуры гемоглобина или снижением синтеза одной и более глобиновых цепей. Клиническая картина крайне разнообразна 30. Строение фермента: активный центр, ко-факторы, аллостерический центр. Активный центр – небольшой участок фермента, который образован радикалами аминокислотных остатков, которые на уровне третичной структуры формируют центр взаимодействия с субстратом (центр, комплементарный субстрату). АлЦ – (есть не у всех ферментов) = регуляторный центр, т.к. к нему могут присоединяться активаторы и ингибиторы и регулировать активность ферментов. АлЦ и АЦ должны быть пространственно разделены: АЦ в одной субъединице, АлЦ - в другой. Кофакторы – вещества небелковой природы, необходимые для проявления активности ферментов (есть не у всех ферментов) 31. Классификация и номенклатура ферментов. Примеры.  32. Что такое изоферменты (на примере изоферментов ЛДГ)? Значение определения изоферментов в сыворотке крови. Изоферменты – множественные формы фермента, которые катализируют одну и ту же реакцию, но в разных органах. Например, ЛДГ (лактатдегидрогеназа) катализирует реакции ПВК ↔ лактат в разных органах. Фермент состоит из 4 субъединиц двух типов: Н и М. И существует 5 типов (изоформ) фермента. 33. Строение ферментов. Активный центр (АЦ) Аллостерический центр (АлЦ) Кофакторы 34. Зависимость скорости ферментативной реакции от концентрации субстрата. Понятие о константе Михаэлиса. Уравнение. константа Михаэлиса - равна концентрации субстрата, при которой скорость реакции составляет половину от максимальной.  35. Зависимость скорости ферментативной реакции от рH среды: нарисовать и охарактеризовать график, причины. Влияние кислотности среды на скорость ферментативных реакций обусловлено тем, что при изменении кислотности меняется конформация всей белковой молекулы фермента и, в том числе, изменяется конформация активного центра и способность его осуществлять катализ. При рН-оптимуме фермент находится в оптимальной для проявления каталитических свойств конформации. При небольшом отклонении величины кислотности от рН-оптимума наблюдается незначительное изменение конформации, носящее обратимый характер. При значительном отклонении от рН-оптимума (в сильно кислой и сильно щелочной среде) происходит необратимая денатурация ферментного белка, приводящая к полной утрате каталитической активности. 43. Ко-факторы ферментов. Коферменты Производные витаминов Участвуют в ферментативных реакциях Переносят различные группы В ходе ферментативных реакций претерпевают изменения, противоположные изменениям в субстрате. 44. Охарактеризуйте виды регуляции активности ферментов (4 типа). Путем фосфорилирования или дефосфорилирования. Частичный протеолиз (отщепление части ппц) – необратимый тип. При помощи белок-белковых взаимодействий (обратимая реакция) Аллостерическая регуляция (обратимая реакция) 45. Охарактеризуйте виды ингибирования ферментов: обратимое (конкурентное, неконкурентное); необратимое (специфическое, неспецифическое).   51. Применение ферментов в медицине: энзимодиагностика, энзимотерапия. Примеры.  |
