диффуя. материаловедение 1. 1 Диффузия 3 1 Механизмы протекания диффузии 3
 Скачать 171.35 Kb. Скачать 171.35 Kb.
|
СОДЕРЖАНИЕВведение 2 1 Диффузия 3 1.1 Механизмы протекания диффузии 3 1.2Кристаллическое строение металлов 6 2.1 Дендритная кристаллизация металлов 8 2.1 Дефекты кристаллического строения металлов (дислокация) и их влияние на прочность 12 Заключение 15 Список литературы 16 ВведениеДиффузия в сплавах представляет собой перенос разнородных атомов, который сопровождается изменением концентрации компонентов в отдельных зонах. Самодиффузией называют перемещение атомов одного и того же типа в чистых металлах или основного компонента - в сплавах. Диффузия атомов внедрения с малым атомным радиусом, например углерода в решетке железа, осуществляется межузельным путем . Этот процесс довольно легко реализуется благодаря тому, что число внедренных атомов в решетке мало по сравнению с числом междоузлий. Металловедение - наука, устанавливающая связь между составом, структурой и свойствами металлов и сплавов и изучающая закономерности их изменения при физических или химических воздействиях. Металлы и сплавы принято делить на две группы: черные металлы и сплавы - железо и сплавы на его основе; цветные металлы и сплавы. Кобальт, никель и марганец часто относят к металлам железной группы. Цветные металлы разделяют на легкие; легкоплавкие; тугоплавкие; благородные; обладающие химической инертностью; урановые; редкоземельные; лантаноиды; щелочноземельные. Общим для всех металлов является: характерный металлический блеск, хорошая отражательная способность и непрозрачность; высокие пластические свойства; высокая теплопроводность и электропроводимость; зависимость электропроводимости от температуры; термоэлектронная эмиссия - способность испускать электроны при нагреве. 1 Диффузия1.1 Механизмы протекания диффузииДиффузия — движение частиц среды, приводящее к необратимому переносу вещества или к установлению равновесного распределения концентраций частиц данного сорта в среде. В качестве диффундирующих частиц рассматривают молекулы, атомы, электроны проводимости, дырки, нейтроны и другие частицы. Диффузия в металлах приводит к переносу атомов на расстояния, превышающие межатомные расстояния для данного вещества. Частным случаем диффузии в чистом веществе или растворе постоянного состава, при котором диффундируют собственные частицы вещества, а его химический состав не меняется, является самодиффузия. При самодиффузии диффузионные перемещения частиц твердого вещества могут приводить к изменению его формы и другим явлениям. Так, длительное воздействие сил поверхностного натяжения, тяжести, упругих, электрических и др. может привести к сращиванию двух пришлифованных поверхностей образцов одного и того же вещества, спеканию порошков, растягиванию образцов под действием подвешенного к ним груза (диффузионная ползучесть материалов) и т.д. В отсутствие макроскопического движения среды диффузия молекул (атомов) определяется их тепловым движением. При наличии в среде стационарных перепадов температуры, электрических полей и т.п. диффузия приводит к установлению равновесного распределения концентраций, характеризуемого соответствующими градиентами (термодиффузия, электродиффузия и т.п.). В однородной системе (газ, жидкость) при молекулярной диффузии в отсутствие внешних воздействий диффузионный поток (поток массы) пропорционален градиенту его концентрации. Коэффициент пропорциональности называется коэффициентом диффузии. Последний зависит от строения и структуры взаимодействующих веществ и особенно сильно — от температуры. В твердых кристаллических веществах различают следующие виды диффузии: по механизму протекания, по геометрическому месту переноса атомов, по месту поглощения атомов и по природе процесса.[1] 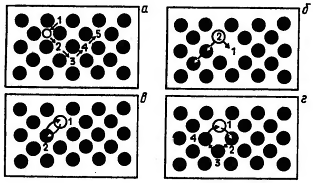 Рис. 1. Схемы механизмов протекания диффузии: а — межузельный; б — вакансионный; в-обменный; г — циклический Механизм протекания диффузии может быть межузелъным, вакансионным, обменным и циклическим (рис. 1). Реализация того или иного механизма протекания диффузии определяется кристаллическим строением вещества и типом дефектов его кристаллической решетки. Так, доказано, что основным механизмом диффузии примесных атомов в твердых растворах замещения является вакансионный, а в твердых растворах внедрения — межузельный. Явление диффузии атомы соприкасающихся металлов диффузия ... По геометрическому месту переноса атомов выделяют объемную, поверхностную (из внешней среды) и граничную (по границам зерен) диффузии. Для совершения элементарного акта диффузии атом должен преодолеть энергетический барьер. Наиболее легко диффузия протекает по поверхности и границам зерен, где сосредоточены дефекты кристаллического строения (вакансии, дислокации и др.). Объемная диффузия в твердых веществах обусловлена перескоками атомов из одного положения в другое, относительно свободное. Поверхностная диффузия связана с переносом вещества или на поверхность материала из внешней среды, или с поверхности материала во внешнюю среду, или на поверхность материала из его объема, или же вглубь материала с его поверхности (сорбционные процессы). 1.2Кристаллическое строение металловВсе металлы и сплавы имеют кристаллическое строение - атомы (ионы) расположены не хаотично, а в определенном порядке. При этом мелкие кристаллы различно ориентированы по отношению друг к другу. В твердом состоянии металл представляет собой систему из положительно заряженных ионов, «омываемых газом» из свободных коллективизированных электронов. В системе действуют электростатические силы притяжения (металлическая связь). Силы связи в металлах определяются силами притяжения и силами отталкивания между электронами и ионами. Атомы располагаются на таком расстоянии друг от друга, на котором суммарная сила взаимодействия минимальна. Поэтому в металлах атомы располагаются закономерно, в геометрически правильном порядке, соприкасаясь внешними электронными сферами, образуя правильную кристаллическую решетку, соответствующую минимальной энергии взаимодействия. Кристаллическая решетка состоит из воображаемых линий и плоскостей, проходящих через точки расположения ионов в пространстве. Наименьший объем кристалла, дающий представление об атомной структуре металла в любом объеме, называется элементарной кристаллической ячейкой. Большинство металлов имеют кристаллическую решетку одного из трех типов: объемно-центрированный куб - ОЦК - имеют металлы РЬ, К, Na, Li, Ti, W, Та, Cr и др.; гранецентрированный куб - ГЦК - имеют металлы Sr, Tn, Pb, Ni, Ag, Au, Pd, Pt и др.; Расстояние между центрами ближайших атомов в элементарной ячейке называется периодом ячейки. Он выражается в нанометрах (1 нм = 10-11 м). На одну элементарную ячейку ОЦК приходятся два атома: один в центре, другой - в вершине куба. На одну элементарную ячейку ОЦК приходятся четыре атома: один в вершине куба, а три - атомы, находящиеся в середине грани. Плотность кристаллической решетки характеризуется координационным числом, равным числу атомов, находящихся на одинаковом и наименьшем расстоянии от рассматриваемого атома. В элементарной ячейке ОЦК расстояние между атомами равно 0,5√3а. На этом расстоянии у атома находятся восемь соседей. Координационное число равно 8 и обозначается К8 (К - кубическая решетка). Плотность упаковки атома (коэффициент компактности ячейки), равная отношению объема, занятого атомами, к объему ячейки, составляет 68 %. Для ГЦК координационное число равно К12; плотность упаковки - 74 %. Для ГПУ в качестве характеристики ячейки принимаются два параметра: сторона шестиугольника а и высота призмы b. Координационное число равно Г12 (Г - гексагональная решетка). В разных сечениях (плоскостях) кристаллической решетки число атомов неодинаково. Поэтому свойства кристалла (механические, физические и химические) в различных направлениях разные. Это свойство кристаллов называется анизотропией.[2] 2 Кристаллизация металлов 2.1 Дендритная кристаллизация металловПри условии очень медленного охлаждения и отсутствии атомов примесей в жидкости рост кристалла от своего зародыша происходит равномерно во всех направлениях. При ускоренном охлаждении, наблюдаемом в большинстве случаев при кристаллизации металлов, механизм образования кристаллов (зерен) носит дендритный характер. Дендритная кристаллизация характеризуется тем, что рост зародышей происходит с неравномерной скоростью. После образования зародыши развиваются главным образом в тех направлениях, в которых скорость роста максимальна. В этих направлениях образуется как бы ствол будущего кристалла, называемый осью (или ветвью) первого порядка. Оси первого порядка не только удлиняются, одновременно они разрастаются в стороны, вследствие чего они толще у основания и тоньше у острия. В дальнейшем от осей первого порядка под определенными углами начинают расти новые оси, которые называются осями второго порядка; от ветвей второго порядка растут ветви третьего порядка и т.д. По мере роста ветви более высокого порядка (четвертого, пятого, шестого и т.д.) постепенно заполняют все промежутки, ранее занятые жидким металлом. Когда все промежутки дендрита заполнены, наблюдать дендритное строение можно только в условиях, когда не хватает жидкого металла для заполнения пространства между осями, например в поверхностных слоях кристаллизующегося металла, так как жидкий металл направляется на заполнение пространства между осями кристаллов, образующихся в нижележащих слоях (т.е. отступает от растущих в поверхностных слоях кристаллов). Рост кристаллов дендритной (разветвленной) формы обусловливают примеси, посторонние атомы в жидкости. Поэтому реальные сплавы затвердевают, образуя преимущественно дендритные кристаллы. Дендритное строение зерен, не различимое при визуальном осмотре, хорошо видно при наблюдении под микроскопом. При заливке в форму (изложницу) большой массы металла он не затвердевает одновременно во всем объеме слитка. Затвердевание начинается у мест, от которых отводится теплота, — у стенок и дна изложницы, а затем распространяется внутрь формы. Поэтому в слитке наблюдаются области (зоны) с неодинаковым строением кристаллов (зерен). Схема строения стального слитка приведена на рис. 2. В слитке имеются три структурные зоны: О зона 1 — мелкие равноосные кристаллы, образующиеся при соприкосновении расплавленного металла с холодными стенками изложницы. Здесь металл переохлаждается и возникает множество центров кристаллизации, тем более что посторонние твердые частицы и выступы на поверхности изложницы создают дополнительные центры кристаллизации. Зона 1 распространяется на небольшую глубину; О зона 2 — крупные столбчатые кристаллы, которые растут перпендикулярно стенкам и дну изложницы, в сторону, обратную направлению отвода теплоты от жидкости; О зона 3 — различно ориентированные равноосные кристаллы разного размера, причем они всегда больше кристаллов зоны 1.[3]  Рис. 2. Схема строения стального слитка С точки зрения механической прочности столбчатые кристаллы для малопластичных металлов нежелательны. Особенно непрочными являются места встречи дендритов, растущих от разных стенок изложницы; здесь образуются различные дефекты — пустоты, неметаллические включения и т.п. Вследствие неравномерной кристаллизации зерен дендритной формы химический состав в разных местах одного и того же дендрита получается неоднородным. Неоднородность состава внутри одного кристалла называют внутрикристаллической или дендритной ликвацией. В результате кристаллизации по зонам в слитке отмечается также ликвация, называемая зональной (макроскопической). Наибольшее скопление примесей наблюдается в центре, в верхней части слитка. При затвердевании и охлаждении слитка происходит сокращение объема, которое называется усадкой. Усадка не может происходить за счет общего понижения уровня металла, так как затвердевание слитка начинается у стенок и дна изложницы, а также с поверхности. Если принять, что сверху слитка поверхностной корки не образуется (это иногда бывает и практически), то слиток будет затвердевать по усадочной схеме, приведенной на рис. 3. 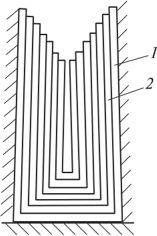 Рис. 3. Схема образования усадочной раковины Затвердевание у стенок изложницы слоя 1 с уменьшением объема вызовет понижение уровня оставшегося жидкого металла, затвердевание слоя 2 и последующих слоев будет вызывать все большее понижение уровня жидкого металла. В результате в слитке получится воронкообразное углубление — усадочная раковина. Под усадочной раковиной обычно располагаются ликва- ционная зона и мелкие усадочные раковинки (поры), которые создают зону, называемую усадочной рыхлостью. Усадочная рыхлость обусловлена образованием между растущими кристаллами отдельных замкнутых объемов металла, в которых происходит местная усадка и появляются мелкие раковины. Та часть слитка, где расположены усадочная раковина, усадочная рыхлость, ликвационная зона, является дефектной частью (прибыльная часть), ее нельзя использовать для изготовления деталей, а необходимо отделить от здоровой части слитка. Перед дальнейшей обработкой давлением прибыльная часть слитка отрубается или отрезается, что дает отход 15—25 % металла. 2.1 Дефекты кристаллического строения металлов (дислокация) и их влияние на прочностьВ кристаллах всегда имеются дефекты (несовершенства) строения, обусловленные нарушением правильного расположения атомов кристаллической решетки. Дефекты кристаллического строения подразделяют по геометрическим признакам на точечные, линейные и поверхностные. Атомы совершают колебательные движений возле узлов решетки, и с повышением температуры амплитуда этих колебаний увеличивается. Большинство атомов данной кристаллической решетки имеют одинаковую (среднюю) энергию и колеблются при данной температуре с одинаковой амплитудой. Однако отдельные атомы обладают энергией, значительно большей средней энергии, и перемещаются из одного места в другое. Наиболее легко перемещаются атомы поверхностного слоя, выходя на поверхность. Место, где находился такой атом, называется вакансией (рис. 2, а).  Рис. 2. Дефекты в кристаллах: а - вакансия, б — внедренный атом, в краевая линейная дислокация, г - неправильное расположение атомов на границе зерен 1 и 2 Рис. 2. Дефекты в кристаллах: а - вакансия, б — внедренный атом, в краевая линейная дислокация, г - неправильное расположение атомов на границе зерен 1 и 2 На это место через некоторое время перемещается один из атомов соседнего слоя и т. д. Таким образом вакансия перемещается в глубь кристалла. С повышением температуры количество вакансий увеличивается и они чаще перемещаются из одного узла в другой. В диффузионных процессах, протекающих в металлах, вакансии играют определяющую роль. К точечным дефектам относят также атом, внедренный в междоузлие кристаллической решетки (рис. 2, б), и замещенный атом, когда место атома одного металла замещается в кристаллической решетке другим, чужеродным атомом. Точечные дефекты вызывают местное искажение кристаллической решетки. Линейные дефекты являются другим важнейшим видом несовершенства кристаллической решетки, когда в результате сдвига на одно межатомное расстояние одной части решетки относительно другой вдоль какой-либо плоскости число рядов атомов в верхней части решетки на один больше, чем в нижней. В данном случае в верхней части решетки появилась как бы лишняя атомная плоскость (экстраплоскость). Край экстраплоскости, перпендикулярный направлению сдвига, называется краевой, или линейной, дислокацией (рис. 2, в), длина которой может достигать многих тысяч межатомных расстояний. Шириной дислокации считают расстояние от центра дефекта до места решетки без искажения. Ширина дислокации мала и составляет несколько атомных расстояний. Кристаллическая решетка в зоне дислокации упруго искажена, поскольку атомы в этой зоне смещены относительно их равновесного состояния. Для дислокации характерна их легкая подвижность. Это объясняется тем, что атомы, образующие дислокацию, стремятся переместиться в равновесное состояние. Дислокации образуются в процессе кристаллизации металлов а также при пластической деформации, термической обработке и других процессах. Поверхностные дефекты представляют собой границы раздела между отдельными кристаллами (рис. 2, г). На границе раздела атомы кристалла расположены менее правильно, чем в его объеме. Кроме того, по границам раздела скапливаются дислокации и вакансии, а также концентрируются примеси, что еще больше наpyшает порядок расположения атомов. При этом сами кристаллы разориентированы, т. е. могут быть повернуты относительно друг друга на десятки градусов. Прочность металла может либо увеличиваться вследствие искажений кристаллической решетки вблизи границ, либо уменьшаться из-за наличия примесей и концентрации дефектов. Дефекты в кристаллах существенно влияют на свойства металлов. ЗаключениеВ данном реферате рассмотрено 2 темы это диффузия в металлах и дендритная кристаллизация металлов. Диффузия служит основой многих распространенных технических операций: спекания порошков, химико-термической обработки металлов, гомогенизации сплавов, металлизации и сварки материалов, дубления кожи и меха, крашения волокон; перемещения газов .Роль диффузии существенно возросла в связи с необходимостью создания материалов с заранее заданными свойствами для развивающихся областей техники (ядерной энергетики, космонавтики, радиационных и плазмохимических процессов и т. п.).Таки образом, диффузия является важнейшим явлением в нашей жизни. Переход металла из жидкого состояния в твердое называется кристаллизацией. Она протекает вследствие перехода системы из термодинамически неустойчивого состояния в термодинамически устойчивое состояние, т.е. из состояния с большей энергией в состояние с меньшей энергией. Во время плавления происходит поглощение теплоты, которая расходуется на повышение энергии атомов, т.е. на «разрушение» кристаллической решетки металла. Эта теплота называется скрытой. В процессе кристаллизации происходит обратное выделение энергии в виде скрытой теплоты кристаллизации. Она компенсирует тепло, которое отводится в окружающую среду, и задерживает падение температуры. С увеличением скорости охлаждения степень переохлаждения возрастает, и процесс кристаллизации протекает при температурах, значительно более низких, чем равновесная температура кристаллизации. Степень переохлаждения зависит от природы и чистоты металла. Чем чище металл, тем при большей степени переохлаждения возникают зародыши твердых кристаллов. Список литературыСидорин И.И. Косолапов Г.Ф. Материаловедение: Учебник для высших технических учебных заведений. 2006 - 215 с. . Солнцев Ю.П., Пряхин Е.И. Материаловедение. 2006 - 263 с Адаскин А.М., Зуев В.М. Материаловедение (металлообработка). - М., 2003. |
