1. Единицы выражения скорости ферментативных реакций. Е, катал, удельная ферментативная активность, число оборотов фермента. Единица активности
 Скачать 275.27 Kb. Скачать 275.27 Kb.
|
|
1. Единицы выражения скорости ферментативных реакций. Е, катал, удельная ферментативная активность, число оборотов фермента. Единица активности (Е) – это количество фермента, которое катализирует превращение одного микромоля субстрата в мин при стандартных условиях (в оптимуме рН, при избытке субстрата, температуре 37 или 20º С). (U-международная) Катал-единица измерения активности катализатора в Международной системе единиц (СИ). (1999г официально) Если присутствие катализатора увеличивает скорость химической реакции на один моль в секунду, то активность данного количества данного катализатора равна одному каталу. Катал — производная единица СИ, которая через основные единицы выражается следующим образом: 1 кат = моль / с Удельная активность – это число единиц ферментативной активности в 1 мг фермента, т.е. число мкмолей субстрата, превращаемое в 1 мин 1 мг фермента. Уд. активность выражается также числом каталов на 1 кг фермента (кат/кг). числом оборотов (kcat) называется максимальное количество субстрата, которое определенный фермент может преобразовать в продукт реакции в единицу времени. Оно может быть рассчитано следующим образом: Пример: ( записывать не обязательно) Ацетилхолинэстераза - 7,4×105 мин−1 при нормальных условиях в нейтральной среде. Читается как (молекулы ацетилхолина в минуту на одну молекулу фермента). 2. Изоферменты биологическое значение множественности молекулярных форм фермента. Изоферменты, или изоэнзимы– это множественные формы фермента, катализирующие одну и ту же реакцию, но отличающиеся друг от друга по физическим и химическим свойствам. «множественные формы фермента» применим к белкам, катализирующим одну и ту же реакцию и встречающимся в природе в организмах одного вида. ферменты, молекулы которых состоят из двух и более субъединиц, обладающих одинаковой или разной первичной, вторичной или третичной структурой. Субъединицы нередко называют протомерами, а объединенную олигомерную молекулу – мультимером. Считают, что процесс олигомеризации придает субъединицам белков повышенную стабильность и устойчивость по отношению к действию денатурирующих агентов, включая нагревание, влияние протеиназ и др. Связи в основном являются нековалентными, поэтому такие ферменты довольно легко диссоциируют на протомеры. Удивительной особенностью таких ферментов является зависимость активности всего комплекса от способа упаковки отдельных субъединиц. Если генетически различимые субъединицы могут существовать более чем в одной форме, то соответственно и фермент, образованный из двух или нескольких типов субъединиц, сочетающихся в разных количественных пропорциях, может существовать в нескольких сходных, но не одинаковых формах. Подобные разновидности фермента получили название изоферментов. 3. Методы выделения и очистки ферментов. Разрушение тканей. Очистка ферментативных препаратов. Процесс очистки состоит в выделении данного фермента из грубого клеточного экстракта, содержащего множество других компонентов. Небольшие молекулы удаляются диализом или гель-фильтрацией; нуклеиновые кислоты — осаждением путем добавления антибиотика стрептомицина и т.д. Основная проблема — отделить нужный фермент от сотен химически и физически сходных белков. Классические методы очистки Широко используются следующие методы очистки: осаждение при различных концентрациях солей (чаще всего сульфата аммония или сульфата натрия), а также органическими растворителями (ацетоном, этанолом); дифференциальная денатурация путем нагревания или изменения pH; дифференциальное центрифугирование, гель-фильтрация и электрофорез. Для масштабной и быстрой очистки белков успешно применяются избирательная адсорбция и элюция белков с целлюлозного анионообменника диэтиламиноэтилцеллюзлозы и катионообменника карбоксиметилцеллюлозы. Широко используется также разделение белков по размерам на молекулярных ситах, например сефадексе. Эти методы являются, однако, относительно малоселективными (если они не используются в сочетании) для отделения индивидуального белка от всех остальных, находящихся в смеси. Такая задача легче решается методом аффинной хроматографии. Поттера-Эльвейема гомогенизатор аппарат для измельчения небольшого количества мягких тканей при биохимических исследованиях, представляющий собой толстостенную пробирку с притертым к ней стеклянным пестиком, вращаемым электромотором. Преимущества дробит клетки и ткани путём сдвигового деформирования нежное дробление известен поколениям пользователей по всему миру Дробление клеток и тканей сдвиговыми силами, действующими между толкушкой и стенкой стеклянного цилиндра, является относительно нежным, благодаря чему можно даже выделить неповреждённое ядро. Метод аффинной хроматографии извлекать из сложной смеси белков один конкретный белок или по крайней мере небольшое их число. Метод основан на использовании иммобилизованного лиганда, который специфически взаимодействует с тем белком, который требуется получить в очищенном виде. После удаления всех прочих несвязавшихся белков нужный фермент элюируют с иммобилизованного лиганда либо концентрированными солевыми растворами, либо раствором, содержащим растворимую форму лиганда. 4. Кинетика ферментативных процессов. Уравнение Михаэлиса-Ментен и его вывод. Уравне́ние Михаэ́лиса — Ме́нтен — основное уравнение ферментативной кинетики, описывает зависимость скорости реакции, катализируемой ферментом, от концентрации субстрата. (1913год) 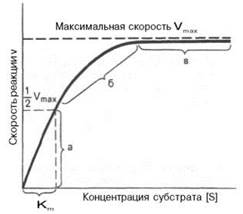   Вывод: константа Михаэлиса численно равна концентрации субстрата (моль/л), при которой скорость данной ферментативной реакции составляет половину от максимальной. 5. Константа Михаэлиса и максимальная скорость ферментативного процесса. Практическое значение. константа Михаэлиса — Кинетический параметр ферментативной реакции, численно равный концентрации субстрата, при которой скорость реакции составляет половину максимальной; К.М. характеризует сродство фермента к субстрату. Vmax- максимальная скорость реакции при данной концентрации фермента в оптимальных условиях проведения реакции.
Кm, тем больше сродство фермента к данному субстрату, тем выше начальная скорость реакции и наоборот, чем больше Кm, тем меньше начальная скорость реакции, тем меньше сродство фермента к субстрату. 6. Определение величин Km и Vmax на практике. Графоаналитический метод обратных величин Лайнуивера и Берка. Km-Кинетический параметр ферментативной реакции, численно равный концентрации субстрата, при которой скорость реакции составляет половину максимальной; К.М. характеризует сродство фермента к субстрату. Vmax- максимальная скорость реакции при данной концентрации фермента в оптимальных условиях проведения реакции. График уравнения Михаэлиса-Ментен в обратных координатах называют графиком Лайнуивера-Берка если существует равенство между двумя какими-либо величинами, то и обратные величины также будут равны. В частности, если 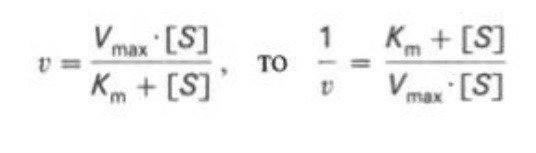 Преобразует 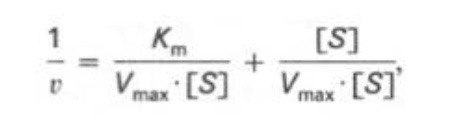 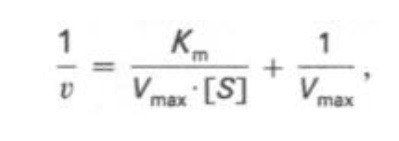 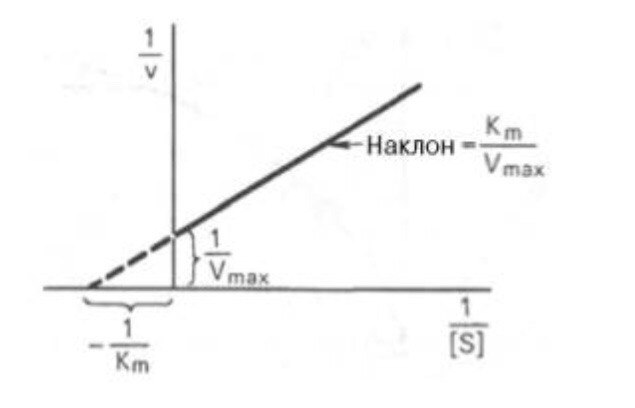 которое получило название уравнения Лайнуивера–Бэрка. Это уравнение прямой линии: у = ах + b. Если теперь в соответствии с этим уравнением построить график в координатах 1/v (y) от l/[S] (x), то получим прямую линию, тангенс угла наклона который будет равен величине Km/Vmax; отрезок, отсекаемый прямой от оси ординат, представляет собой l/Vmax(обратная величина максимальной скорости). Если продолжить прямую линию за ось ординат, тогда на абсциссе отсекается отрезок, соответствующий обратной величине константы Михаэлиса – 1/Кm Таким образом, величину Кm можно вычислить из данных наклона прямой и длины отрезка, отсекаемого от оси ординат, или из длины отрезка, отсекаемого от оси абсцисс в области отрицательных значений. 7. Влияние рн на скорость ферментативных процессов. Причины изменения скорости ферментативных реакций при изменении рн инкубационной среды. Характер зависимости ферментативной реакции от рН определяется тем, что этот показатель оказывает влияние на: a) ионизацию аминокислотных остатков, участвующих в катализе, b) ионизацию субстрата, c) конформацию фермента и его активного центра. 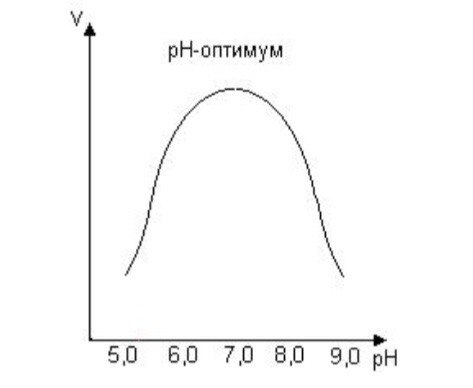 Скорость ферментативной реакции зависит от рН реакционной смеси. Объясняется это тем, что в активные центры ферментов входят различные ионогенные группы белковых молекул, которые при различных значениях рН среды ионизируются по-разному. Значение рН, при котором достигается максимальная скорость катализируемой реакции, называют рН-оптимум фермента. Например, рН-оптимум пепсина равен 1,5. а щелочной фосфатазы -9-10. Исходя из этого определение активности того или иного фермента в биологической жидкости необходимо проводить при рН, близкого к рН-оптимуму данного фермента. наибольшую активность ферменты проявляют в строго определенных для каждого фермента pH и температуре (оптимумы).При изменении этих условий активность ферментов снижается, либо прекращается вовсе. |
