Физика пласта (Ответы на экзамен). 1. Физические свойства нефтегазового пласта, принципы их определения и области использования
 Скачать 0.82 Mb. Скачать 0.82 Mb.
|
39. Уравнения состояния идеальных и природных газов.Закон состояния идеального газа Менделеева-Клапейрона: РV=GRТ (справедлив для идеального газа). Идеальные газы – газы, силами взаимодействия в которых можно пренебречь. (Е/V)Т=0, где Е – внутренняя энергия парообразования. Свойство идеальных газов заключается в том, что: РV/(GRТ)=1=z. Новый введённый нами коэффициент z, который для идеальных газов равен 1, а для реальных газов отличен от неё, называется коэффициентом сверхсжимаемости. z – коэффициент, с помощью которого свойства идеальных газов прилагаются к реальным. Он характеризует степень отклонения идеального газа от реального. Реальные(природные) газы – смесь углеводородных и не углеводородных компонентов. Молекулы аргона, ксенона, криптона и метана имеют сферическую конфигурацию. Молекулы таких газов, как пропан и бутан, - несферическую, поэтому для учёта формы молекул был введён параметр – ацентрический фактор (). Он показывает, что если молекула сферическая, то силы, которые на неё действуют – сферические, что указывает на симметрию сил. Если же молекулы не сферические, то возникает асимметрия действующих сил. 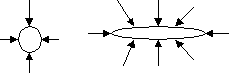 z=z(Рпр, Тпр, ) zсм=z0(Рпр, Тпр)+z1(Рпр, Тпр)см, где z0 – коэффициент сверхсжимаемости простого газа. Для простого газа молекулы сферические и =0. z1 – поправка к коэффициенту сверхсжимаемости непростого газа, который зависит от Рпр, Тпр и 0. см – ацентрический фактор всей смеси, характеризуемой определёнными концентрациями: см=уii Отсюда можно видеть, что ацентрический фактор смеси зависит от ацентричного фактора каждого компонента. уi – молярная концентрация компонента. 40,41. Физические свойства реальных газов.Физические свойства газового конденсата.Природный газ – это газообразная смесь углеводородных и не углеводородных газов (в основе любого состава лежат гомологи метана СnН2n+2, кроме того, в газах могут присутствовать: азот, окись углерода СО2, сероводород Н2S, меркаптаны, а также редкоземельные инертные газы, такие как гелий, криптон, аргон, ксенон). Свойства газа меняются в процессе разработки месторождения (из нефтегазовой в чисто газовую). Плотность природного газа и стабильного конденсата. Для природного газа:Р, t=Р0, t0(Рz0Т0)/(Р0zТ) Для стабильного конденсата:(С5+)=1.003Мк/(Мк+44.29) [кг/см3] По коэффициенту преломления, определяемого на опыте, можно рассчитать: 1gМк=1.939+0.0019tк+1g(2.15 - nD), где tк – температура кипения конденсата; nD – коэффициент преломления. Эти коэффициенты носят эмпирический характер. Но плотность стабильного конденсата можно вычислить и по иной формуле, а именно: к=хiМi/хini/i, где хi – молярная доля i-ого компонента; i – плотность i-ого компонента; Мi – молекулярная масса. Вязкость газов и углеводородных конденсатов. 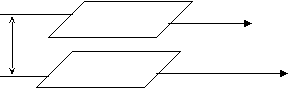 F/А?dv/dу
А1 v dу А2 v+dv Вязкость газа при низких давления и температурах близка вязкости идеального газа. Значит, можно воспользоваться кинематической теорией, записав уравнение для разреженного газа: =v/3, где v – средняя скорость движения молекул; - длина свободного пробега. Согласно кинетической теории, вязкость зависит от давления и температуры: С повышением давления плотность возрастает, но снижается, следствием чего является возрастание вероятности соударения, средняя скорость движения при этом постоянна, и вязкость в начальный период практически постоянна (р). С ростом температуры вязкость возрастает, т.к. увеличивается средняя скорость движения молекул, а плотность и длина свободного пробега практически не меняются. В то же время из определения вязкости, силы, препятствующие перемещению одного слоя относительно другого должны меняться, а, значит, изменение вязкости носит сложный характер.  Рmах Рmах Рmin T При малых давлениях мало зависит от перепада давлений. С ростом давления и увеличением температуры вязкость газов () снижается. Если у нас возрастает молекулярная масса газа, то вязкость увеличится соответственно. Учёт наличия неуглеводородных газов, их влияние на вязкость проводится следующим образом: =уаа+(1 – уа)у, где у – молярная доля; а – вязкость неуглеводородного газа; у – вязкость углеводородного газа. Зависимость от молекулярной массы может быть графически изображена: 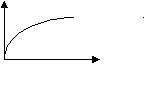 М |

 Пас]
Пас]