Химия ОГЭ. 1. Используя метод электронного баланса, расставьте коэффициенты в уравнении реакции, схема которой
 Скачать 0.57 Mb. Скачать 0.57 Mb.
|
|
Часть 2. Ответы. 1. Используя метод электронного баланса, расставьте коэффициенты в уравнении реакции, схема которой: As2S3 + HNO3 (конц.) = H3AsO4 + H2SO4 + NO2 + H2O Определите окислитель и восстановитель. As2S3 + 28HNO3 (конц.) = 2H3AsO4 + 3H2SO4 + 28NO2 + 8H2O (1 балл) Окислителем является азот в составе азотной кислоты, а восстановители – это мышьяк и сера в составе сульфида мышьяка. (1 балл) + 1 балл за верно составленный баланс 2. N     H4Cr2O7 A Li3N NH3 +CuO, t A H4Cr2O7 A Li3N NH3 +CuO, t A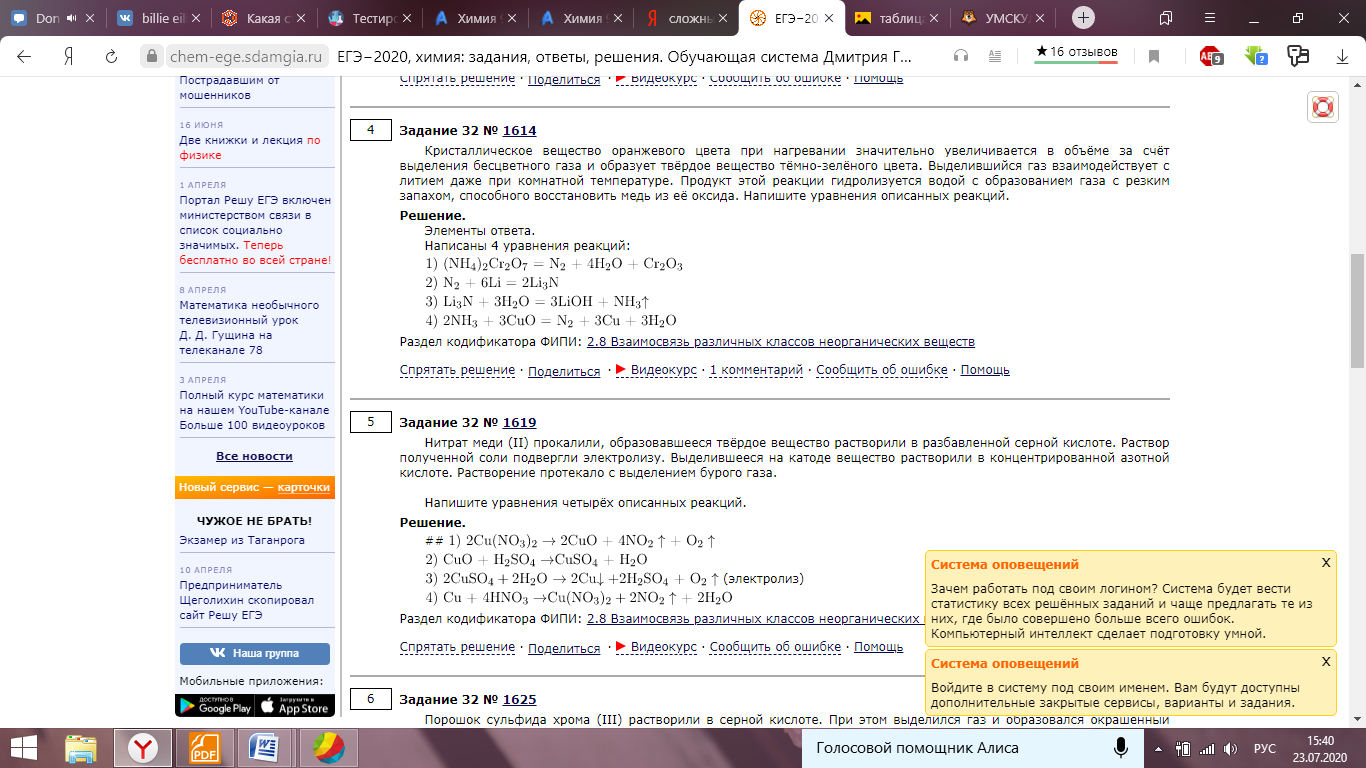 По 1 баллу за уравнение 3. 1 балл) Составлено уравнение реакции: FeCl3 + 3NaOH = 3NaCl + Fe(OH)3 2 балл) Рассчитаны количества веществ хлорида железа (III) и гидроксида натрия: n(FeCl3)= (m(p-pa) * w)/M = (500 * 0,19) / 162,5 = 0,585 моль n(NaOH) = 3n(FeCl3) = 0,585*3= 1,755 моль (по уравнению реакции) 3 балл) Определён объём раствора щёлочи: m(NaOH) = n(NaOH) * M(NaOH)= 1,755 * 40 = 70,2 г m р-ра (NaOH) = m(NaOH)/w = 70,2/0,15 = 468 г v (NaOH) = m (NaOH)/p = 468/1,05 = 445,7 мл Ответ: V (NaOH) = 445,7 мл 4. 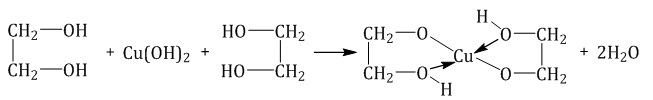 1 балл При взаимодействии этиленгликоля со свежеосажденным гидроксидом меди (II) образуется ярко-синий раствор гликолята меди - 2 балл Cu(OH)2 + 4(NH3•H2O) → [Cu(NH3)4](OH)2 + 4H2O - 3 балл При взаимодействии раствора аммиака с гидроксидом меди (II) образуется тёмно-синий раствор - 4 балл 5. 6NO2 + FeI2 → Fe(NO3)3 + I2 + 3NO 1 балл 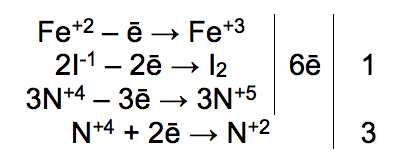  2 балл 2 баллFeI2 – восстановитель, NO2 – окислитель 6. По 1 баллу за уравнение 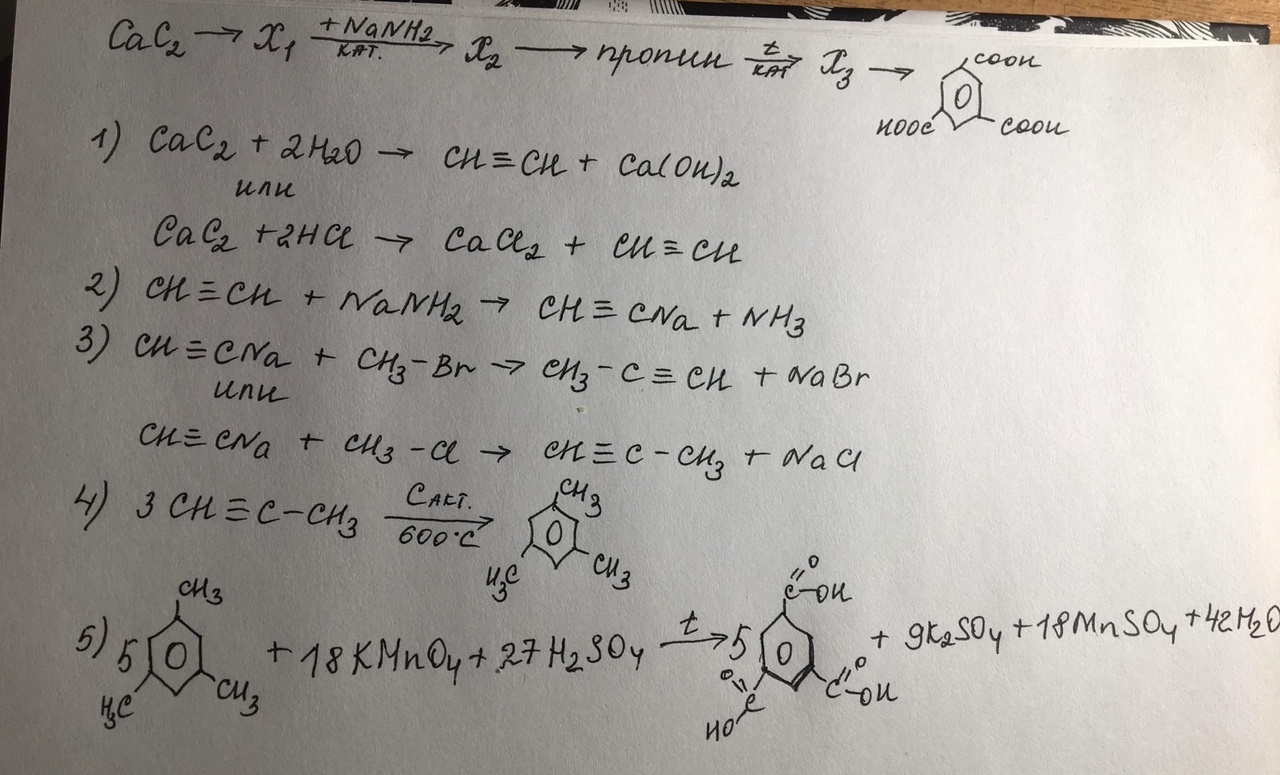 7 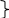 . 2AgF + H2S = Ag2S + 2HF - 1 балл . 2AgF + H2S = Ag2S + 2HF - 1 балл2Ag+ + 2F- + H2S = Ag2S + 2HF 2Ag+ + 2F- + H2S = Ag2S + 2HF 2 балл Полное и сокращенное ионные уравнения совпадают. |
