06_вар_кр_5_33209.docx_181f0f0fe6ce1e3b4975112752c9bea4. 1 Изготовление инъекционных растворов в промышленности и в аптечных условиях. Нтд
 Скачать 66.46 Kb. Скачать 66.46 Kb.
|
|
Вариант 6. 1. Теоретические вопросы: 1.1. Изготовление инъекционных растворов в промышленности и в аптечных условиях. НТД. Ответ: Изготовление инъекционных растворов в аптеках регламентируется рядом НД: ГФ, приказами МЗ РФ № 309, 214, 308, Методическими указаниями по изготовлению стерильных растворов в аптеках, угвержденных МЗ РФ от 24.08.94 г. Лекарственные формы для инъекций могут изготовлять только те аптеки, которые имеют асептический блок и возможности для создания асептики. Не разрешается готовить инъекционные лекарственные формы, если нет методик количественного анализа, данных о совместимости ингредиентов, режиме стерилизации и технологии. Стадии технологического процесса - Подготовительная. - Изготовление раствора. - Фильтрование. - Фасовка раствора. - Стерилизация. - Стандартизация. - Оформление к отпуску. На подготовительной стадии проводятся работы по созданию условий асептики: подготовка помещения, персонала, оборудования, вспомогательных материалов, тары и упаковочных средств. На подготовительной стадии осуществляется также подготовка лекарственных веществ, растворителей и стабилизаторов. Для получения воды очищенной используют аквадистилляторы. Проводятся также расчеты. В отличие от других лекарственных форм для всех инъекционных растворов регламентированы состав, способы обеспечения стабильности и стерильности. Эти сведения имеются в приказе МЗ РФ № 214 от 16.09.97, а также в Методических указаниях по изготовлению стерильных растворов в аптеках, утвержденных МЗ РФ от 24.08.94. Изготовление растворов для инъекций. На этой стадии проводят отвешивание порошкообразных веществ, отмеривание жидкостей и химический анализ раствора. В соответствии с приказом МЗ РФ № 308 от 21.10.97. «Об утверждении инструкции по изготовлению в аптеках жидких лекарственных форм» инъекционные растворы готовят массо-объемным методом в мерной посуде или объем растворителя определяют расчетным путем. При необходимости добавляют стабилизатор. После изготовления проводят идентификацию, определяют количественное содержание лекарственного вещества, рН, изотошфуюшие и стабилизирующие вещества. При удовлетворительном результате анализа раствор фильтруют. Стадия фильтрования и розлива. Для фильтрования растворов используют разрешенные к применению фильтрующие материалы. Фильтрование больших объемов растворов проводят на фильтровальных установках стационарного или карусельного типа. Фасовка. Для фасовки инъекционных растворов используют стерильные флаконы из нейтрального стекла НС-1,НС-2. Для укупорки флаконов применяют пробки из специальных сортов резины: силиконовые (ИР-21), из нейтрального каучука (25П), бутилового каучука (ИР-119, 52-369). После фасовки проводят первичный контроль каждого флакона на отсутствие механических включений визуальным методом. Если обнаруживаются механические включения, раствор перефильтровывают. После контроля на чистоту флаконы, укупоренные резиновыми пробками, обкатывают металлическими колпачками. Для этого используют приспособление для обжима крышек и колпачков (ПОК) и более совершенный полуавтомат ЗП-1 для закатки колпачков. После укупорки флаконы маркируют с помощью жетона или штамповкой на колпачке названия раствора и его концентрации. Стерилизация. Для стерилизации водных растворов используют чаще всего термический метод, а именно стерилизацию насыщенным паром под давлением. Стерилизацию проводят в паровых стерилизаторах вертикальных (марки ВК-15, ВК-3) и горизонтальных (ГК-100, ГП-280, ГП-400, ГПД-280 и др.). ВК - вертикальный круговой; ГП - горизонтальный прямоугольный односторонний; ГПД - горизонтальный прямоугольный двусторонний.) Устройство парового стерилизатора и принцип работы. В отдельных случаях растворы стерилизуют текучим паром при температуре 100°С, когда этот метод является единственно возможным для данного раствора. Текучий пар убивает только вегетативные формы микроорганизмов. Растворы термолабильных веществ (апоморфина гидрохлорида, викасола, барбитала натрия) стерилизуют фильтрованием. Для этого используют глубинные или, предпочтительно, мембранные фильтры. Стерилизация растворов должна производиться не позднее 3-х часов после изготовления раствора, под контролем провизора. Повторная стерилизация не допускается. После стерилизации проводят вторичный контроль на отсутствие механических включений, качество укупорки флаконов и полный химический контроль, т.е. проверяют рН, подлинность и количественное содержание действующих веществ. Стабилизаторы после стерилизации проверяют только в случаях, предусмотренных НД. Для контроля после стерилизации отбирается один флакон от каждой серии. Стадия стандартизации. Стандартизация проводится после стерилизации по показателям: отсутствие механических включений, прозрачность, цветность, значение рН, подлинность и количественное содержание действующих веществ. Инъекционные лекарственные формы и вода для инъекций периодически проверяются органами Госсанэпиднадзора на стерильность и апирогенность. Растворы для инъекций считаются забракованными, если они не соответствуют нормам хотя бы по одному из показателей, а именно: физико-химические свойства, содержание видимых механических включений, стерильность, апирогенность, а также при нарушении герметичности укупорки и недостаточном объеме заполнения флакона. Оформление к отпуску. На флакон наклеивают этикетку белого цвета с синей полосой с обязательным указанием наименования раствора, его концентрации, даты изготовления, условий и срока хранения. Сроки хранения инъекционных лекарственных форм регламентированы приказом МЗ РФ № 214 от 16.07.97. Особенности заводского производства: -большой объем; -высокая степень механизации и автоматизации; -возможность изготовления дозированных лекарственных форм; -возможность получения лекарственных препаратов с большим сроком годности. Современные требования к инъекционным растворам наиболее полно реализуются в заводских условиях, обеспечивающих высокую степень чистоты, стабильность, стерильность, точную дозировку и др. в соответствии с правилами GMP. 1.2. Производство ампул. Калибровка и мойка дрота. Ответ: Дрот - это стеклянные трубки определенной длины (1,5 метра). Выпускается на стекольных заводах из медицинского стекла. К дроту предъявляются жесткие требования: отсутствие механических включений, пузырьков воздуха и других дефектов, одинаковый диаметр по всей длине, определенная толщина стенок, отмываемость загрязнений и др. Дрот калибруют, т.е. сортируют по наружному диаметру от 8 до 27мм. Это очень важно, чтобы ампулы одной серии имели одинаковую вместимость. Поэтому стеклянные трубки калибруют на специальной установке по наружному диаметру в двух сечениях на определенном расстоянии от середины трубки. Мойка и сушка дрота. После калибровки дрот поступает на мойку. В основном, дрот приходится отмывать от стеклянной пыли, которая образуется при его изготовлении. От основной массы загрязнений легче отмыть именно дрот, а не готовые ампулы. Дрот моют либо в установках камерного типа, в которых одновременно и сушат трубки, либо в горизонтальных ваннах с помощью ультразвука. Положительные стороны камерного способа мойки: высокая производительность; возможность автоматизации процесса; совмещение операций мойки и сушки. Недостатки: большой расход воды; невысокая эффективность мойки за счет небольшой скорости потока воды. Увеличение эффективности мойки достигается за счет барботажа, создания турбулентных потоков и струйной подачи воды. Более эффективным по сравнению с камерным является ультразвуковой способ. В жидкости при прохождении ультразвука (УЗ) образуются чередующиеся зоны сжатия и разряжения. В момент разряжения возникают разрывы, которые называются кавитационными полостями. При сжатии полости захлопываются, в них возникает давление, около нескольких тысяч атмосфер. Поскольку частицы загрязнений являются зародышами кавитационных полостей, то при их сжатии загрязнения отрываются от поверхности трубок и удаляются. Контактно - ультразвуковой способ более эффективен по сравнению с УЗ - способом, т.к. к специфическому действию УЗ добавляются еще механическая вибрация. В установках контактно-УЗ способа мойки трубки контактируют с вибрирующей поверхностью магнитно-стрикционных излучателей, расположенных на дне ванны с водой. При этом колебания поверхности излучателей передаются стеклянным трубкам, что способствует отделению загрязнений от их внутренних поверхностей. Качество мойки дрота проверяют визуально. Отмытый и высушенный дрот передается на изготовление ампул. 1.3. Оценка качества инъекционных растворов: количественное содержание действующих веществ, цветность, апирогенность, стерильность и другие показатели. Способы определения механических включений. Ответ: Одним из важнейших показателей качества инъекционных растворов является показатель «механические включения». Под механическими включениями (МВ) подразумеваются посторонние нерастворимые частицы (кроме пузырьков воздуха), случайно присутствующие в лекарственных средствах. Введение больному лекарственного препарата, содержащего МВ, может вызвать головную боль, аллергические реакции, флебиты, закупорку вен вплоть до некроза тканей, гранулематозное воспаление легких, иногда со смертельным исходом. В инъекционных препаратах помимо МВ, хорошо видимых невооруженным глазом, содержится большое количество частиц довидимого диапазона, которые можно обнаружить только с помощью инструментальныхметодов анализа. Если частиц довидимого диапазона в растворе много, то они могут забивать капилляры кровеносных сосудов, а также стать причиной гранулем и тромбозов. В связи с данным обстоятельством для оценки качества инъекционных растворов применяются различные методы. Визуальный метод позволяет обнаружить частицы размером 50 мкм и более. Контроль инъекционных растворов на МВ проводится в помещении, защищенном от прямого попадания солнечного света. Зона контроля освещается электрической лампочкой или лампой дневного света соответствующей мощности (60 вт для бесцветных и 100 вт для окрашенных растворов). Ампулы вносят в зону просмотра в положении «вверх донышками» и просматривают на черном и белом фонах. Затем плавным движением, без встряхивания, переводят в положение «вниз донышками» и вторично просматривают на черном и белом фонах. Обязательными показателями качества инъекционных растворов являются стерильность и пирогенность. Для более объективной оценки качества раствора по этому параметру были разработаны другие методы: визуально-оптические, основанные на использовании проекторов, увеличительных линз, поляризационного света и т.д.; оптические, с автоматической регистрацией фотоэлементами поглощения или рассеивания проходящего света; мембрано-микроскопические; проточные методы. Стерильность инъекционных растворов обеспечивается производством лекарственных препаратов в условиях асептики и последующей стерилизацией. В стерильных растворах не должно быть жизнеспособных микроорганизмов. Поэтому каждая серия готовой продукции подлежит контролю на стерильность в соответствии с требованиями ОФС «Испытание на стерильность» ГФ ХII издания. Испытание инъекционных растворов в ампулах на стерильность проводят микробиологическим методом прямого посева на питательные среды или методом мембранной фильтрации. Испытуемые лекарственные препараты удовлетворяют требованиям стерильности при отсутствии роста микроорганизмов. Продукты жизнедеятельности и распада микроорганизмов, а также погибшие микробные клетки, содержащиеся в инъекционных лекарственных препаратах, могут вызывать пирогенный эффект (повышение температуры тела, лихорадочное состояние), снижение кровяного давления, тахикардию, цианоз, рвоту, понос. Освобождение от пирогенных веществ в инъекционных растворах термической стерилизацией практически невозможно, так как они термостабильны. Поэтому исключительное значение имеют профилактические мероприятия, предотвращающие образование пирогенных веществ. Это, прежде всего, строжайшее соблюдение асептики на всех этапах производства инъекционных растворов, независимо от последующей стерилизации. Значение имеют также использование свежеперегнанной воды, апирогенных лекарственных веществ и соблюдение времени выдерживания растворов перед стерилизацией. Однако практически невозможно добиться полного освобождения инъекционных растворов от микроорганизмов. В связи с данным обстоятельством, а также опасностью пирогенного эффекта инъекционные растворы при объеме одноразовой дозы 10 мл и более подвергаются испытанию на пирогенность. Определение пирогенных веществ унифицировано и изложено в ОФС «Испытание на пирогенность» ГФ ХII издания. Согласно ОФС, испытание пирогенности проводят биологическим методом на кроликах. Допускается использование альтернативного метода на основе ЛАЛ-теста вместо определения пирогенности на кроликах. Инъекционные растворы, наряду с другими требованиями, должны быть стабильными. В процессе изготовления инъекционных растворов, особенно при термической стерилизации и последующем хранении, возможно разложение некоторых лекарственных веществ. Они могут подвергаться изомеризации и химическим превращениям: окислению, гидролизу, декарбоксилированию и т. д. В водных растворах протекают, например, реакции гидролиза лекарственных веществ, представляющих собой соли, образованные сильной кислотой и сильным основанием, и наоборот. Из вышеизложенного следует, что стабильность инъекционных растворов в первую очередь зависит от физико-химических свойств лекарственных веществ, величины рН раствора, температуры, а также марки медицинского стекла, из которого изготовлены ампулы. Для контроля стабильности инъекционных растворов вводят такие показатели качества, как значение рН, внешний вид, прозрачность и цветность раствора. По величине рН, определяемой потенциометрическим методом, можно косвенно судить о качестве медицинского стекла, используемого для изготовления ампул, а также о соблюдении режима стерилизации или стерилизации без стабилизатора. Данный показатель является также показателем стабильности инъекционных растворов при хранении. Изменение рН раствора в процессе хранения ампул может быть вызвано постепенным гидролизом лекарственных веществ и накоплением продуктов кислотного или основного характера. Кроме изменения рН раствора, показателем стабильности лекарственных веществ может служить внешний вид ампульного раствора, оцениваемый визуально. Как правило, инъекционные растворы неокрашенных лекарственных веществ представляют собой прозрачные, бесцветные или слабо окрашенные жидкости. Для объективной оценки дополнительно определяют такие показатели качества, как прозрачность и цветность растворов в соответствии с требованиями ОФС «Определение прозрачности и мутности жидкостей» и «Определение окраски жидкостей». Объективную оценку разложения лекарственного вещества в инъекционном растворе дает такой показатель качества, как «посторонние примеси», определяемые высокочувствительными хроматографическими методами (ТСХ или ВЭЖХ). Посторонние примеси в инъекционных лекарственных препаратах не допускаются. Одним из показателей качества инъекционных растворов в ампулах является номинальный объем. Это испытание унифицировано и изложено в ОФС «Извлекаемый объем лекарственных форм для парентерального применения» ГФ Х11 издания. Для определения номинального объема раствора в ампулах вместимостью от 1 до 20 мл отбирают пять ампул. Извлекают содержимое каждой ампулы сухим шприцем, вместимость которого не более чем в три раза превышает измеряемый объем. Из шприца и иглы удаляют пузырьки воздуха и помещают содержимое, не выдавливая раствор из иглы, в сухой мерный цилиндр. Обязательными показателями качества инъекционных растворов, как и других лекарственных средств, являются испытание на подлинность и количественное определение. Особенностью испытания инъекционных растворов является установление подлинности не только действующего вещества, но и стабилизаторов или консервантов. Указание о необходимости установления подлинности таких вспомогательных веществ в инъекционном растворе приводится в нормативной документации частного характера (ФСП). В целях обеспечения правильной дозировки проводится количественное определение действующего вещества методом, указанным в ФСП. 1.4. Глазные лекарственные формы. Характеристика. Классификация. Требования НТД. Ответ: Лекарственные препараты для глаз – это важнейшая группа лекарственных форм. Для лечения и профилактики глазных заболеваний в настоящее время применяют такие лекарственные формы: - глазные мази; - глазные капли; - глазные пленки; - офтальмологические растворы. Глазные лекарственные формы наносят на самую чувствительную из всех слизистых оболочек – слизистую глаза. Она резко реагирует на любые внешние раздражители: механические примеси, изменение рН среды, осмотическое давление, микроорганизмы, поэтому к глазным лекарственным формам предъявляются особые требования. Все лекарственные препараты для глаз должны изготавливаться в асептических условиях. По определению ГФ XI, глазные капли – лекарственная форма, предназначенная для инстилляции в глаз. Глазные капли представляют собой водные или масляные растворы или тончайшие суспензии лекарственных веществ (размер частиц 10–12 мкм). 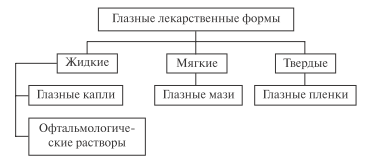 Требования, предъявляемые к глазным каплям: - отсутствие механических примесей; - комфортность (изотоничность, оптимальное значение рН); - стерильность; - стабильность; - точность концентрации; - пролонгированность действия. Гипо- и гипертонические растворы, а также растворы, имеющие рН менее 4,5 и более 9,0, вызывают в глазу чувство боли, рези, жжения и слезотечение, поэтому для создания комфортных условий использования капель их обязательно изотонируют. Глазные капли должны быть изотоничны слезной жидкости или раствору натрия хлорида с концентрацией 0,9 ± 0,2 % (0,7–1,1 %). Изотонируют глазные капли чаще всего хлоридом натрия. Если лекарственное вещество несовместимо с хлоридом натрия, то используют натрия нитрат, натрия сульфат, натрия цитрат и другие вещества. Большинство глазных капель, за исключением раствора сульфацила натрия и кислоты аскорбиновой, имеют значение рН в пределах 4,5–9,0. Использование буферных растворителей обеспечивает хорошую переносимость, терапевтический эффект, стабильность. Введение нестерильного раствора в больной глаз может привести к серьезным последствиям, вплоть до потери зрения. Стерильность глазных капель обеспечивается строгим соблюдением асептики и стерилизацией. Стерилизацию глазных капель осуществляют методами, указанными в частных статьях ГФ. Термической стерилизации подвергают капли с веществами, растворы которых устойчивы к температурному воздействию. Такие вещества называют термостабильными. Термолабильные вещества растворяют в простерилизованных растворах в асептических условиях (например, резорцин, раствор адреналина, раствор цитраля). При использовании глазные капли неизбежно загрязняются микрофлорой. Для сохранения стерильности глазных капель и растворов после вскрытия упаковки в их состав могут быть введены консерванты. 1.5. Совершенствование лекарственных форм для новорожденных и детей до 1 года. Ответ: Организм ребенка, особенно в раннем возрасте, характеризуется малой массой при большой поверхности тела, большим объемом внеклеточной жидкости, своеобразным связыванием белков с лекарственными веществами, незрелостью и недостаточностью ферментных систем, метаболизирующих лекарства в крови, незрелостью регуляторных механизмов (нервной системы, дыхательного центра, центра терморегуляции и т. д.). Для н о в о р о ж д е н н ы х детей характерно быстрое проникновение лекарственных препаратов в органы и ткани, а повышенная проницаемость слизистой органов пищеварения может усилить и ускорить всасывание лекарственных веществ в желудочно-кишечном тракте. Кроме того, побочные явления могут быть обусловлены недостаточным выделением и обезвреживанием токсических веществ почками (выделительная способность которых у новорожденных детей на 50 % ниже, чем у взрослых). Ввиду функциональной незрелости новорожденного надо избегать назначения лекарственных веществ, обладающих ингибирующим действием или вызывающих поражение дыхательного центра. Не рекомендуется назначать новорожденным салицилаты, тетрациклины, канамицин, неомицин, полимиксин, препараты группы морфина, фенацетин, антипирин, индометацин и др. Из-за повышенной кожной проницаемости следует с осторожностью применять ментол, калия перманганат, анестезин, деготь. Не рекомендуется применять кислоту борную как малоэффективный антисептик, обладающий токсическим действием. С целью совершенствования детских лекарственных форм необ ходимо расширять научно-исследовательскую работу по созданию новых лекарственных средств для детей, увеличивать ассортимент высокоэффективных вспомогательных веществ (солюбилизаторов, корригирующих веществ, основ для суппозиториев), разрабатывать специальные виды упаковок для детских лекарственных форм (крыш ки для флаконов, которые трудно открыть, упаковки для однора зового приема, что дают возможность не нарушать герметичность и сохранять стерильность препарата на протяжении всего срока пользования им). Усилия научных и производственных учреждений должны быть направлены на создание лекарств, удобных в использовании, мини мально травмирующих психику ребенка, имеющих приятный вкус, запах, привлекательный внешний вид и в то же время обеспечиваю щих максимальный терапевтический эффект с минимумом побочных действий, отвечающих требованиям, которые предъявляются к детским лекарственным формам. 2. Ситуационные задачи. 2.1. При изготовлении ректальных суппозиториев по прописи: Возьми: Стрептомицина сульфата 100000 ЕД Новокаина 0,2 мл Масла какао 3,0 Смешай, чтобы получилась свеча. Дай таких доз №20 ассистент растворил лекарственные вещества в минимальном количестве воды очищенной, раствор смешал с основой, пластифицируя массу небольшим количеством ланолина б/в. Оцените ситуацию. Ответ: Вещества, растворимые в воде или иных индифферентных растворителях, предварительно растворяют в нескольких каплях воды или другого растворителя и только после этого смешивают с жировой основой. Пластифицировать не обязательно. 2.2. После стерилизации 200 мл раствора глюкозы 5% для инъекций во флаконе из стекла марки НС-1 в паровом стерилизаторе при t = 120оС в течение 15 минут появилась желтая окраска. Проанализируйте причины. Ответ: Раствор во флаконах стерилизуют в паровом стерилизаторе насыщенным водяным паром при избыточном давлении 0,11 МПа (1,1 кгс/см2) и температуре 120°С. Раствор во флаконах вместимостью до 100 мл стерилизуют в течение 8 мин., от 100 мл до 500 мл. – 12 мин. Таким образом нарушен режим стерилизации (превышено время). 2.3. Возьми: мази тиамина бромида 0,5% - 10,0 Дай. Обозначь. Закладывать за веко левого глаза 2 раза в день. Ситуация. Ассистент в стерильной ступке растер 0,05 тиамина бромида с 10,0 глазной основы, укупорил, оформил к отпуску. Оцените ситуацию. Ответ: Не учтена особенность изготовления. Rp: Ung. Thiamini bromidi 0,5% - 10,0
0,5 г тиамина бромида, 4 капли стерильной воды. 10,0 основы (1+9) V=10, 0 Данная лекарственная форма сложная, мягкая для наружного применения двухфазная эмульсионная глазная мазь глубокого действия. Особенности. Основа для глазных мазей (1+9), должна быть заранее простерилизована и расфасована по 10,0 в СЖШ при 1800 – 30 минут или 2000 – 15 минут. Мазь готовим по типу эмульсий – растворяем в минимальном количестве воды 0,1 мл = 4 капли. Вода для растворения предварительно простерилизована. 3. Опишите технологию с теоретическим обоснованием: 3.1. Возьми: Раствора глюкозы 20% - 400 мл Простерилизуй! Дай таких доз №10. Обозначь. Для в/в введения. Ответ:
Rp.: Sol. Glucosi 20% - 400 ml Sterilisetur! D.t.n 10 D. Signa. Для в/в введения.
Форма рецептурного бланка (приказ № 110 от 12 февраля 2007г.) - N 107-1/у. Проверка фармацевтической (физико-химической, химической и фармакологической) совместимости ингредиентов прописи. Вывод. Лекарственные вещества совместимы. Проверка доз веществ списков А и Б - не требуется. Учетных веществ нет. Вывод: препарат может быть изготовлен.
Glucosi (глюкоза) - бесцветные кристаллы или белый мелкокристаллический порошок без запаха, сладковатого вкуса. Растворим в воде (1:1,5). Дополнительное требование к лекарственному веществу "Глюкоза для инъекций" - апирогенность. Хранят глюкозу в стерильной, хорошо укупоренной таре. В защищенном от света месте. Растворы - гидратирующее, дезинтоксикационное средство. Agua pro ingectionibus (ФС 42-2620-97) - бесцветная, прозрачная жидкость без вкуса и запаха, не содержит пирогенные вещества.
Дата ППК к рецепту № 1 Aquae purificatae 3248 ml Glucosi hydrici (10%) 880,0 Solutio Vejbeli 200 ml Vобщ = 4000 ml Доп. Откл. 4000 40 мл Подписи: Изготовил . Проверил . Отпустил
Инфузионный раствор для внутривенного капельного введения, представляющий собой истинный водный раствор лекарственного вещества – глюкозы, требующего стабилизации, выдерживающего термическую стерилизацию.
Раствор глюкозы для инъекций готовят весообъемным методом. В мерную емкость загружают кристалическую глюкозу, (в пересчете на безводную) добавляют воды для инъекций приблизительно 2/3 нужного количества и с помощью мешалки раствор, перемешивают до полного растворения глюкозы в течении 2—3 мин. Для стабилизации раствора глюкозы добавляют в количестве 5% от общего объёма раствор Вейбеля. После полного химического контроля раствор фильтруют через стерильный комбинированный фильтр (складчатый бумажный фильтр с подложенным тампоном длинноволокнистой стерильной ваты), промытый стерильной водой для инъекций или через стеклянный фильтр № 3 или 4. Разливают по флаконам объемом 400 мл.
Флаконы с раствором укупоривают резиновой пробкой, проверяют на отсутствие механических включений. В случае отсутствия мех. включений обкатывают металлическим колпачком. Укупоренные флаконы обвязывают смоченной пергаментной бумагой, на «язычке» которой указывают: № рецепта, состав прописи, режим стерилизации, дату изготовления, подпись изготовившего. Стерилизация (не позднее 3 часов с момента изготовления раствора) насыщенным паром под давлением (120 0С) – 8 минут.
m глюкозы - 800 г КУО глюкозы = 0,69мл/г V = 0,69мл/г х 800 = 552 мл прирост объема не уложится в норму доп. отклонения (пр. № 751н 1% -4000 40 мл) Стабилизатора Вейбеля (5% от объема) - 200 мл VH2O = 4000-552-200 = 3248 мл
Анализ документации. Имеющийся рецепт, паспорт письменного контроля и номер лекарственной формы соответствуют. Расчеты сделаны верно. Правильность упаковки, укупорки и оформления. Объем флакона из нейтрального стекла соответствует объему раствора. Лекарственная форма укупорена герметично. Колпачок на флаконе не прокручивается. Оформление соответствует требованиям приказа МЗ РФ № 120 от 05.09. 97г. Полный химический контроль проводится в соответствии с требованиями приказа МЗ РФ № 214 от 16.07. 97г. Механические включения отсутствуют. Органолептический контроль. Бесцветная прозрачная жидкость без запаха. Отклонение в объеме 1% (от 3960 до 4040 мл.). (приказ МЗ РФ №751 от 26.10.2015 г.) Стерильность. В соответствии с требованиями ГФ ХI, ст. «Испытание на стерильность». Апирогенность. В соответствии с требованиями ГФ ХI, ст. «Испытание на пирогенность». 3.2 . Возьми: Левомицетина 0,1 Масла какао 1,0 Смешай, чтобы получилась свеча. Дай такие дозы №20. Обозначь. По 1 свече 4 раза в день. Ответ: 1. Рецепт на русском и латинском языках. Левомицетина 0,1 Масла какао 1,0 Смешай, чтобы получилась свеча. Дай такие дозы №20. Обозначь. По 1 свече 4 раза в день. Rp.: Laevomycetini 0,1 Olei Cacao 1,0 Misce fiat supp. D. t. d. 20. S. По 1 свече 4 раза в день. 2. Фармацевтическая экспертиза рецепта: форма рецептурного бланка, требования, проверка совместимости ингредиентов, проверка доз и предельно-допустимого количества для выписывания в рецепте ядовитых и сильнодействующих веществ. Форма рецептурного бланка (приказ № 110 от 12 февраля 2007г.) - N 107-1/у. Проверка фармацевтической (физико-химической, химической и фармакологической) совместимости ингредиентов прописи. Вывод. Лекарственные вещества совместимы. Проверка доз. ВРД= 2,0 г, РД = 0,1 г. ВСД= 7,0 г СД = 0,4 г. Дозы не завышены. 3. Физико-химические свойства входящих ингредиентов. Хранение. Применение. Левомицетин - белый или белый со слабым желтовато-зеленоватым оттенком кристаллический порошок без запаха, горького вкуса. Растворимость. Мало растворим в воде, легко растворим в 95% спирте, растворим в этилацетате, практически нерастворим в хлороформе.. 4. Рабочая пропись (обратная сторона ППК). № рецепта дата Streptocidi 2,0 Olei Cacao 20,0 Lanolini anhydrici 0,7 Мобщ.практ.=22,7 m1свечи.практ.=1,13 Приготовил: (подпись). Проверил: (подпись). Отпустил: (подпись). 5. Характеристика лекарственной формы. Особенности. Свечи (суппозитории ректальные) – твердые при комнатной температуре и расплавляющиеся или растворяющиеся при температуре тела дозированные лекарственные формы. 6. Оптимальный вариант технологии с теоретическим обоснованием. Левомицетин относится к сильнодействующим веществам, поэтому проверяют его разовую и суточную дозу. 2,0 г левомицетина тщательно растирают в ступке, смешивают с частью измельченного масла какао, после чего добавляют остаток основы. Затем с помощью безводного ланолина (из расчёта 1,0 г на 30,0 г массы) получают однородную массу, из которой выкатывают 20 свечей массой по 1,13 г каждая. Упаковывают и оформляют к отпуску. 7. Упаковка, оформление к отпуску, условия хранения. Готовые свечи аккуратно укладывают в картонную коробку на гофрированную капсулу, сверху покрывают вощеной капсулой с насечкой. Основная этикетка: «Наружное», предупредительные надписи: «Хранить в прохладном месте», «Беречь от детей», отдельный рецептурный номер. 8. Паспорт письменного контроля (лицевая сторона). Левомицетина 0,1*20 = 2,0 г Масла какао 1,0*20 = 20,0 г Безводного ланолина 0,7 г 9. Оценка качества лекарственной формы. Анализ документации. Рецепт формы 107-1/у, оформлен в соответствии с требованиями НД. Ингредиенты совместимы. Письменный контроль. Расчеты на оборотной и лицевой стороне ППК выполнены правильно. Последовательность технологических операций верная. Опросный контроль. Проводится выборочно. Органолептический контроль. Внешний вид проверяется визуально. Свечи правильной формы белого цвета. Химический контроль. Подлинность и количественное содержание лекарственных веществ соответствует прописи. Упаковка и оформление. Лекарственный препарат оформлен согласно требованиям НД. Вывод: Лекарственный препарат удовлетворяет требованиям ГФ, приказов и инструкций (приказы МЗ РФ №214, 1997 г., № 751н). 3.3. Возьми: Рибофлавина 0,002 Кислоты аскорбиновой 1,0 Калия йодида 0,3 Воды очищенной 10 мл Смешай. Дай таких доз числом 10. Обозначь. По 2 капли 3 раза в день в оба глаза. Ответ: 1. Рецепт на русском и латинском языках. Возьми: Рибофлавина 0,002 Кислоты аскорбиновой 1,0 Калия йодида 0,3 Воды очищенной 10 мл Смешай. Дай таких доз числом 10. Обозначь. По 2 капли 3 раза в день в оба глаза. . Rp.: Riboflavini 0,002 Acidi аscorbinici 1,0 Kalii iodidi 0,3 Aquae purificatae 10 ml D. t. d. 10. S. По 2 капли 3 раза в день в оба глаза. 2. Фармацевтическая экспертиза рецепта: форма рецептурного бланка, требования, проверка совместимости ингредиентов, проверка доз и предельно-допустимого количества для выписывания в рецепте ядовитых и сильнодействующих веществ. Форма рецептурного бланка (приказ № 110 от 12 февраля 2007г.) - N 107-1/у. Проверка фармацевтической (физико-химической, химической и фармакологической) совместимости ингредиентов прописи. Вывод. ЛВ совместимы. Проверка доз веществ списка А и Б, НЕО учетных веществ. Дозы не проверяют, т.к. ЛП для наружного применения. Учетных ЛВ нет. Вывод. Лекарственный препарат изготавливать можно. 3. Физико-химические свойства входящих ингредиентов. Хранение. Применение. Riboflavinum (рибофлавин) - желто-оранжевый кристаллический порошок горького вкуса, со слабо-специфическим запахом, на свету неустойчив. Мало растворим в воде (1:5000). Витамин. Хранение. В защищенном от света месте. Acidum ascorbinicum (кислота аскорбиновая) - белый кристаллический порошок кислого вкуса, легко растворим в воде (1:3,5). Хранение. В хорошо укупоренной таре, предохраняя от действия света. Витамин. Kalii iodidum (калия иодид) - бесцветные кубические кристаллы или белый мелкокристаллический порошок без запаха, солено-горького вкуса. Легко растворим в воде (1:0,75). Хранение. В сухом защищенном от света месте. В офтальмологии при лечении катаракты. 4. Рабочая пропись (обратная сторона ППК). Проверка изотоничности mнатрия хлорида = 0,009х10 – (1х0,18 + 0,3х0,35) 0,09 < 0,285 Вывод: раствор гипертоничный. Готовят на растворе рибофлавина: Vр-ра рибофлавина (1:5000) = 0,002 х 5000 = 10 мл Калия йодида 0,3 Аскорбиновой кислоты 1,0 5. Характеристика лекарственной формы. Особенности. Глазные капли - жидкая лекарственная форма, предназначенная для инстилляции в глаз. Они представляют собой водные или масляные растворы фармацевтических субстанций, чаще всего антисептиков, анестетиков и композиций, снижающих внутриглазное давление. Капли глазные должны: - изготавливаться в асептических условиях и быть стерильными; - выдерживать испытания на механические включения; - не должны обладать токсическим и раздражающим действием; быть комфортными при применении (изотоничны, изогидричны со слезной жидкостью); - быть стабильными в условиях часто открываемой упаковки. К глазным каплям не предъявляется требование апирогениости. При таком способе применения пирогенные вещества не попадают в кровь. Поэтому глазные капли готовят на воде очищенной, а не на воде для инъекций. 6. Оптимальный вариант технологии с теоретическим обоснованием. В стерильный флакон отмеривают раствор рибофлавина (1:5000) 100 мл. Растворяют при перемешивании 3,0 г калия йода и 10,0 г кислоты аскорбиновой. Фильтрование по мере необходимости через стерильный комбинированный фильтр, промытый стерильной водой. 7. Упаковка, оформление к отпуску, условия хранения. Во флаконы из нейтрального стекла по 10 мл. Флакон с раствором укупоривают резиновой пробкой, проверяют на отсутствие механических включений, обкатывают металлическим колпачком. Основная этикетка «Глазные капли», предупредительные надписи «Хранить в прохладном и защищенном то света месте», «Беречь от детей», отдельный рецептурный номер. Срок годности препарата не более 2 суток. 8. Паспорт письменного контроля (лицевая сторона). Дата ППК к рецепту № 2 Sol. Riboflavini 1:5000 10 ml Acidi ascorbinici 10,0 Kalii iodidi 3,0 Vобщ = 10 ml Подписи: Изготовил _________ Проверил __________ 9. Оценка качества лекарственной формы. Фармацевтическая экспертиза рецепта проведена правильно. Номера препарата, рецепта и ППК соответствуют, расчеты сделаны правильно, ППК выписан верно. Наклеена основная этикетка «Глазные капли» с указанием № аптеки, № рецепта, ФИО пациента, способа применения, даты (число, месяц, год), цены. Имеется отдельный рецептурный номер, предупредительные надписи «Хранить в прохладном и защищенном от света месте», «Беречь от детей» – МУ от 04.07.97. Вместимость флакона соответствует объему препарата. Укупорка герметична: металлический колпачок не прокручивается и при переворачивании флакона жидкость не подтекает. Раствор прозрачный, желтого цвета, механических включений нет. Отклонения в объеме укладываются в норму допустимых отклонений – пр. № 751н (± 10%). Vпрепарата = 10±1 мл [9 мл; 11 мл] Вывод. Препарат изготовлен удовлетворительно. 4. Сделайте необходимые расчеты: 4.1. Составьте рабочую пропись для изготовления 1500 мл раствора натрия гидрокарбоната изотонического для инъекций. (Изотонический эквивалент по натрию хлориду 0,65). Ответ: Natrii hydrocarbonis – (ГФ Х, ст.430) белый кристаллический порошок без запаха, соленощелочного вкуса, устойчив в сухом воздухе, медленно разлагается во влажном. Водные растворы имеют щелочную реакцию. Растворим в воде. Aqua pro ingectionibus (ФС 42-2620-97) - бесцветная, прозрачная жидкость без вкуса и запаха, не содержит пирогенные вещества. Инфузионный раствор для внутривенного капельного введения, представляющий собой истинный водный раствор лекарственного вещества – натрия гидрокарбоната, не требующего стабилизации, выдерживающего термическую стерилизацию. Изготовление инъекционного раствора ведется в соответствии с требованиями приказов РФ № 214 от 16.07.97 г. и МЗ РФ №751 от 26.10.2015 г. и статьи ГФ Х1 «Инъекционные лекарственные формы». Рабочая пропись (обратная сторона ППК). Проверка изотоничности mнатрия хлорида = 0,009х1500 = 13,5 г Раствор должен быть изотоничен, следовательно гидрокарбоната натрия следует взять 13,5/0,65 = 20,77 г. Сmax (%) = 20,77*100/(1500+20,77) = 1,36%. КУО натрия гидрокарбоната = 0,3. Прирост объема 20,77*0,3 = 6,23 мл уложится в норму отклонения объема (+-1%) - 15 мл. Следовательно КУО не учитываем. Лицевая сторона Дата №2 Aguae pro injectionibus 1500 ml Natrii hydrocarbonatis 22,77 Объем 1500 мл Простерилизовано! Приготовил (подпись) Проверил (подпись) Отпустил (подпись) 4.2. Рассчитайте необходимое количество натрия хлорида для изготовления 50 мл раствора атропина сульфата 0,1% для глазных капель. (Изотонический эквивалент по натрию хлориду 0,1). Ответ: Rp.: Solutionis Atropini sulfatis 0,1% - 50 ml В рецепте выписана сложная жидкая лекарственная форма для наружного применения – глазные капли. Глазные капли должны быть изотоничны слезной жидкости. Следует проверить изотоничность глазных капель и рассчитать необходимое количество натрия хлорида для доизотонирования раствора. Изотонический эквивалент атропина сульфата по натрию хлорида равен 0,1. Для приготовления 50 мл изотонического раствора только из натрия хлорида его потребуется 0,009*50 = 0,45 mнатрия хлорида = 0,009х50 – (0,05х0,1) = 0,445 Приготовление следует вести в асептических условиях на стерильной воде очищенной по правилам приготовления капель с концентрацией веществ менее 3 %. 5. Вопросы тестового контроля. Выберите один правильный ответ. 5.1. К инфузионным относятся растворы объемом более: а) 50 мл б) 100 мл в) 200 мл г) 400 мл 5.2. К нестерилизуемым растворам для инъекций относят: а) Раствор адреналина гидротартрата 0,18% б) Раствор аминазина 2,5% в) Раствор новокаинамида 10% г) Раствор бемегрида 5.3. Ронгалит, натрий метабисульфит, натрий сульфит применяют в качестве: а) консерванта б) антиоксиданта в) пролонгатора г) изотонирующего компонента д) корригента 5.4. Стадия технологического процесса при производстве ампулированных растворов, которая идет после сушки и стерилизации ампул а) приготовление раствора б) стерилизующая фильтрация в) наполнение ампул г) запайка ампул д. определение герметичности 5.5. Установите соответствие. Способы наполнения ампул растворами: Вид раствора Метод наполнения 1. Водные растворы А. Вакуумный 2. Неводные растворы Б. Пароконденсационный В. Турбовакуумный Г. Шприцевой Ответ:
|
