1. Изохорный процесс изменение состояния идеального газа
 Скачать 15.63 Mb. Скачать 15.63 Mb.
|
|
1. Изохорный процесс изменение состояния идеального газа.  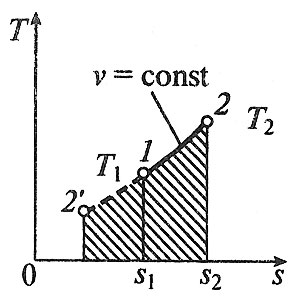 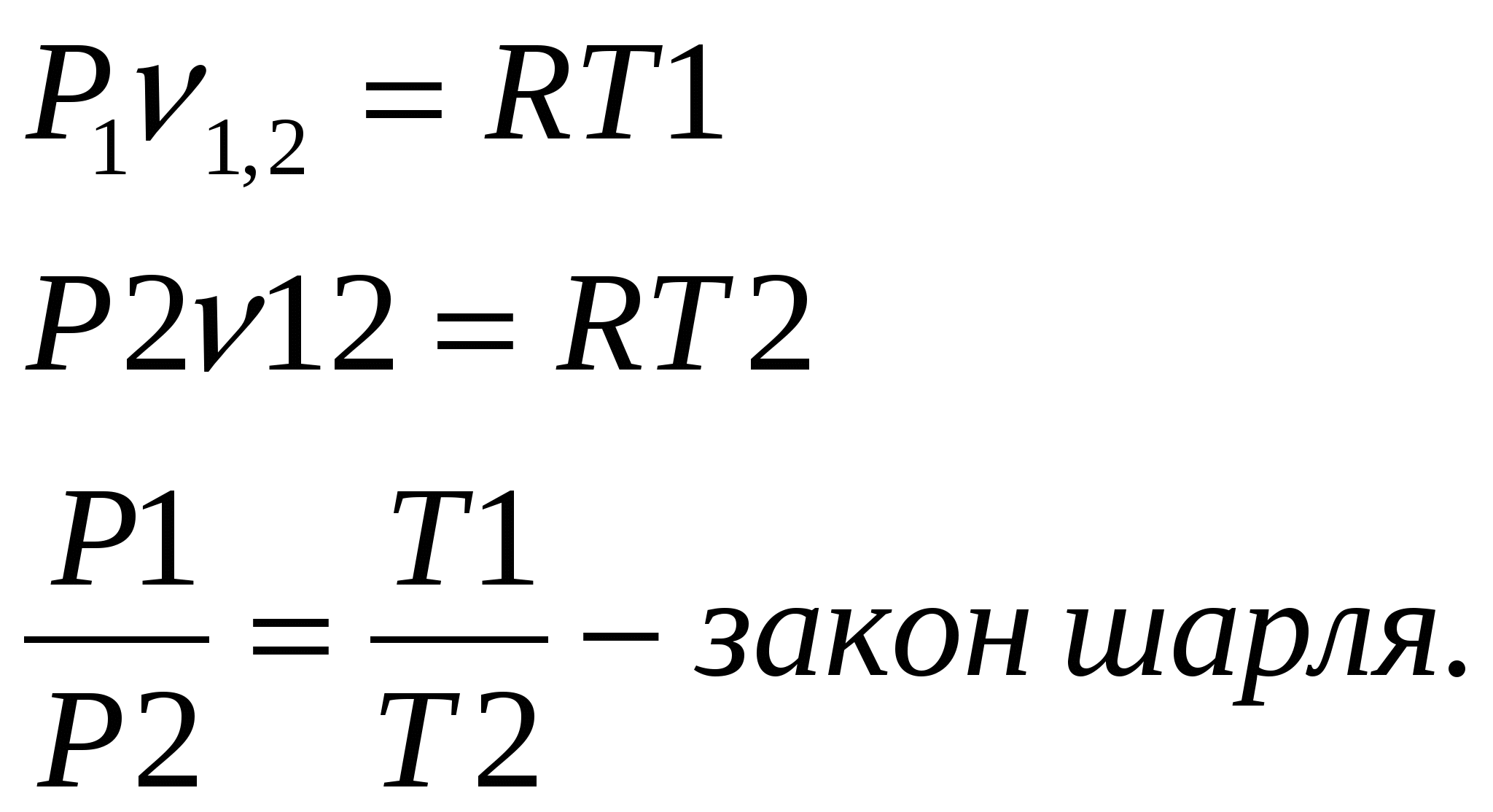 Для получения значения энергии запишем 1ое начало термодинамики.  T-S диаграмма используется для определения количества подведенного или отведенного тепла. Т.к Т2>Т1 в процессе 1-2, то тепло подводится, если Т2<Т1 то тепло отводится. Кол-во подведенного и отведенного тепла определяется как площадь под кривой 1-2. Удельная располагаемая работа обозначается Изменение удельной энтропии найдем из 1го и 2ого Н Т/Д. 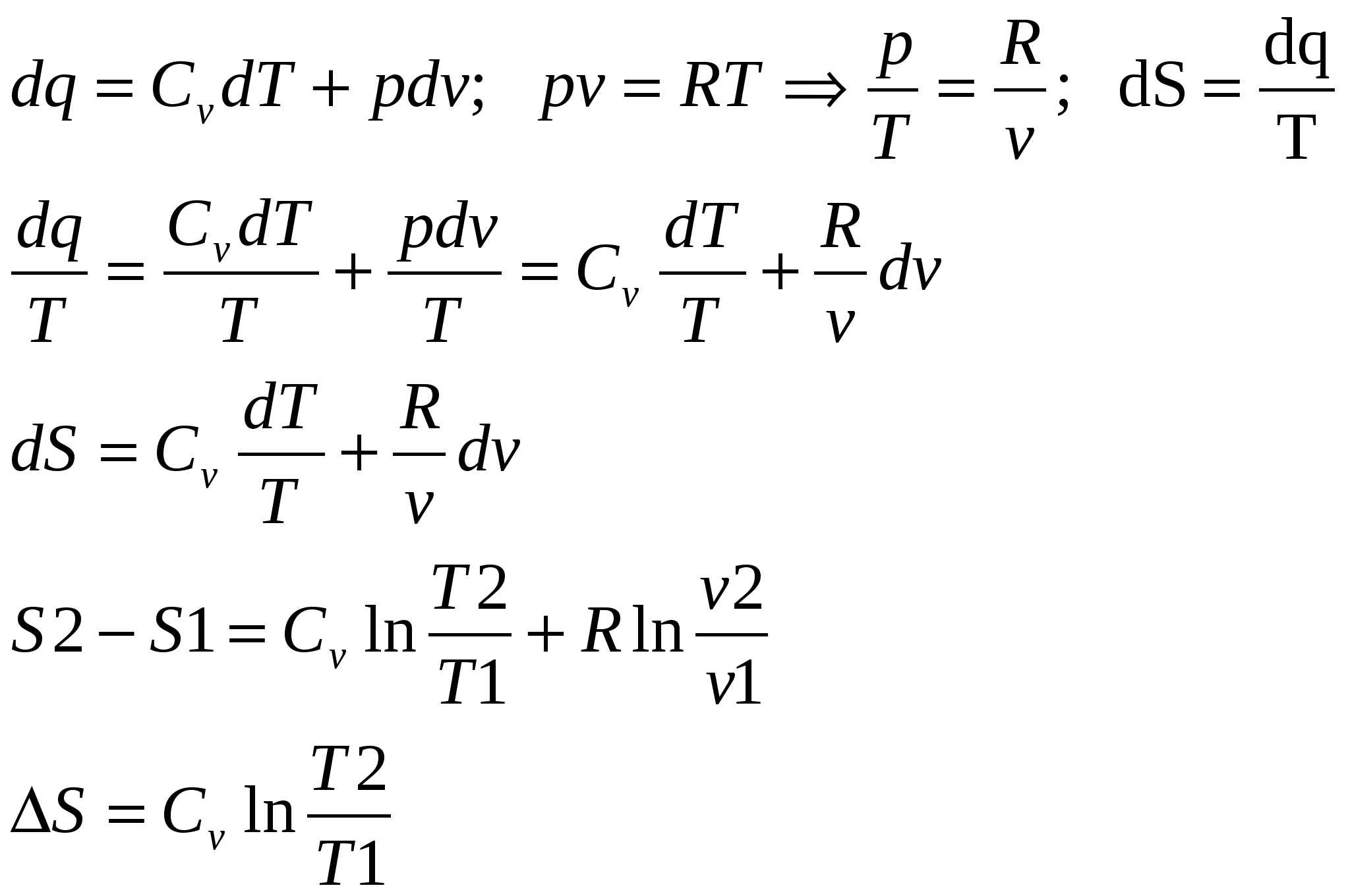 Количество полной теплоты идет на изменение энергии. 2. Изобарный процесс изм сост ид газа. р=соnst, dp=0  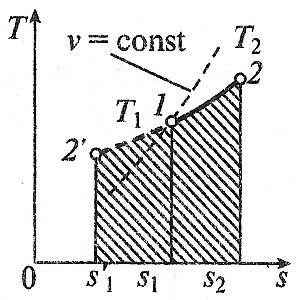  Часть теплоты подведенной к рабочему телу идет на изменение внутренней энергии, а часть на совершение работы.  При изобарном процессе 28,5% всей подведенной теплоты расходуется на совершение работы, 71,5%-идет на изменение внутренней энергии тела. Изменение энтропии. Т.к. Ср>Сv , то изменение энтропии при изобарном процессе будет больше чем при изохорном. Изобара 1-2 при одинаковой температуре Т1 и Т2 более пологая чем изохора 1,2’.  3. Изотермический пр-с изм сост ид газа. Т=const. dT=0 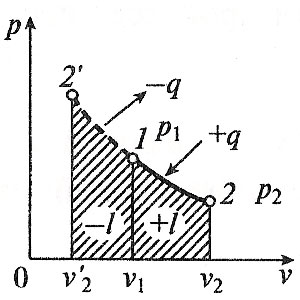  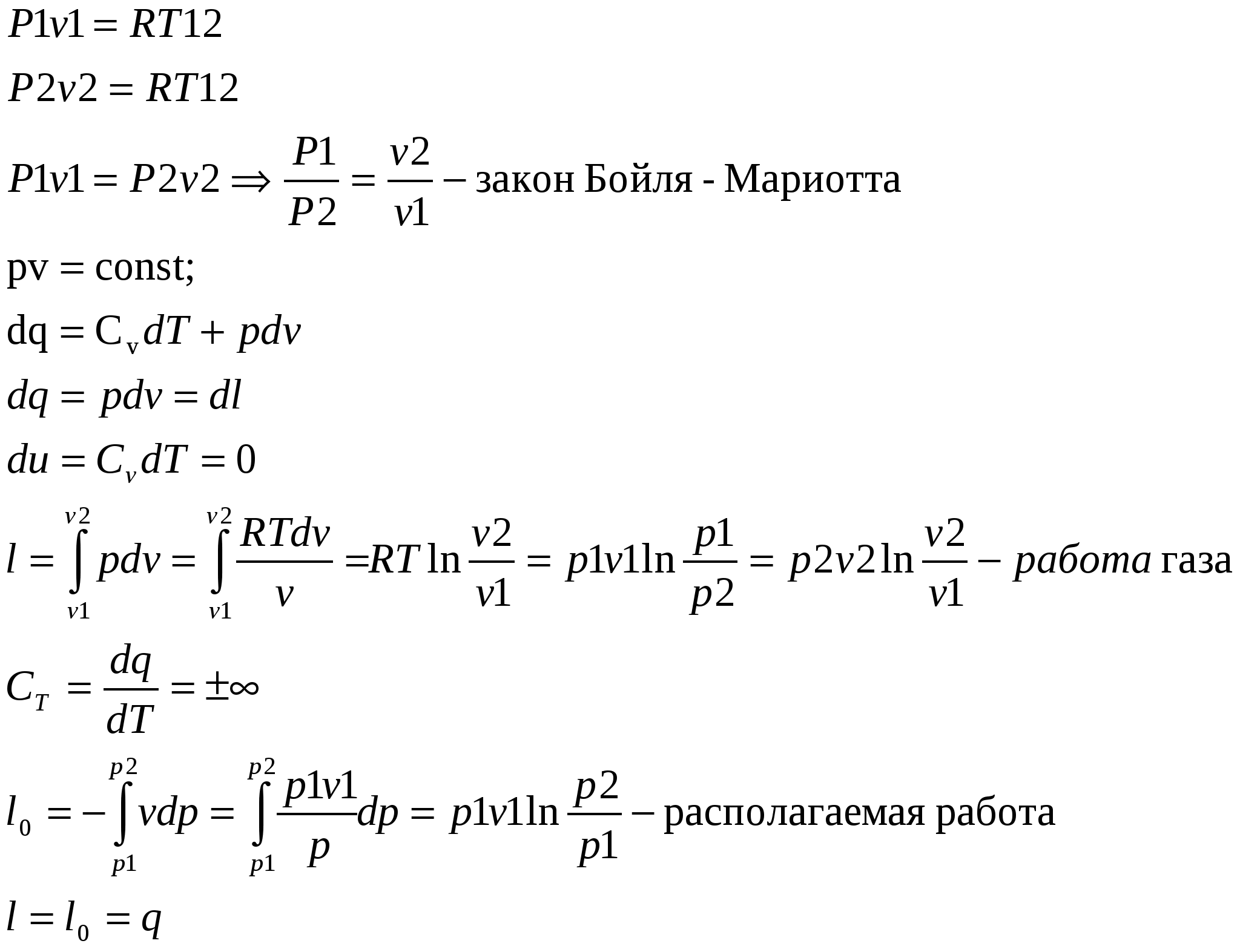 В изотермическом пр-се идеальная работа газа, располагаемая работа, изменение объема и удельное количество теплоты равны между собой. Изменение энтропии:  4. Адиабатный пр-с изм сост ид газа. Адиабатным процессом наз пр-с происходящий без теплообмена с окруж средой.   Первое Н Т/Д: 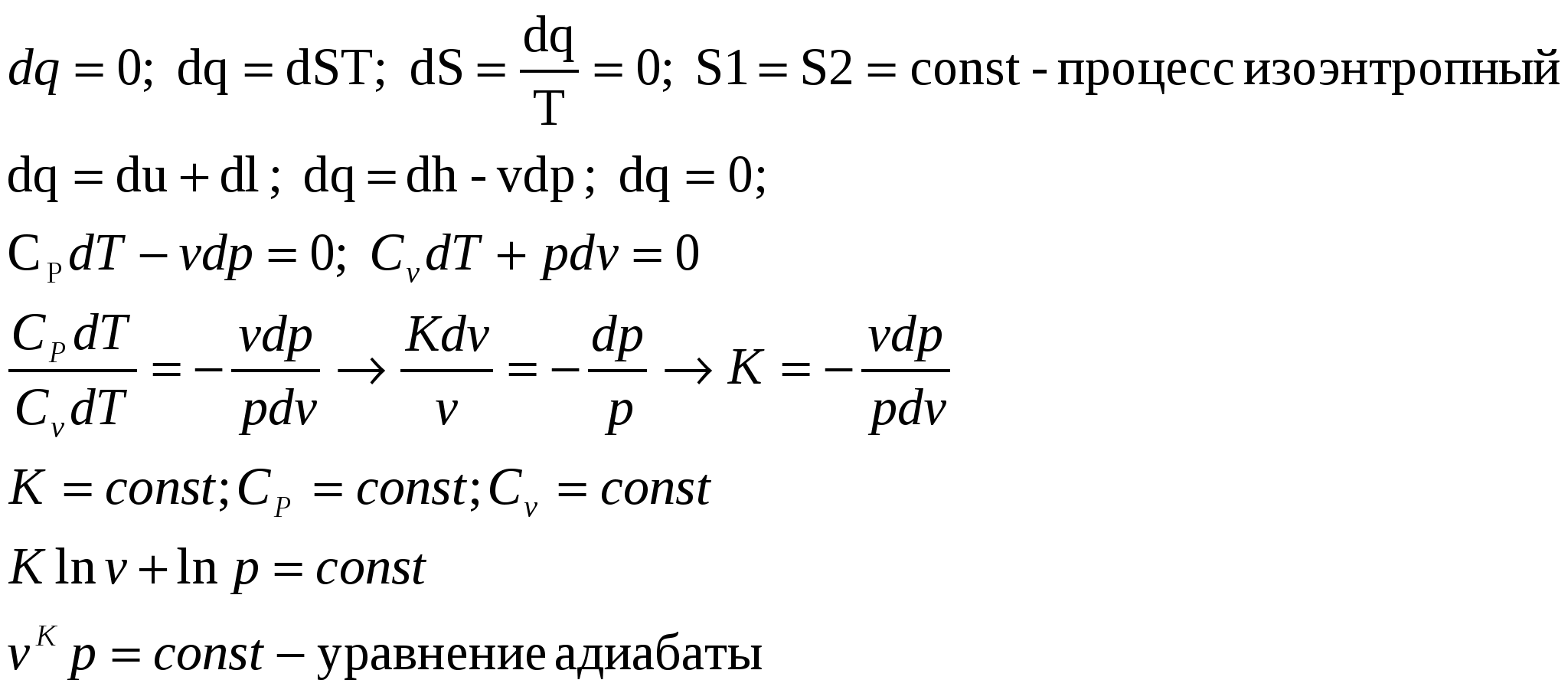 Адиабата идет круче чем изотерма. В адиаб пр-се работа совершается за счет убыли внутр энергии рабочего тела.  Располагаемая работа l0 для адиаб пр-са в К раз больше удельной работы расширения газа и противоположна ей по знаку. Из ур-я адиабаты видно, т.к. K>1, то адиабата идет круче чем изотерма. Т.к. адиабата идет круче чем изотерма то адиаб пр-с идет без теплообмена с окр средой и расширение газа происходит только за счет падения ее внутр энергии, в изотерм пр-се расширение газа происходит за счет подведения теплоты. Если от т А сжать газ, то адиабата А1 располагается круче изотермы А1’, т.к. при адиабатном пр-се теплота не отводится и температура газа с увеличением давления растет больше чем в изотермическом пр-се. 5. Политропный пр-с – прс-с в котором удельная теплоемкость остается постоянной. График процесса политропы – это кривая которая описывает газовые пр-сы, в кот-ых происходит изменение всех термодинамических параметров. Кол-во подведенной теплоты:  Если n= Соотношение параметров. Заменим показатель адиабаты на показатель политропы. Получим, Работа в политропном пр-се. Для работы в политропном пр-се используется выражение работы в адиаб пр-се заменим K на n.  Располагаемая работа l0 в n раз больше удельной работы: Теплоемкость:  Пр-сы начинающиеся в т А и проходящие с расширением рабочего тела имеют положительную работу. Пр-сы в области 5,6,7,8 имеют отрицат работу, т к рабочее тело в этих областях сжимается. Для 1,2,3,8 проходят при подводе теплоты, а в области 4,5,6,7 – с отводом теплоты. Пр-сы происходящие во 2ой, 7,8 сопровожд повышением температуры раб тела. 3,5,6,4 – температура понижается. 3 – при подводе теплоты происходит падение температуры раб тела, 7 – происходит повыш темпер, при отводе теплоты к раб телу. Вывод изменения энтропии: 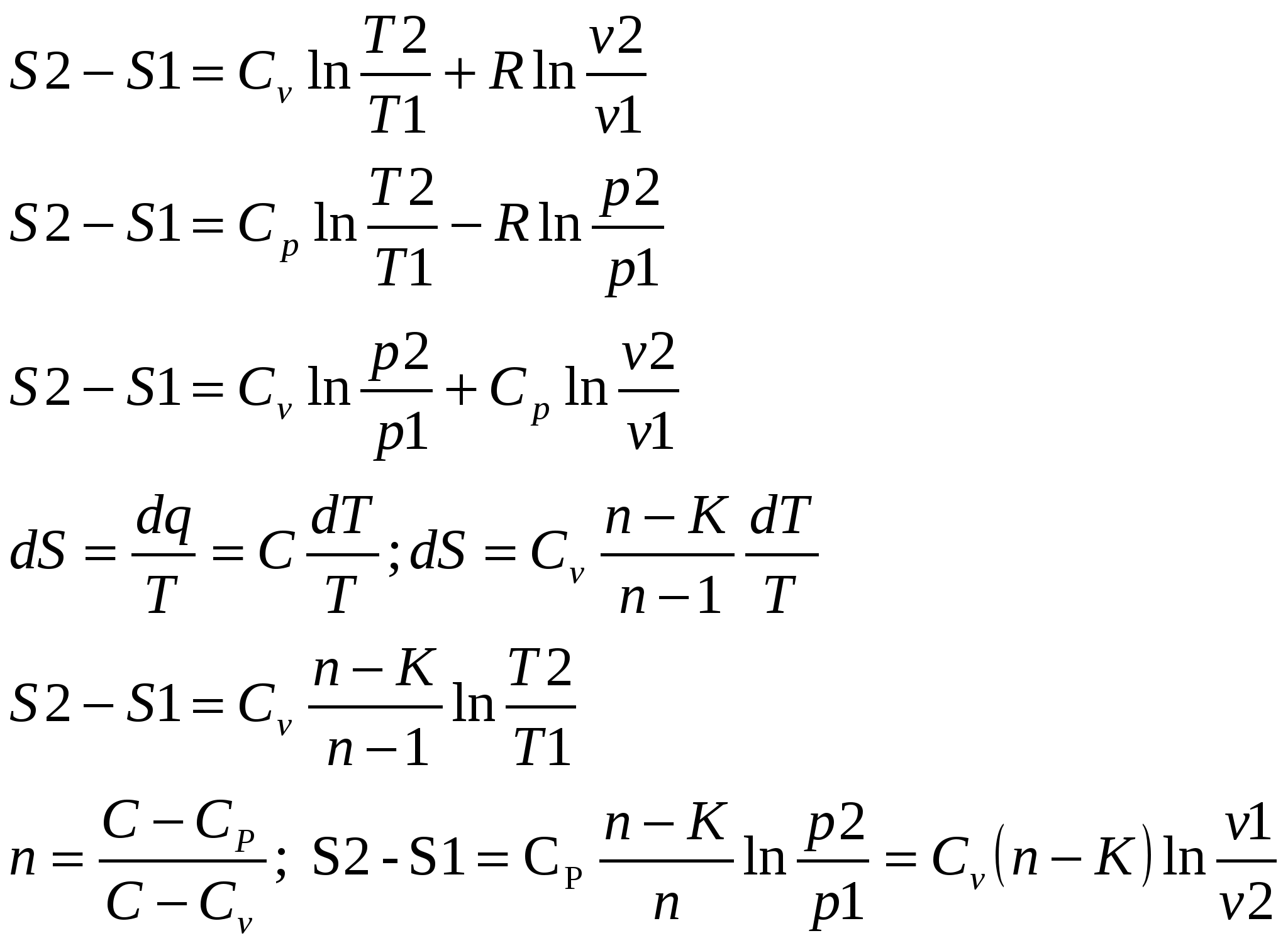 6. Термодинамическая фазовая рТ-диаграмма. Все прямые фазовые переходы требуют подвода теплоты и происходят при постоянном давлении и постоянной температуре. Переход из одного агрегатного состояния в другое принято рассматривать на РТ-диаграмме. Если взять в кач-ве независимого параметра Т, то есть три линии: p=f1(T)-AK – соответ. равновесному состоянию Ж и Г фазы- испарение p=f2(T)-AC p=f3(T)-AB. Эти линии представляют геометрич место точек в которых находится в равновесном состоянии любая пара из 3х агрегатных состояний. АС-соответствует равновесному состоянию Т и Г фазы (сублимация по прямому пр-су)- десублимация. АВ-соответ равновесному состоянию Т и Ж фазы – плавление (кристаллизация) Температура при котором происходит переход из Твердого состояния в Ж – Тпл, Ткрист. Кол-во теплоты подведенное в этом пр-се – теплота плавления (кристаллиз). Температура перехода в-ва из Ж в Г – Ткип, (Тконд). Теплота в этом пр-се которое выделяется или поглощается – теплота парообразования или теплота конденсации. Температура из Т в Пар – температура сублимации. Теплота подведенная или отведенная назыв теплотой сублимации. Кривая на которых происходит в зависимости от давления и температуры переход из Ж состояния в Г заканчивается в точке К – это критическая точка. В т К исчезает физическое различие между жидким и газообразным состоянием в-ва, а точнее плотности пара водяной смеси равной плотности жидкости. Критическое давление – Рк = 22,12 МПа, Тк = 374,16 С. Все три кривые пересекаются в т А которая наз тройной точкой. В этой точке исчезает различие между тремя фазами Т Ж Г. Изобарная теплоемкость для фазового перехода равна бесконечности. Коэффициент изобарного (объемного) расширения: Коэффициент изотермического сжатия: Уравнение Клайперона-Клазиуса связывает температуру, давление, удельный объем с теплотой фазового перехода 7. pV диаграмма водяного пара. AF-зависимость удельного объема воды от давления при температуре 0 С. Область, которая заключается между изотермой и осью координат – область равновесного существования Ж и Т фаз. При нагреве, объем начнет увелич и при достижении кипения в т А1 становится максимальной. С увеличением давления увелич Т, в т А1 v2>v1. АК- пограничная кривая жидкости, во всех точках степень сухости = 0, Х=0. КВ-пограничная кривая пара, Х=1. Дальнейший подвод теплоты переводящий воду из состояния насыщения в состояние сухого пара: А1-В1, А2-В2 – изобарно – изотермич пр-сы. Зависимость удельного объема v′′ изображается кривой КВ- пограничной кривой пара. Пар на этой кривой имеет степень сухости Х=1. При дальнейшем подводе теплоты к сухому пару в т Д1 и Д2, в котором находится перегретый пар, р=const, а Т растет. Линии В2-Д2, В1-Д1 – изобарный пр-с перегретого пара. АК и КВ делят область диаграммы на три части. Левее АК располагается жидкость, а правее – влажный насыщенный пар (пароводяная смесь). КВ – сухой насыщенный пар, правее перегретый. К – критическая точка. А – тройная точка, Ткип = 0,001 С Удельное кол-во работы 8. TS-диаграмма водяного пара используется при исследовании холодильных установок и паросиловых установок А-а-А1. Р-м пр-сы нагрева: А1В1- линия парообразования В1Д1-линия пароперегрева Левее АК находится жидкость. АК и КВ- область влажного насыщ пара Область правее КВ – перегретый пар Между АК и КВ наход линии кривые промежуточной степени сухости. TS диаграмма используется для определения подводимого или отводимого тепла. Из TS диаграммы видно что самое большое кол-во теплоты идет на пр-с парообразования, меньше на пароперегрев, еще меньше на нагревание. Пр-с пароперегрева - в пароперегревателе, в котлах – парообразование. По тепловому потоку вначале располагаются испаритель, пароперегреватель, экономайзер. 9. hS диаграмма водяного пара. Эта диаграмма наиболее удобна для расчетов. В отличие от pV и TS диаграмм связана величина удельной работы, а так же кол-во подведенного и отведенного тепла, изобр не виде площади, а в виде отрезков. За начало координат hS диаграммы принимают состояние воды в тройной точке, где величина энтальпии и энтропии равна 0. По оси абсцисс – энтропия, по ординате – энтальпия. На диаграмме наносятся пограничные кривые жидкости АК и пара – линия КВ. Пограничные кривые выходят из начала координат. На hS диаграмме находятся: изобары изотермы изохоры. Изобары в области влажного пара, представляет собой прямые линии выходящие из начала пограничной кривой жидкости к которой они касаются. В этой области изобары совпадают с изотермой, т е имеют одинаковый угол наклона. Порядок расчета по диаграмме: 1. по заданным начальным и конечным параметрам пр-са находят график пр-са и все параметры в этих точках; 2. определяют изменение внутренней энергии: 3. определяют теплоту пр-са по след формулам:  Все данные начальных и конечных точек определяются по таблице Ривкин «Термические св-ва воды и пара», наиболее точные Вукалович. 10. Основные параметры воды и водяного пара. Определим кол-во теплоты которое потребуется для нагрева воды от 0 С до t кипения или t насыщения при p =const. По 1ому Н Т/Д: Кол-во необходимое для нагрева воды до температуры насыщения: Нарисуем TS диаграмму. Величина  Удельной теплотой парообразования называется кол-во теплоты которое идет на превращение в пар 1 кг воды нагретой до состояния насыщения Удельный объем влажного насыщ пара: 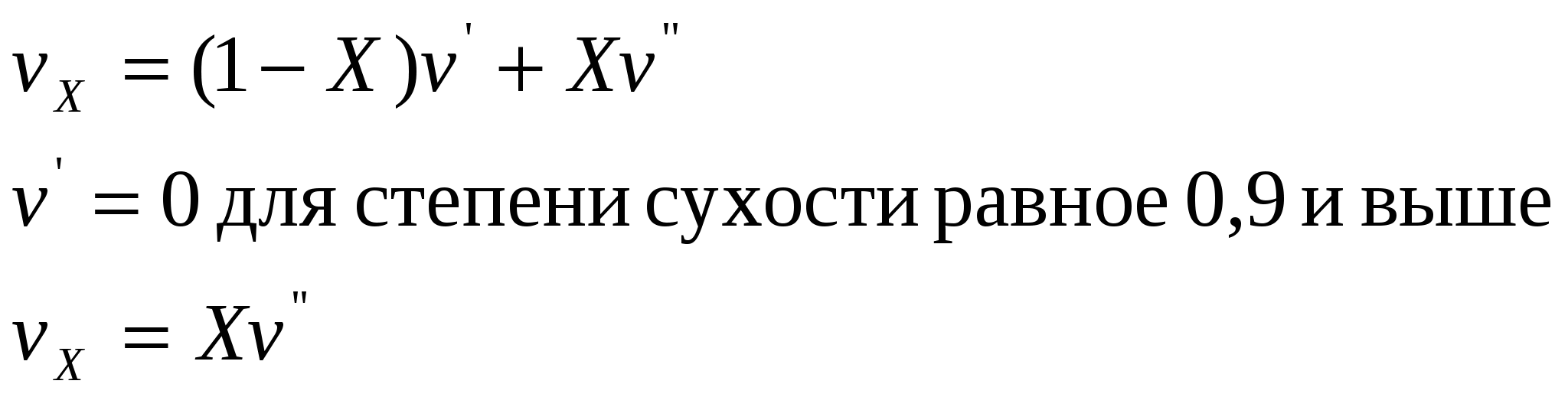 Удельная энтальпия: Пр-с пароперегрева: для перегретого пара t выше t насыщения v>v насыщения.  , где , где Для перегретого пара величина энтальпии:  |
