Вариант 1. 1. Качественная реакция на ион железа (iii) реакция со щелочью
 Скачать 232.31 Kb. Скачать 232.31 Kb.
|
|
Вариант 1  Ионы железа (III) в растворе можно определить с помощью качественных реакций. Проведем некоторые из них. Возьмем для опыта раствор хлорида железа (III). 1. Качественная реакция на ион железа (III)– реакция со щелочью. Если в растворе есть ионы железа (III), образуется гидроксид железа (III) Fe(OH)3. Основание нерастворимо в воде и бурого цвета. (Гидроксид железа (II) Fe(OH)2. – также нерастворим, но серо-зеленого цвета). Бурый осадок указывает на присутствие в исходном растворе ионов железа (III). FeCl3 + 3 NaOH = Fe(OH)3 ↓+ 3 NaCl 2. Качественная реакция на ион железа (III) – реакция с желтой кровяной солью. Желтая кровяная соль – это гексацианоферрат калия K4[Fe(CN)6]. (Для определения железа (II) используют красную кровяную сольK3[Fe(CN)6]). К порции раствора хлорида железа прильем раствор желтой кровяной соли. Синий осадок берлинской лазури* показывает на присутствие в исходном растворе ионов трехвалентного железа. 3 К4[Fe(CN)6 ] +4 FeCl3 = KFe[Fe(CN)6])↓ + 12 KCl 3. Качественная реакция на ион железа (III) – реакция с роданидом калия. Вначале разбавляем испытуемый раствор – иначе не увидим ожидаемой окраски. В присутствии иона железа (III) при добавлении роданида калия образуется вещество красного цвета. Это ‑ роданид железа (III). Роданид от греческого "родеос" - красный. FeCl3 + 3 КCNS = Fe(CNS)3 + 3 KCl Fe3+. Аналитические реакции катионов V аналитической группы по кислотно-основной классификации: Mg2+, Mn2+, Fe2+, Fe3+, Bi3+, Sb3+, Sb5+. Групповой реагент – гидроксид натрия или калия. Наблюдается выпадение осадка. Fe3++3NaOH→Fe(OH)3 ↓+3Na+ Сl-.Анион первой аналитической группы Реакция с нитратом серебра AgNO3. Нитрат серебра в присутствии азотной кислоты образует с хлорид-ионами белый творожистый осадок хлорида серебра. Ag+ + Cl- = AgCl(тв). Этот осадок нерастворим в HNO3, но легко растворим в растворах гидроксида аммония, карбоната аммония, цианида калия и тиосульфата натрия за счет образования растворимых комплексных солей серебра: AgCl (тв) + 2NH3 = [Ag(NH3)2]+ + Cl-, Осадок AgCl постепенно темнеет на свету вследствие его разложения: 2AgCl (тв) = 2Ag + Cl2 (г). Методика проведения реакции.В пробирку помещают 3 капли раствора хлорида, 2 капли 2 н. раствора HNO3, 2 капли раствора AgNO3 и наблюдают образование белого осадка AgCl. К полученному осадку добавляют избыток 2 н. раствора NH4ОН и наблюдают его растворение.  Кислотно-основная схема разделения катионов: 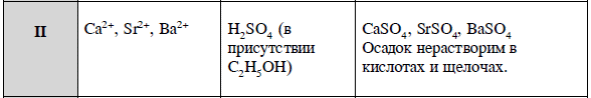  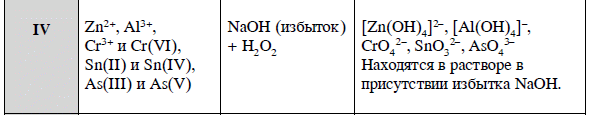 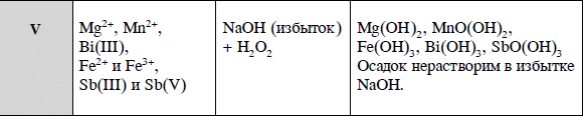  Обнаруживаемый минимум - это наименьшее количество иона, которое удается обнаружить с помощью данной реакции (при соблюдении необходимых условий). Выражают обнаруживаемый минимум в миллионных долях грамма - микрограммах, иногда обозначаемых буквой γ =2·10-8г. Предельной концентрацией называется отношение массы определяемого иона к Предельная концентрация выражается в г/мл и обозначается через Спред=10-6 г/мл  ПР(СuS)=[Cu2+][S2-]=S2 S=(ПР)0,5=(6,3·10-36)0,5 =2,5·10-18 моль/л= 2,4·10-16 г/л Mr(СuS)=64+32=96 г Ответ: 2,5·10-18 моль/л, 2,4·10-16 г/л  K2SO3 – соль сильного основания и слабой кислоты, поэтому гидролиз протекает по аниону. Первая стадия гидролиза Молекулярное уравнение: K2SO3 + H2O ⇄ KOH + KHSO3 Полное ионное уравнение: 2K+ + SO32- + H2O ⇄ K+ + OH- + K+ + HSO3- Краткое ионное уравнение: SO32- + H2O ⇄ HSO3- + OH- Вторая стадия гидролиза Молекулярное уравнение: KHSO3 + H2O ⇄ KOH + H2SO3 Полное ионное уравнение: K+ + HSO3- + H2O ⇄ K+ + OH- + H2SO3 Краткое ионное уравнение: HSO3- + H2O ⇄ H2SO3 + OH- Т.к. в результате гидролиза образовались гидроксид-ионы (OH-), то раствор будет имееть щелочную среду (pH > 7). Константа гидролиза: Kг = Kв/Kк = 10-14/(6,2 · 10-8) = 1,6 · 10-5 Степень гидролиза: h = √(Kг/Cм) = √(1,6 · 10-5/0,01) = 4 ·10-4 Для вычисления рН следует принять во внимание. что в результате гидролиза образуется один гидроксид-ион. Если исходная концентрация гидролизующихся ионов Cммоль/л, а гидролизу подверглась доля h этих анионов, то при этом образовалось hCм моль/л гидроксид-ионов. Таким образом: [OH-] = hCм = 4 ·10-4·0,01 = 4 ·10-6 моль/л Следовательно: pOH = -lg[OH-] = -lg(4 ·10-6) = 5,4 Отсюда: pH = 14 - pOH = 14 - 5,4 = 8,6 |
