Хз. 1. Карбонат Калия
 Скачать 89.89 Kb. Скачать 89.89 Kb.
|
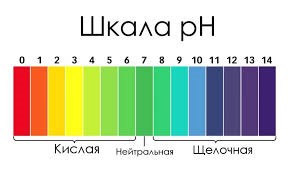 pH-называемый водородный показатель или показатель кислотности, это одна из важнейших величин, выражающих кислотно-основные свойства раствора. pH меняется непрерывно в диапазоне от 0 до 14  1.Карбонат Калия. Первая ступень Молекулярное уравнение:K2CO3 + HOH ⇄ KHCO3 + KOH Полное ионное уравнение: 2K+ + CO32- + HOH ⇄ K+ + HCO3- + K+ + OH- Краткое ионное уравнение: CO32- + HOH ⇄ HCO3- + OH- Вторая ступень гидролиза. Молекулярное уравнение: KHCO3 + H2O ⇄ H2CO3 + KOH Полное ионное уравнение: K+ + HCO3- + H2O ⇄ H2CO3 + K+ + OH- Краткое ионное уравнение: HCO3- + H2O ⇄ H2CO3 + OH- раствор имеет щелочную среду. Соответственно (pH>7) Лакмус окраситься в синий цвет 2.Хлорид Железа(III) ПЕРВАЯ СТУПЕНЬ (СТАДИЯ) ГИДРОЛИЗА Молекулярное уравнение FeCl3 + HOH ⇄ FeOHCl2 + HCl Полное ионное уравнение Fe3+ + 3Cl- + HOH ⇄ FeOH2+ + 2Cl- + H+ + Cl- Сокращенное (краткое) ионное уравнение Fe3+ + HOH ⇄ FeOH2+ + H+ ВТОРАЯ СТУПЕНЬ (СТАДИЯ) ГИДРОЛИЗА Молекулярное уравнение FeOHCl2 + HOH ⇄ Fe(OH)2Cl + HCl Полное ионное уравнение FeOH2+ + 2Cl- + HOH ⇄ Fe(OH)2+ + Cl- + H+ + Cl- Сокращенное (краткое) ионное уравнение FeOH2+ + HOH ⇄ Fe(OH)2+ + H+ ТРЕТЬЯ СТУПЕНЬ (СТАДИЯ) ГИДРОЛИЗА Молекулярное уравнение Fe(OH)2Cl + HOH ⇄ Fe(OH)3 + HCl Полное ионное уравнение Fe(OH)2+ + Cl- + HOH ⇄ Fe(OH)3 + H+ + Cl- Сокращенное (краткое) ионное уравнение Fe(OH)2+ + HOH ⇄ Fe(OH)3 + H+ В результате гидролиза образовались ионы водорода (H+), поэтому раствор имеет кислую среду (pH < 7). Лакмус окраситься в красный 3.Гидролиз хлорида калия Гидролизу не подвергается, т.к. в составе нет «слабого иона»: KCl ⇄ K+ + Cl—. Характер среды водного раствора – нейтральный. (pH=7) Лакмус окраситься в фиолетовый цвет |
