|
|
Документ Microsoft Word (2). 1 Материя (от лат materia вещество) физическое вещество, в отличие от психического и духовного. В классическом значении всё вещественное, телесное, имеющее массу, протяжённость, локализацию в пространстве, проявляющее корпускулярные свойства.
1
Мате́рия (от лат. materia «вещество») — физическое вещество, в отличие от психического и духовного. В классическом значении всё вещественное, «телесное», имеющее массу, протяжённость, локализацию в пространстве, проявляющее корпускулярные свойства.
Вещество́ — одна из форм материи, состоящая из фермионов или содержащая фермионы наряду с бозонами; обладает массой покоя, в отличие от некоторых типов полей, как например электромагнитное.
Вторая форма существования материи – физическое поле – материальная среда, в которой осуществляется взаимодействие частиц, не является непосредственным объектом химии.
Предмет изучения химии: химия изучает химическую форму движения материи, под которой понимают качественное изменение веществ, т. е. разрушение одних химических связей и образование других. В результате химических процессов возникают новые вещества с новыми химическими и физическими свойствами.
Задачи химии:
1. Получение веществ с заранее заданными свойствами (для развития новой техники необходимы материалы с особыми свойствами, которых нет в природе: сверхчистые, сверхтвердые, жаростойкие, сверхпроводящие).
2. Повышение эффективности производства и качества продукции.
3. Создание безвредных, безотходных технологий.
4. Рациональное использование энергии химических превращений (в настоящее время электрическую и механическую энергию получают в основном преобразованием химической энергии природного топлива).
2
Роль и значение химии в технологии машиностроения, авиастроения, приборостроения, полупроводниковой технике.
Велико значение науки о веществе в технике, развитие которой немыслимо без понимания процессов превращения веществ. Глубокое понимание законов химии и их применение позволяют как совершенствовать существующие, так и создавать новые процессы, машины, установки и приборы. Химические реакции широко используются во многих производственных процессах. Они (например, процессы окисления, коррозии и др.) протекают при работе установок, машин и приборов. Использование химических реакций в ряде производственных процессов позволяет резко повышать производительность труда и качество продукции, получать новые материалы. Для развития новой техники необходимы материалы с особыми свойствами, которых нет в природе: сверхчистые, сверхтвердые, сверхпроводящие, жаростойкие и т.п. Такие материалы поставляет современная химическая промышленность, поэтому можно понять важность химии для любой специальности. В электротехнической промышленности, например, более 80% продукции выпускается с применением полимерных материалов.
3
Все вещества состоят из атомов. Атомы бывают различные. Атомы каждого вида одинаковы между собой, но они отличаются от атомов любого другого вида. Атом — система взаимодействующих элементарных частиц, состоящая из ядра и электронов. Тип атома определяется составом его ядра. Ядро состоит из протонов и нейтронов, вместе называемых нуклонами. Элемент — совокупность атомов с одинаковым зарядом ядра, т. е. числом протонов. Атомы элемента могут иметь различные числа нейтронов в составе ядра, а следовательно, и массу. Такие атомы, относящиеся к одному элементу, называются изотопами. Каждый известный элемент имеет свое обозначение. Так водород обозначается как Н, углерод — С. Атом — наименьшая частица элемента, обладающая его химическими свойствами. https://lektsii.org/4-9668.html
квантовыми числами: п, l, т и s, где п — главное квантовое число, в основном определяющее энергию электрона; l — орбитальное (побочное) квантовое число, характеризующее момент количества движения электрона; т — магнитное квантовое число, характеризующее проекцию момента количества движения электрона на некоторое выделенное направление, а именно — направление внешнего магнитного поля; s — спиновое квантовое число, характеризующее некоторый дополнительный момент количества движения электрона, присущий самому электрону. На квантовые числа l, т и s накладываются следующие ограничения: l не может быть больше, чем главное квантовое число минус единица; т может принимать 2l +1 различных значений
4
https://studopedia.ru/1_120846_raspredelenie-elektronov-v-mnogoelektronnih-atomah.html
Распределение электронов в многоэлектронных атомах основано на трех положениях: принципе минимума энергии, принципе В. Паули и правиле Ф Хунда.
1. Заполнение энергетических уровней и подуровней происходит согласно принципу минимальной энергии: минимальной энергией обладают уровни и подуровни, ближайшие к ядру: 1s, 2s, 2p, 3s, 3p, 4s, 3d и т. д.

5
Существуют две формулировки периодического закона химических элементов: классическая и современная.
Классическая, в изложении его первооткрывателя Д.И. Менделеева: свойства простых тел, а также формы и свойства соединений элементов находятся в периодической зависимости от величин атомных весов элементов.
Современная: свойства простых веществ, а также свойства и формы соединений элементов находятся в периодической зависимости от заряда ядра атомов элементов (порядкового номера).

6
7
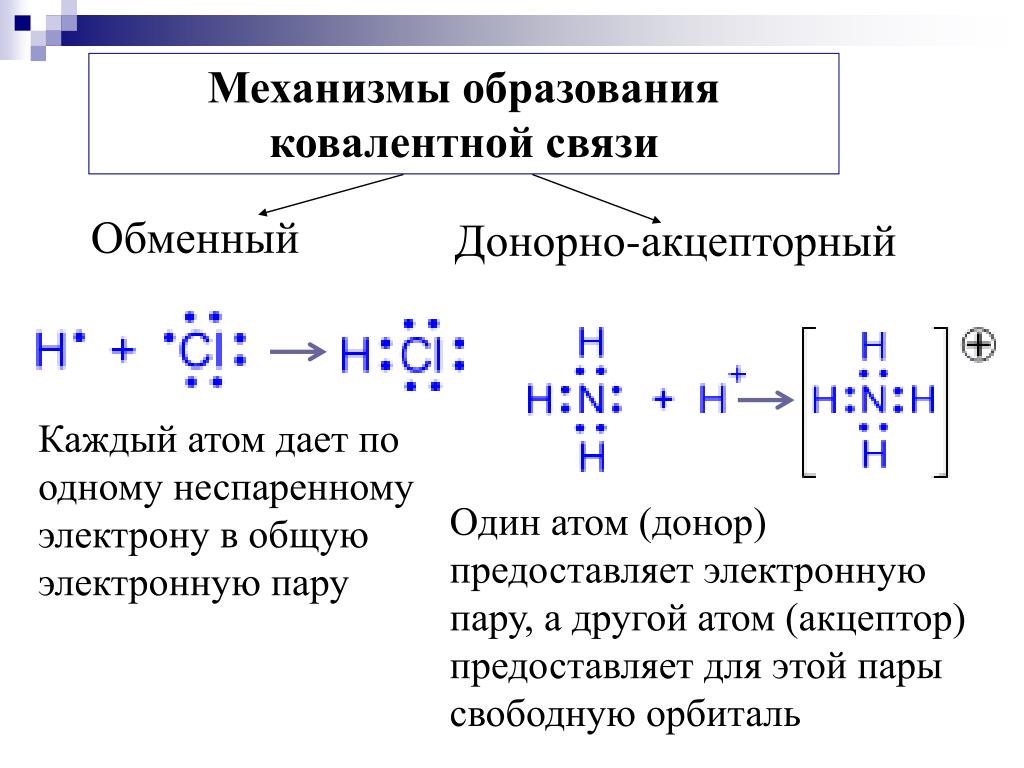
Ковалентная связь (от лат. co — «совместно» и vales — «имеющий силу») — химическая связь, образованная перекрытием (обобществлением) пары валентных (находящихся на внешней оболочке атома) электронных облаков. Общие электронные пары, образующиеся в простых веществах H2,O2,Cl2,F2,N2, в одинаковой степени принадлежат обоим атомам. Такая ковалентная связь называется неполярной. Ковалентная полярная связь образуется между атомами неметаллов в сложных веществах.
Рассмотрим образование ковалентных связей в сложных веществах.
Ковалентная неполярная связь соединяет атомы в простых веществах-неметаллах.
Длина ковалентной связи
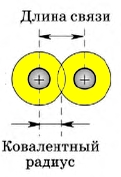
Длиной ковалентной связи называют расстояние между ядрами атомов, которые образуют связь. Длина связи напрямую связана с радиусом атома - чем он больше, тем длиннее связь.
Значения ковалентных радиусов некоторых атомов (пм; 10-12 м):
H = 30 пм;
F = 58;
O = 73;
N = 75;
C = 77;
Cl = 99;
S = 103;
P = 110;
Si = 118;
Al = 130.
В симметричных молекулах (H2, F2, Cl2...) половину длины связи называют ковалентным радиусом. Зная ковалентный радиус, очень легко вычислять длину ковалентной связи в молекуле. Например, длина ковалентной связи молекулы HF = 30 + 58 = 88 пм.
2. Энергия ковалентной связи
Под энергией ковалентной связи (выражают в ккал/моль или кДж/моль) обычно понимают энергию, которая необходима для разрыва связи (при образовании ковалентной связи энергия выделяется, при разрыве - поглощается). Чем выше энергия связи, тем прочнее связь.
Энергия связи зависит от ее длины - чем длиннее связь в молекуле, тем проще ее разорвать (затратить меньше энергии).
Энергии связи некоторых молекул (кДж/моль):
H2 = 453 (длина связи = 60 пм);
Cl2 = 242 (198 пм);
HCl = 431 (129 пм).
3. Полярность ковалентной связи
Данная характеристика отображает расположение электронной пары двух атомов, образующих связь. Степень полярности связи зависит от величины электроотрицательности атомов, образующих связь (чем она больше, тем больше полярность связи). У более полярной ковалентной связи общая пара электронов больше смещена к более электроотрицательному атому (см. понятие электроотрицательности).
Электроотрицателность является табличной величиной, определяемой по шкале Поллинга. Гораздо более важно знать не саму электроотрицательность атома как таковую, но разницу этих значений в молекуле - какой из атомов более электроотрицателен, а какой менее.
Полярность ковалентной связи оценивается количественно при помощи дипольного момента (µ), при этом система из двух равнозначных, но противоположных по знаку, зарядов, называется диполем.
Очень важно различать дипольный момент ковалентной связи (ее полярность) и дипольный момент молекулы в целом. В простых двухатомных молекулах эти два параметра равны между собой. Совсем другая картина наблюдается в сложных молекулах, в которых дипольный момент молекулы складывается из суммы векторов дипольных моментов отдельных связей.
4. Поляризуемость ковалентной связи
Поляризуемость отображает степень способности электронов смещаться под воздействием внешнего электрического поля, формируемого ионами или другими полярными молекулами.
Поляризуемость ковалентной связи прямо пропорциональна ее длине, что, в общем-то, логично - чем дальше от ядра атома находится электрон, тем он слабее им притягивается, поэтому, легче смещается при внешнем воздействии на него. Таким образом, с увеличением длины связи происходит увеличение ее поляризуемости, что, в свою очередь, приводит к возрастанию силы кислот (например, йодистоводородная кислота сильнее фтороводородной).
Поляризуемость и полярность связи являются обратнозависимыми величинами: менее полярная связь больше поляризуется, и наоборот.
5. Насыщаемость ковалентной связи
Насыщаемостью называют способность атома образовывать определенное кол-во ковалентных связей - в образовании связи стремятся принять участие все "неспаренные" электроны атома. Например, атом водорода имеет только один неспаренный электрон, а атом азота - три. По этой причине наиболее устойчивым химическим соединением будет NH3, но не NH или NH2.
6. Направленность ковалентной связи
Направленность характеризует пространственную ориентацию ковалентной связи относительно других связей молекулы. В молекулах электроны ковалентных связей и свободные пары электронов постоянно испытывают взаимное отталкивание в результате чего ковалентные связи располагаются так, что валентный угол между ними отвечает принципу наименьшего отталкивания между электронами (например, в молекуле воды валентный угол составляет 104,5°).
7. Кратность ковалентной связи
В некоторых случаях между атомами могут возникать не одна, а две (двойная связь) или три (тройная связь) общих электронных пар (так называемые кратные связи).
Двойная ковалентная связь образуется у атомов, имеющих по два неспаренных электрона; тройная - у атомов, имеющих по три неспаренных электрона (см. Множественные связи).
Как видно из таблицы, приведенной ниже, молекула азота примерно в 7 раз "крепче" молекулы фтора.
Связь химическая - связь между атомами в молекуле или соединении. Причиной хим связи считают стремление атомов к завершению внешнего уровня. Главным условием и признаком образования хим связи считают ум. Энергии и систем атомов.
Длина связи(d)- расстояние между ядрами соседних химически связанных атомов, при котором энергия системы минимальна. При увеличении кратности связи ее длина уменьшается, а энергия связи - увеличивается, при одинаковой кратности - чем меньше длина, тем больше энергия связи. Примеры длин связи в различных видах атомов углерода равна:
(С-С) - 0.154 нм = А*
(С=С) - 0.134 нм
(С≡С) - 0.120 нм
Валентный угол-угол, образованный воображаемыми линиями соединенными центры атомов в молекулах и отсчитанный в меньшую сторону. Они определяют геометрическую пространственную конфигурацию молекул. Величина валентных углов зависит от природы атомов и от характера химической связи. Например, в (CH4) -109o, в (NH3) - 107o, a в (H2O) - 105o
Энергия связи[кДж/моль] –энергия, которая выделяется при образовании связей или затрагивает на её разрыв.Чем выше энергия связи, тем связь прочнее.
8
Возбужденное состояние атомов (в.с.). Спаренные электроны валентного уровня при возбуждении могут расспариваться, и переходить на свободные атомные орбитали (АО) более высокого подуровня в пределах данного валентного уровня. Например, для бериллия в невозбужденном состоянии (н.с.) В=0, т.к. на внешнем уровне нет неспаренных электронов. В возбужденном состоянии (в.с.) спаренные электроны 2s2 занимают 2s1 и 2p1 подуровни, соответственно – В=2.
9
соединения сложного состава, у которых можно выделить центральный атом (комплексообразователь) и непосредственно связанные с ним молекулы или ионы (лиганды), называются комплексными соединениями.
По координационной теории Вернера в каждом комплексном соединении различают внутреннюю и внешнюю сферы. Внутреннюю сферу называют комплексом. При написании химических формул комплексных соединений внутреннюю сферу заключают в квадратные скобки.
Центральный атом внутренней сферы комплексного соединения, вокруг которого группируются ионы или молекулы, называется комплексообразователем. Частицы, непосредственно связанные с комплексообразователем, называются лигандами. Число лигандов в комплексе называется координационным числом комплексообразователя. Координационное число показывает число мест во внутренней сфере комплексного соединения или число мест вокруг комплексообразователя, на которых могут разместиться лиганды. Координационные числа разных комплексообразователей имеют значения от 2 до 12.
Заряд комплекса численно равен суммарному заряду внешней сферы и противоположен ему по знаку. Различают катионные, анионные и нейтральные комплексы. Комплекс с положительным зарядом называют катионным, с отрицательным зарядом — анионным, с нулевым зарядом — нейтральным.
Заряд комплексообразователя равен и противоположен по знаку алгебраической сумме зарядов всех остальных ионов.
Комплексообразователи.Способность элемента к образованию комплексных соединений относится к важнейшим его химическим свойствам. Она зависит от строения внешнего электронного уровня атома элемента и определяется его положением в периодической системе Д. И. Менделеева. Как правило, комплексообразователями являются атомы или чаще ионы металлов, имеющие достаточное число свободных орбиталей. При образовании химических связей с лигандами комплексообразователи выполняют роль акцепторов. Возможность участия тех или иных орбиталей центрального атома в комплексообразовании меняется от периода к периоду.
Способность элементов к комплексообразованию от периода к периоду растет. При последовательном переходе от одного периода к другому растет координационное число элементов.
Лиганды.Лигандами в комплексных соединениях могут служить анионы F-, ОН", CN_, SCN-, N0^, С023 ", С2ОтГ и др.; нейтральные молекулы Н20, NH3, CO, NO, F2, N2H4, NH2—СН2— —СН2—NH2 (этилендиамин) и т. д. Почти все лиганды обладают одной или несколькими неподеленными парами электронов (NH3, Н20, F, ОН"). Иногда роль лигандов играют молекулы, не содержащие неподеленных пар электронов, но имеющие электроны, участвующие в образовании л-связи. Донорные свойства лигандов реализуются за счет s- и р-атомных орбиталей, а акцепторные— за счет вакантных р- и d-орбиталей.
10
Сигма- и пи-связи (- и -связи), ковалентные химические связи, характеризующиеся определенней, но различной пространственной симметрией распределения электронной плотности. Как известно, ковалентная связь образуется в результате обобществления электронов взаимодействующих атомов.
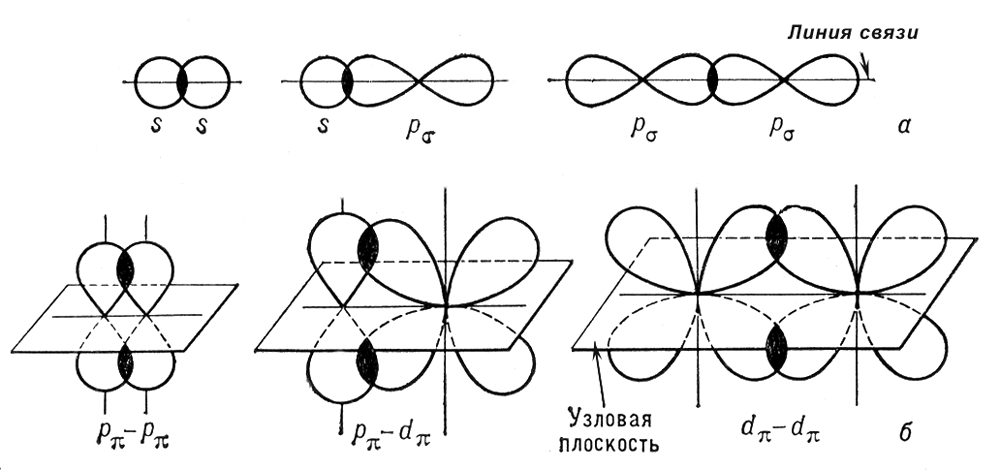
11
ионная связь объясняется следующим образом: атом - типичный металл - теряет свой валентный электрон, превращаясь в катион. Атом – типичный неметалл - принимает электрон, превращаясь в анион.
Na0 –  = Na+ (катион) = Na+ (катион)
Cl0 + 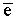 = Cl-- (анион) = Cl-- (анион)
Ионная связь является максимально полярной. Она образуется атомами тех элементов, которые имеют максимально различные электроотрицательности, т. е. ионная связь образуется щелочными и щелочно-земельными металлами и галогенами:KF; CaCl2; NaI. Ионная связь имеет два основных свойства:
· ненаправленность,
· ненасыщаемость.
Эти два свойства тесно связанны между собой. Два иона: катион и анион полностью не могут компенсировать силовые поля друг друга, поэтому для компенсации своих зарядов каждый ион вынуждает притягивать из пространства дополнительные ионы противоположного знака. В этом заключается ненасыщаемость. Так как электрическое поле иона имеет сферический характер, то для ионной связи характерна ненаправленность. Благодаря тому, что энергия ионизации больше энергии сродства к электрону, полного перехода электронов не происходит даже в случае атомов с очень большой разностью электроотрицательности. Таким образом, соединений с чисто ионной связью не существует. Можно говорить лишь о доле ионной связи. В силу особенностей ионной связи, т.е. её полярности, ненаправленности и ненасыщаемости, молекулы с ионной связью являются достаточно относительным понятием. В водных растворах и расплавах ионные молекулы полностью диссоциированы на ионы: AB=A++B-. Двух- и трёхионных соединений не существует, а весь кристалл ионного соединения можно рассматривать как молекулу, состоящую из огромного числа ионов:АmBn .
12
К особому виду межмолекулярного взаимодействия относится водородная связь, которая бывает межмолекулярной и внутримолекулярной.
Межмолекулярная водородная связь — это связь между положительно поляризованным атомом водорода одной молекулы и отрицательно поляризованным атомом другой молекулы.
Внутримолекулярная водородная связь — это связь между положительно поляризованным атомом водорода и отрицательно заряженным другим атомом одной и той же молекулы.
Химическая связь, образованная положительно поляризованным атомом водорода молекулы и электроотрицательным атомом другой или той же молекулы, называется водородной связью
13
Химическая термодинамика представляет собой научную дисциплину, которая изучает:
- переход энергии из одной формы в другую, от одной части системы к другой;
- тепловые эффекты, сопровождающие химические и физические процессы;
- возможность и направление самопроизвольного протекания процессов.
Параметры состояния, термодинамические параметры — физические величины, характеризующие состояние термодинамической системы: температура, давление, удельный объём, намагниченность, электрическая поляризация и др.
Первый закон химической термодинамики представляет собой в наиболее общем виде закон сохранения энергии для систем, в которых изменение энергии происходит в виде теплоты и работы. Для любого процесса соблюдается равенство: Q = ΔU + A.
14
Энтальпия образования вещества — энтальпия образования многоэлементного соединения из простых веществ, отнесенная к 1 моль продукта реакции ΔH°298(вещество)
Энтальпи́я, также тепловая функция и теплосодержание — термодинамический потенциал, характеризующий состояние системы в термодинамическом равновесии при выборе в качестве независимых переменных давления, энтропии и числа частиц.
Закон Гесса.В 1841 году российский ученый Г.И.Гесс открыл закон, получивший его имя. Тепловой эффект реакции зависит от природы и состояния исходных веществ и конечных продуктов, но не зависит от пути реакции, т.е. от числа и характера промежуточных стадий. Закон Гесса лежит в основе термохимических расчетов. Однако рамки его действия ограничены изобарно-изотермическими и изохорно-изотермическими процессами. Проиллюстрируем закон Гесса на примере реакции сгорания метана:СН4 + 2О2 = СО2 + 2Н2О (г),dH = - 802,34 кДж.Эту же реакцию можно провести через стадию образования СО:СН4 +3/2О2 = СО + 2Н2О (г), dH°2 = - 519,33 кДж, СО + 1/2O2 = СО2,dH°з = - 283,01 кДж,dH=dH1 + dH°3 = (- 519,33) кДж + (- 283,01) кДж = - 802,34 кДж. - тепловой эффект реакции, протекающей по двум путям, одинаков.
15
Энергия Гиббса (энергия Гельмгольца) - это часть внутренней энергии, которую система может отдать окружающей среде. Именно поэтому ее называют "свободной". В соответствии с одной из формулировок второго начала термодинамики (невозможен самопроизвольный переход теплоты от холодного тела к горячему) система может остыть лишь до некоторой конечной температуры Тк. В этих условиях система отдает среде только часть своей внутренней энергии, которую называют свободной энергией. В изобарно-изотермическом процессе она выступает в форме энергии Гиббса dG, а в изохорно-изотермическом - энергии Гельмгольца dА.
Критерии самопроизвольного протекания процессов
а) В изолированной системе самопроизвольно идут только процессы с увеличением энтропии. S > 0 - процесс возможен, S < 0 - невозможен. Когда S достигает максимума, наступает равновесие, макроскопические изменения прекращаются. Типичный пример - диффузия, которая происходит без теплового эффекта: система самопроизвольно переходит в состояние с максимальной вероятностью - молекулы, атомы, ионы перемешиваются.
б) Там, где возможен теплообмен с окружающей средой, это уже не совсем верно. Возможны экзотермические процессы с уменьшением S, например, кристаллизация жидкости, конденсация пара. Поэтому первоначально был введен критерий Бертло: самопроизвольно идут только экзотермические процессы, то есть процессы с уменьшением U или H. Этот критерий при низких температурах оправдывается часто. Действительно, потерять энергию проще, чем приобрести. Простая механическая аналогия: предмет на столе имеет большую потенциальную энергию, чем на полу, скатиться и упасть на пол он может самопроизвольно, но не может сам заскочить с пола на стол. Но все же и этот критерий не совсем верен. Возможны и эндотермические процессы, например, испарение жидкости.
16

Энтропия S – функция состояния системы. Энтропия характеризует меру неупорядоченности (хаотичности) состояния системы. Единицами измерения энтропии являются Дж/(моль·К).
Второй закон термодинамики имеет несколько формулировок. Для систем, которые не обмениваются с окружающей средой ни энергией, ни веществом (изолированные системы), второй закон термодинамики имеет следующую формулировку: в изолированных системах самопроизвольно идут только такие процессы, которые сопровождаются возрастанием энтропии:. ∆S> 0. Второй закон термодинамики имеет статистический характер, т.е. справедлив лишь для систем, состоящих из очень большого числа частиц. |
|
|
 Скачать 0.58 Mb.
Скачать 0.58 Mb.





