Спс. Контрольная работа 1 химия. 1. Напишите электронную формулу атома селена Se. Нарисуйте размещение электронов двух последних уровней в квантовых ячейках в нормальном и возбужденном состояниях
 Скачать 34.37 Kb. Скачать 34.37 Kb.
|
|
Контрольная работа 1 Вариант 1 1. Напишите электронную формулу атома селена Se. Нарисуйте размещение электронов двух последних уровней в квантовых ячейках в нормальном и возбужденном состояниях. Определите по этим рисункам возможные устойчивые степени окисления в нормальном (н) и возбужденном (в) состояниях. 1) н: +2; в: +4, +6 2) н: +2; в: –4, –6 3) н: –2; в: +4 4) н: –2; в: +6 5) н: –2; в: +4, +6 Сколько граммов хлорида натрия необходимо растворить в 600 г воды для получения 4% раствора? 3. Для какой из приведенных ниже реакций изменение энтальпии соответствует стандартной энтальпии образования BaSO4 (К) ? 1) Ba(NO3)2 (Ж) + H2SO4 (Ж) = BaSO4 (K) + 2HNO3 (Ж) 2) BaO (K) + SO3 (Г) = BaSO4 (K) 3) Ba (K) + S (K) + 4O (Г) = BaSO4 (K) 4) Ba (K) + S (K) + 2O2 (Г) = BaSO4 (K) 5) Ba (K) + H2SO4 (Ж) = BaSO4 (K) + H2 (Г) 4. Во сколько раз возрастет скорость химического процесса при повышении температуры на 300, если температурный коэффициент скорости реакции равен 2? Ответы: 1) 60; 2) 8; 3) 15; 4) 6; 5) 30. 5. Равновесие реакции 2H2O (г)↔ О2 (г) + 2Н2 (г) установилось при концентрациях (моль/л): Н2О = 0,4; О2 = 0,2; Н2 = 0,1. Вычислить константу равновесия.
6. Указать выражение константы диссоциации H2SO3 по I-й ступени: 1) 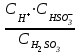 ; 2) ; 2) 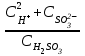 ; 3) ; 3) 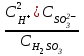 ; ;4) 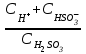 ; 5) ; 5) 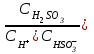 Вариант 2 1. Определить, в каком периоде, группе и подгруппе (главной А или побочной В) находится элемент, имеющий электронную структуру …4d55s2. К какому электронному семейству он относится? 1) 4; VII А; d 2) 5; VI А; s 3) 5; VI В; d 4) 5; VII В; d 5) 5; VII В; s Сколько грамм сульфата калия и какой объем воды необходимо взять для приготовления 400 г 8% раствора? Определите изменение энтальпии (в кДж) в реакции 2FeO (К) + C (графит) = 2Fe (K) + CO2 (Г) Является ли данная реакция эндотермической?
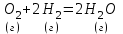 при увеличении концентрации H2 в 3 раза? Ответы: 1) 6; 2) 3; 3) 9; 4) 12; 5) 4. 5. Для процесса C (графит) + 2Н2 (г) ↔ СН4 (г) при Т = 1216 К константа равновесия равна 0,1. Найти ΔG данной реакции и указать, возможна ли она.
Исходя из значений ПР, указать наиболее растворимое в воде соединение ртути: Hg2(OH)2; 2) Hg2I2; 3) Hg2Br2; 4) Hg2(CN)2; 5) Hg2Cl2 . Вариант 3 1. Исходя из положения приведенных элементов в периодической системе, указать, какой из них имеет наименьшую энергию сродства к электрону.
Сколько мл воды необходимо прилить к 350 мл 20% серной кислоты (ρ=1,139 г/см3) чтобы концентрация раствора стала 4%? 3. Определите изменение энергии Гиббса в вышеуказанном процессе (в кДж). Возможно ли самопроизвольное протекание процесса при стандартных условиях?
4.Скорость реакции 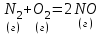 при при 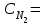 1 моль/л 1 моль/л 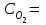 3 моль/л равна 0,15. Вычислить константу скорости реакции. 3 моль/л равна 0,15. Вычислить константу скорости реакции.Ответы: 1) 0,050; 2) 0,150; 3) 0,450; 4) 0,600; 5) 0,075. 5.Во сколько раз повысится скорость прямой реакции и обратной при повышении давления в 4 раза в системе N2 (г) + O2 (г) ↔ 2NO (г) , в какую сторону при этом сместится равновесие системы?
6. Какое из молекулярных уравнений реакции можно выразить следующим сокращенным ионным уравнением: NH4+ + OH- = NH4OH ? 2 NH4NO3 + Zn(OH)2 = 2 NH4OH + Zn(NO3)2 ; 3 (NH4)2SO3 + 2 Al(OH)3 = 6 NH4OH + Zn(NO3)2 ; NH4Cl + KOH = NH4OH + KCl ; 2 (NH4)3PO4 + 3 Ca(OH)2 = 6 NH4OH + Ca3(PO4)2 ; (NH4)2SO4 + Ba(OH)2 = 2 NH4OH + BaSO4 . Вариант 4 1.На основании распределения d-электронов в квантовых ячейках определите максимальное значение суммарного спинового квантового числа d-электронов атома титана Ti. Чему равно значение главного квантового числа для этих электронов?
2.Сколько граммов сульфата алюминия необходимо взять для приготовления 500 мл 0,5М раствора? 3.Определите изменение энтропии в том же процессе ( Дж/К).
4. Во сколько раз возрастет скорость реакции  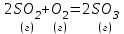 при увеличении давления в системе в 2 раза? Ответы: 1) 16,0; 2) 4,0; 3) 2,0; 4) 8,0; 5) 0,5. 5.В какую сторону сместится равновесие системы 2H2S (г) ↔ 2Н2 (г) +S2 (г) (ΔH > 0) при понижении температуры?
6. К каждому из электролитов прилили раствор сульфида натрия. В каком случае реакция обмена в растворе не идет до конца ? 1.CuSO4 + Na2S → 2.CaCl2 + Na2S → 3.ZnSO4 + Na2S → 4.FeSO4 + Na2S → 5.Zn(NO3)2 + Na2S → Написать уравнение реакции. |
