Классы соединений. классы соединений. 1. Назвать следующие оксиды TiO
 Скачать 24.09 Kb. Скачать 24.09 Kb.
|
|
1). Назвать следующие оксиды: TiO2; TiO; P2O3; Tc2O7 TiO2– оксид титана (IV) TiO – оксид титана (II) P2O3 – оксид фосфора (III) Tc2O7– оксид технеция (VII) Написать формулы соответствующих им гидроксидов (оснований, кислот): TiO2– H4TiO4 TiO – 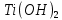 P2O3 – 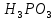 Tc2O7– 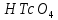 Определить характер оксида (основный, кислотный или амфотерный): TiO2– амфотерный TiO – основный P2O3 – кислотный Tc2O7–кислотный Какие из этих оксидов способны взаимодействовать с водой? TiO2–с водой непосредственно не взаимодействует; TiO – с водой непосредственно не взаимодействует; P2O3 – с водой реагирует проявляя кислотные свойства; Tc2O7– с водой реагирует проявляя кислотные свойства; Написать уравнения реакций: Р2О3 + 3Н2О 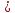 2Н3РО3 2Н3РО3Tc 2О7 + Н2О 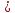 2НТсО4 2НТсО42). Назвать приведенные ниже кислоты: H2SnO2 - оловянистая кислота; H2SnO3 – метаоловянная кислота; H4SnO4 – ортооловянная кислота; Написать уравнения ступенчатой диссоциации H2SnO3: 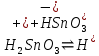 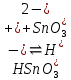 Подчеркнуть все кислотные остатки и назвать их: 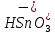 - гидростаннат анион - гидростаннат анион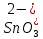 - станнат анион - станнат анион3). Написать формулы гидроксидов: калия, магния, железа (III): КОН – гидроксид калия; 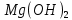 - гидроксид магния; - гидроксид магния;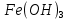 – гидроксид железа (III). – гидроксид железа (III).Показать, как они диссоциируют. Подчеркнуть все катионы и назвать их. KOH ⇄ 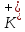 + + 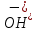 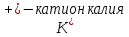 ; ;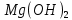 ⇄ ⇄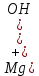 + OH¯ + OH¯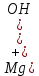 ⇄ ⇄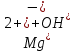 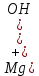 - катион гидроксомагния; - катион гидроксомагния;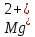 катион магния; катион магния;Fe 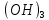 ⇄ Fe ⇄ Fe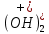 + OH¯ + OH¯Fe 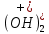 ⇄ ⇄ 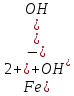 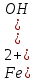 ⇄ ⇄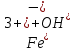 Fe 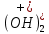 -катион дигидроксожелеза (III); -катион дигидроксожелеза (III);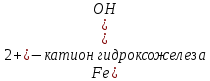 (III); (III);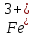 - катион железа (III); - катион железа (III);Написать уравнения всех возможных реакций, протекающих между вторым из приведенных здесь гидроксидов и соляной кислотой. 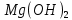 + 2HCl = 2 + 2HCl = 2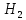 O + Mg O + Mg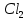 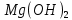 + HCl = H2O + Mg(OH)Cl + HCl = H2O + Mg(OH)Cl4). Назвать следующие соли: Zn(NO3)2; NaH2AsO4; Al(ОH)2NO3. Zn(NO3)2 -нитрат цинка; NaH2AsO4-дигидроарсенат натрия; Al(ОH)2NO3 –дигидроксонитрат алюминия; Показать, как они диссоциируют: Zn(NO3)2⇄ 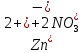 NaH2AsO4⇄ 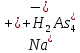 Al(ОH)2NO3⇄ 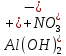 Написать уравнения реакций между кислотой и основанием, приводящие к образованию каждой соли. Zn( 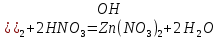 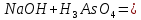 NaH2AsO4+ NaH2AsO4+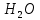 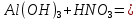 Al(ОH)2NO3+ Al(ОH)2NO3+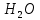 5). Получить сульфат магния, исходя из: а) магния: 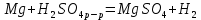 б) оксида магния: MgO+ 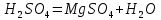 в). гидроксида магния: Mg( 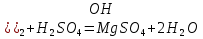 г). карбоната магния: 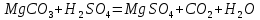 6). Как измениться скорость реакции 2NO(г)+Cl2(г)→2NOCl(г)., если: повысить общее давление в системе в 2 раза? Согласно кинетическому уравнению V=k∙[NO]² ∙ [Сl2] При увеличении давления в 2 раза (т.е. уменьшении объема в 2 раза), конц-и обоих исх. в-в увел. в 2 раза, получим: V=k∙[2NO]² ∙ [2Сl2] = k∙2³∙[NO]² ∙ [Сl2] = 8 [NO]² ∙ [Сl2] т.е. скорость реакции увеличится в 8 раз. 7). Температурный коэффициент скорости реакции равен 3. Как измениться скорость реакции при повышении температуры от 800С до 1800С. Воспользуемся математическим выражением правила Вант-Гоффа: 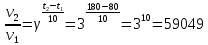 Скорость реакции увеличится в 59049 раз. 8). Какими способами можно сместить вправо равновесие в системе: 2NO(г)+O2(г)↔2NO2(г)+Q Повысить давление, так как согласно принципу Ле-Шателье химическое равновесие смещается в сторону меньшего объема. (3 объема против 2) Понизить температуру так как при уменьшении температуры, система будет «сопротивляться», отдавая тепло. То есть увеличится скорость прямой реакции и равновесие сместится в сторону экзотермической реакции. В рассматриваемом случае экзотермическая реакция прямая. Увеличить концентрацию NO - при наступлении химического равновесия скорости прямой и обратной реакций становятся равны. При увеличении концентрации газообразного NO в системе, возрастет и его равновесная молярная концентрация, и, следовательно, увеличится скорость прямой реакции пр, скорость же обратной реакции останется неизменной. В таком случае равновесие сдвигается вправо или в сторону прямой реакции. Увеличить концентрацию 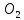 - при наступлении химического равновесия скорости прямой и обратной реакций становятся равны. При увеличении концентрации газообразного - при наступлении химического равновесия скорости прямой и обратной реакций становятся равны. При увеличении концентрации газообразного 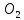 в системе, возрастет и его равновесная молярная концентрация, и, следовательно, увеличится скорость прямой реакции пр, скорость же обратной реакции останется неизменной. В таком случае равновесие сдвигается вправо или в сторону прямой реакции. в системе, возрастет и его равновесная молярная концентрация, и, следовательно, увеличится скорость прямой реакции пр, скорость же обратной реакции останется неизменной. В таком случае равновесие сдвигается вправо или в сторону прямой реакции.9). Термодинамическое уравнения разложения карбоната кальция имеет вид: СаСО3 =СаО+СО2 –177кДж. Определить, какое количество теплоты затратится на разложение 1кг известняка. для разложения 1 моль Са 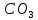 требуется 177 кДж; требуется 177 кДж;Определим количество вещества карбоната кальция: n( 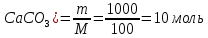 Определим количество теплоты которое необходимо затратить для разложения 10 моль Са 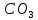 : :Q=177  10=1770 кДж 10=1770 кДж |
