химия. мед. химия. 1 Окислительновосстановительное
 Скачать 0.57 Mb. Скачать 0.57 Mb.
|
|
1)Окислительно-восстановительное титрование основано на взаимодействии определяемого вещества со стандартным (рабочим) раствором окислителя или восстановителя. Так же как и в других титриметрических методах анализа, количественное определение анализируемого компонента осуществляется путем точного изме-рения объемов растворов, вступающих между собой в химиче-скую реакцию.  2) Мгновенный ответ Оксидиметрия это метод объемного анализа, в основе которого лежат окислительно-восстановительные реакции. При помощи титрованных растворов окислителей определяют количественное содержание восстановителей и наоборот. Оксидиметрия подразделяется на ряд методов: перманганатометрию, йодометрию, хроматометрию, броматометрию  3) Окислительно-восстановительные реакции (ОВР) — это реакции, в которых происходит изменение степеней окисления атомов элементов. В овр происходит переход электронов от одних атомов к другим, одновременно протекают два противоположных процесса: окисление и восстановление. Окисление — процесс отдачи электронов. Восстановление — процесс принятия электронов. 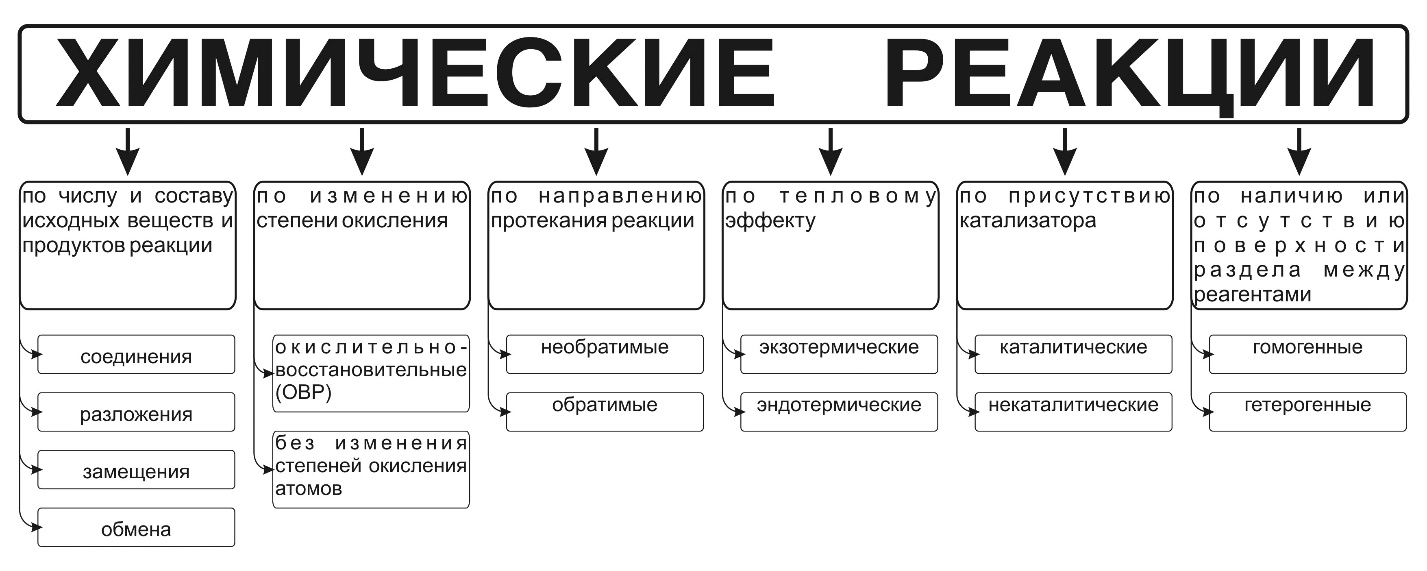 4)  6) Необходимо помнить, что процесс окисления всегда сопровождается процессом восстановления, и наоборот. Поясним понятия, связанные с окислительно-восстановительными процессами, на конкретном примере, а именно на примере реакции взаимодействия железа с раствором сульфата меди(II): Fe+Cu(SO4)2Fe(SO4)2+Cu Fe-2eFe+2 процесс окисления(Fe 0 – восстановитель) Сu+2+2eCu0 процесс восстановления(Cu+2 – окислитель) 7) Степень окисления атома равна численной величине электрического заряда, приписываемого атому в предположении, что электронные пары, осуществляющие связь, полностью смещены в сторону более электроотрицательных атомов (то есть исходя из предположения, что соединение состоит только из ионов). В случае ковалентной связи между одинаковыми атомами электроны делят поровну между атомами. 8)Процесс отдачи электронов называется окислением. В результате процесса окисления степень окисления элемента повышается. Процесс присоединения электронов называется восстановлением. В результате процесса восстановления степень окисления понижается. 9) Важнейшие восстановители: металлы; водород H2; уголь C; оксид углерода(II) CO; сероводород H2S, сульфиды K2S; галогеноводороды HI, HBr; аммиак NH3. Важнейшие окислители: галогены F2, Cl2; кислород O2, озон O3; соединения марганца KMnO4; азотная кислота HNO3 и её соли KNO3; концентрированная серная кислота H2SO4; ионы металлов. В лечебной практике широко используется электрофорез, основан-ный на переносе лекарственных веществ с поверхности кожи в глубоколе-жащие ткани с помощью гальванического тока.  11) Электро́дный потенциа́л — ЭДС элемента, составленного из данного электрода и стандартного водородного электрода, электродный потенциал которого принят равным нулю. При этом знак электродного потенциала считают положительным, если в таком гальваническом элементе испытуемый электрод является катодом, и отрицательным, если испытуемый электрод является анодом. Стандартный электродный потенциал — это потенциал металла, определенный относительно стандартного (нормального) водородного электрода, при условии, что концентрация ионов водорода Н+ и ионов испытуемого металла Me n+ равны 1 моль-ион/л при стандартных условиях (298К, 101кП). |
