Лекция метаболизм аминокислот. 1. Пути превращения аммиачного азота
 Скачать 132.5 Kb. Скачать 132.5 Kb.
|
|
Лекция Обмен азотистых соединений 1.Пути превращения аммиачного азота. 2.Пути синтеза аминокислот (прямое аминирование и переаминирование). 3.Пути превращения аминокислот (дезаминирование, декарбоксилирование). 4.Орнитиновый цикл. 1.Пути превращения аммиачного азота. Человек и животные не способны усваивать минеральные соединения азота, не могут синтезировать некоторые аминокислоты. Эти аминокислоты поступают обычно с пищей (кормом). В отличие от животных, растительные организмы способны синтезировать все необходимые им азотистые соединения из аммиака, который поступил из почвы или образовался в результате восстановления нитратов, распада белков, других реакций. Основной путь превращения аммиачного азота в органические соединения – это синтез аминокислот. Исходным веществом для синтеза органических соединений является аммиак, и в растительных тканях усвоенные из почвы нитраты быстро восстанавливаются до аммиака. Схематически процесс восстановления нитратов до аммиака можно выразить так: H  NO3 + 8 H+ + 8 е NH3 + 3 H2O, NO3 + 8 H+ + 8 е NH3 + 3 H2O,То есть для восстановления молекулы HNO3 до уровня аммиака требуется 8 протонов и 8 электронов. Этот процесс, как и большинство других биохимических процессов, идет ступенчато, через ряд промежуточных соединений и катализируется несколькими ферментами. В настоящее время процесс восстановления нитратов представляется в следующем виде. На первой стадии нитраты под действием нитратредуктазы восстанавливаются до нитритов. Донором протонов и электронов является НАДФ*Н2 (или НАД*Н2). Это сложная реакция, в ней участвует в качестве промежуточного переносчика водорода флавиновый фермент, для проявления активности которого необходим молибден, а также другие вещества и кофакторы. Схематически действие нитратредуктазы изображается так: H  NO3 + НАДФ*H2 НNО2 + H2O. NO3 + НАДФ*H2 НNО2 + H2O.Механизм восстановления нитратов под действием нитратредуктазы:  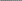   2Н+ 2Н+ НАД*Н2 или НАДФ* Н2 ФАД Мо5+ + 2 е NO3– НАД или НАДФ ФАД*Н2 МО6+ NO2– +Н2О Согласно этой схеме, для восстановления нитратов необходимо 2 протона и 2 электрона, которые доставляются восстановленными формами НАД*Н2 или НАДФ* Н2 и передаются на флавиновый фермент. Последний восстанавливается, а НАД или НАДФ переходят в окисленное состояние. На следующем этапе промежуточным переносчиком электронов служит молибден. Две молекулы МО6+ принимают два электрона от ФАД*Н2 и передают их на NO3– . После присоединения электронов NO3– переходит в NO2– , а из протонов и кислорода образуется молекула воды. Затем нитрат восстанавливается до гипонитрита. Эта реакция катализируется нитритредуктазой, которая также представляет собой металлофлавопротеид. Донором протонов и электронов является восстановленный НАД*Н2 (НАДФ* Н2), в реакции также принимают участие флавиновые ферменты, для активации которых необходимы железо, медь и магний: 2  НNО2 + 2 НАД*Н2 Н2N2О2 + 2 Н2О + 2 НАД НNО2 + 2 НАД*Н2 Н2N2О2 + 2 Н2О + 2 НАДНа следующем этапе происходит присоединение еще двух атомов водорода и образование гидроксиламина (NH2OH). Фермент, катализирующий эту реакцию, называется гипонитритредуктазой. Он представляет собой флавопротеид, для активирования которого требуется медь, железо, марганец, а донором протонов и электронов является НАД*Н2.  Н2N2О2 + 2 НАД*Н2 2 NН2ОН + 2 НАД. Н2N2О2 + 2 НАД*Н2 2 NН2ОН + 2 НАД.На последнем этапе под действием гидроксиламинредуктазы из гидроксиламина образуется аммиак. Здесь также участвуют флафопротеиды, содержащие магний и марганец, а донором водорода является НАД* Н2 : N  Н2ОН + НАД*Н2 NН3 + Н2О+ НАД. Н2ОН + НАД*Н2 NН3 + Н2О+ НАД.Таким образом, общая схема восстановления нитратов представляется в виде: MO CU, Fe, Mg CU, Fe, Mn Mn, Mg N     О3 NО2 N2О2 NН2ОН NН3 О3 NО2 N2О2 NН2ОН NН3 Следует отметить, что ферменты нитратвосстанавливающей системы представляют собой так называемые индуцированные ферменты, т.е. они довольно интенсивно образуются в растениях после поступления в растения большого количества нитратов или продуктов их восстановления. Для восстановления нитратов до аммиака необходимы 8 протонов и 8 электронов, которые доставляются восстановленными НАД*Н2 или НАДФ*Н2 . Нитраты довольно быстро восстанавливаются в растениях, и иногда их восстановление заканчивается в корневой системе. Накопление повышенного количества нитратов в надземных органах растений бывает сравнительно редко, лишь при неблагоприятных условиях выращивания растений или при избыточных дозах нитратных удобрений. Для восстановления нитратов необходимы фосфор, магний, молибден и другие элементы. Интенсивность восстановления нитратов связана с двумя основными процессами, в результате которых выделяется энергия, – дыханием и фотосинтезом. Если растения обеспечены достаточным количеством углеводов, нитраты восстанавливаются в основном в корневой системе при участии НАД*Н2 или НАДФ*Н2 , образующихся при распаде углеводов через цикл ди- и трикарбоновых кислот. Если же интенсивность фотосинтеза ослаблена и растения испытывают некоторый недостаток углеводов, часть нитратов не успевает восстанавливаться в корнях и поступает в надземные органы, где восстанавливается при участии никотинадениндинуклеотидов, образующихся при фотосинтезе. 2. Пути синтеза аминокислот (прямое аминирование и переаминирование). Еще сравнительно недавно считали, что биосинтез аминокислот может происходить только в надземных частях растений. Однако последующие исследования показали, что новообразование аминокислот может происходить и в подземных органах растений. При нормальных условиях развития главным путем превращения аммиака в органические соединения азота является образование аминокислот. В результате биосинтеза аминокислот было выяснено, что аммиак чаще всего реагирует с кетокислотами. Эта реакция прямого аминирования кетокислот аммиаком – основной путь синтеза аминокислот в растениях. Реакция синтеза аминокислот идет в две фазы: NH  1) R–COCOOH + NH3 R–C + H2O 1) R–COCOOH + NH3 R–C + H2Oкетокислота СООН иминокислота NH  2) R–C + 2 Н R–CНNH2СООН 2) R–C + 2 Н R–CНNH2СООНСООН иминокислота НАДФ*Н2 НАДФ аминокислота На 1-й фазе кетокислота, присоединяя аммиак, образует иминокислоту. На 2-й фазе иминокислота восстанавливается и дает аминокислоту. Эта реакция идет под действием какого-либо восстанавливающего агента, например НАДФ*Н2 или НАД*Н2. Следовательно, для первичного синтеза аминокислот необходимы аммиак и кетокислоты. Основными процессами, которые приводят к образованию кетокислот, являются цикл Кребса и реакции анаэробного распада углеводов. Прямое аминирование кетокислот аммиаком – первая и наиболее важная реакция биосинтеза аминокислот. В процессе восстановительного аминирования наиболее активен фермент глутаматдегидрогеназа, который катализирует реакцию синтеза глутаминовой кислоты: С  ООНСН2СН2СОСООН + NН3 + 2Н СООНСН2СН2СНNН2СООН + Н2О ООНСН2СН2СОСООН + NН3 + 2Н СООНСН2СН2СНNН2СООН + Н2О-кетоглутаровая глутаминовая кислота кислота Глутаматдегидрогеназа в качестве активной группы содержит НАД и НАДФ, она может с разной скоростью катализировать восстановительное аминирование -кетоглутаровой, пировиноградной, -кетомасляной, -кетовалериановой, -кетокапроновой и некоторых других кислот. Из растений были выделены и другие ферментные препараты, которые катализируют реакции прямого аминирования кетокислот аммиаком. Все они относятся к дегидрогеназам, и для их действия необходимы НАД*Н2 или НАДФ*Н2. Аспарагиновая кислота может образоваться также при прямом присоединении аммиака к фумаровой кислоте. Реакция катализируется ферментом аспаратаммиаклиазой:  СООНСН=СНСООН+ NН3 СООНСН2СНNН2СООН СООНСН=СНСООН+ NН3 СООНСН2СНNН2СООНАммиак является ядом для растений, и при накоплении большого количества его может наблюдаться отравление тканей растений. Поэтому организмы вынуждены его обезвреживать. Одна из основных реакций, приводящих к связыванию аммиака, – использование его для синтеза аминокислот. Но аммиака, как правило, больше, чем требуется для синтеза аминокислот. Избыточный аммиак обезвреживается при образовании амидов – аспарагина и глутамина. Исходными веществами для биосинтеза глутамина и аспарагина являются соответственно глутаминовая и аспарагиновая кислоты. Синтез глутамина идет при участии АТФ и катализируется ферментом глутаминсинтетазой, которая широко распространена в тканях растений, грибов, бактерий и животных: СООН СОNН2 СН2 СН2  СН2 + NН3 + АТФ СН2 + АДФ + Н3РО4 СН2 + NН3 + АТФ СН2 + АДФ + Н3РО4 СНNН2 СНNН2 СООН СООН
Энергия в этой реакции необходима для биосинтеза амидной связи. Биосинтез глутамина – довольно сложный процесс. Он состоит из четырех, а может быть, и более реакций. Детали этого процесса и промежуточные продукты еще не выяснены. Аналогичным путем происходит синтез аспарагина под действием аспарагинсинтетазы: С  ООНСН2СНNН2СООН+NН3+АТФ СОNН2СН2СНNН2СООН + АДФ + Н3РО4 ООНСН2СНNН2СООН+NН3+АТФ СОNН2СН2СНNН2СООН + АДФ + Н3РО4
Более просто обезвреживается аммиак в растениях с кислым клеточным соком и высоким содержанием яблочной, щавелевой, лимонной и других кислот (бегония, щавель). У этих растений аммиак обезвреживается главным образом его связыванием в виде аммонийных солей органических кислот: С  ООНСНОНСН2СООН + NН3 СООНСНОНСН2СООNН4 ООНСНОНСН2СООН + NН3 СООНСНОНСН2СООNН4
СООН СООNН4  + NН3 + NН3 СООН СООН
Синтез аминокислот путем прямого аминирования кетокислот аммиаком возможен лишь для ограниченного числа аминокислот, у которых в растениях имеются кетоаналоги. Образование большинства других кетокислот происходит либо в результате реакции переаминирования, либо в результате взаимных превращений аминокислот. Переаминирование. Реакция переаминирования впервые была открыта советским исследователем А.Е. Браунштейном в 1938 году. Он наблюдал перенос аминогрупп от аминокислот на кетокислоты. Позднее было показано, что в растениях наиболее легко подвергаются переаминированию глутаминовая и аспарагиновая кислоты, что подтверждало представления об их центральной роли в процессах обмена веществ. Д.Н. Прянишников писал в 1945 году: «...благодаря легкости образования аспарагиновой и глутаминовой кислот из соответствующих кетокислот и их способности к переаминированию можно сказать, что дикарбоновые моноаминокислоты являются как бы большими воротами на пути, ведущем к синтезу других аминокислот, а следовательно, и белков». К настоящему времени изучено очень большое число реакций переаминирования, приводящих к образованию различных аминокислот. Только в растениях в результате переаминирования может синтезироваться до 30 аминокислот, а всего известно около 100 реакций переаминирования. В процессе обмена веществ наибольшее значение имеют следующие реакции переаминирования: глутаминовая кислота + щавелево-уксусная кислота -кетоглутаровая кислота + аспарагиновая кислота глутаминовая кислота + пировиноградная кислота -кетоглутаровая кислота + аланин аспарагиновая кислота + пировиноградная кислота щавелево-уксусная кислота + аланин Реакции переаминирования катализируются аминотрансферазами, которые представляют собой двухкомпонентные ферменты. Их активной группой является фосфорилированное производное пиридоксина (витамин В6) – пиридоксальфосфат (сокращенно ПЛФ). В процессе переаминирования возникает комплексное соединение реагирующей аминокислоты с пиридоксальфосфатом. Затем этот комплекс распадается, и образуются пиридоксаминфосфат (ПМФ) и соответствующая кетокислота. На 2-й стадии реакции ПМФ реагирует с другой кетокислотой, в результате чего синтезируется новая аминокислота, и освобождается свободной пиридоксальфосфат: ПЛФ + аминокислота I ПМФ + кетокислота I ПМФ + кетокислота II ПЛФ + аминокислота II 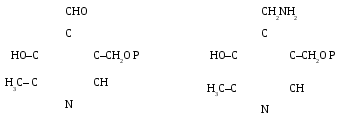
В настоящее время принята теория механизма действия аминотрансфераз, разработанная А.Е. Браунштейном и М.М. Шемякиным. В соответствии с этой теорией механизм реакции переаминирования может быть изображен следующим образом. На 1-й стадии аминокислота I, реагируя с аминотрансферазой, которая представляет собой комплекс пиридоксальфосфата со специфическим белком, образует с выделением воды соединение аминокислоты с ферментом: 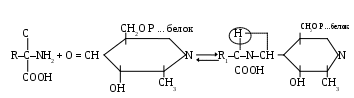
В комплексном соединении такого типа понижена электронная плотность у -углеродного атома, соответствующего остатку аминокислоты, вследствие чего водород легко подвергается диссоциации, и это соединение переходит в свою таутомерную форму с соответствующей перегруппировкой двойных связей. Затем эта таутомерная форма комплекса аминокислоты с аминотрансферазой подвергается гидролизу, в результате чего образуется кетокислота I, соответствующая исходной аминокислоте, а аминогруппа переносится на аминотрансферазу: 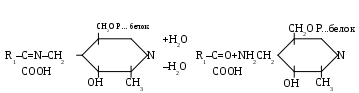
На следующем этапе происходит взаимодействие фосфопиридоксаминной формы аминотрансферазы с другой кетокислотой II, образование соответствующего комплекса, затем происходит распад этого комплекса с переносом аминогруппы на кетокислоту II и образование аминокислоты II и исходной фосфопиридоксалевой формы аминотрансферазы: а  минотрансфераза–ПМФ+кетокислота II аминотрансфераза–ПЛФ+аминокислота II минотрансфераза–ПМФ+кетокислота II аминотрансфераза–ПЛФ+аминокислота IIВ результате реакций переаминирования синтезируются самые разнообразные аминокилоты. С этими реакциями связаны многие процессы обмена веществ в организмах. 3.Пути превращения аминокислот (дезаминирование, декарбоксилирование). Аминокислоты, образовавшиеся в растениях при восстановительном аминировании, переаминировании или другим путем, подвергаются непрерывному обмену. В основном, они используются для синтеза белков, но могут претерпевать и другие превращения – декарбоксилироваться, использоваться для синтеза азотистых оснований и других соединений, отщеплять аминогруппу, полностью окисляться и служить источником энергии для организмов. Дезаминирование аминокислот – распад на аммиак и соответствующие кислоты – является основной реакцией превращения азотистых веществ в безазотистые соединения, которые могут подвергаться дальнейшему обмену. Дезаминирование аминокислот может происходить 3 основными путями: Восстановительное дезаминирование, в котором образуется соответствующая кислота и аммиак: + 2 Н R  CHCOOH RCH2COOH + NH3. CHCOOH RCH2COOH + NH3.NH2 HAД*Н2 НАД 2. Гидролитическое дезаминирование, приводящее к образованию оксикислоты и аммиака: +Н2О R  CHCOOH RCHОНCOOH + NH3. CHCOOH RCHОНCOOH + NH3.NH2 3. Окислительное дезаминирование, когда образуется кетокислота и аммиак: +1\2 О2 R  CHCOOH RCОCOOH+ NH3. CHCOOH RCОCOOH+ NH3.NH2 Аминокислоты наиболее часто распадаются в результате окислительного дезаминирования. Реакция идет в две стадии. На первой стадии аминокислота дегидрируется и превращается в соответствующую иминокислоту: –2Н R  CHCOOH RCCOOH. CHCOOH RCCOOH.NH2 NH ФАД ФАД*Н2 На второй стадии к иминокислоте присоединяется вода и отщепляется аммиак: +Н2О R  CHCOOH RCCOOH+ NH3. CHCOOH RCCOOH+ NH3.NH Реакции окислительного дезаминирования катализируются ферментами, которые получили название оксидаз аминокислот. Декарбоксилирование аминокислот. При декарбоксилировании аминокислот от аминокислоты отщепляется СО2. Если декарбоксилированию подвергается дикарбоновая кислота, то в результате реакции возникает соответствующая монокарбоновая кислота: –СО2 С  ООНСН2СН2СНNН2СООН СООНСН2СН2СН2NН2 ООНСН2СН2СНNН2СООН СООНСН2СН2СН2NН2
При декарбоксилировании монокарбоновых аминокислот образуются соответствующие амины: –CO2 R  CHNH2COOH RCH2NH2 CHNH2COOH RCH2NH2Реакции, приводящие к образованию аминов, катализируются специфичными ферментами – декарбоксилазами аминокислот. Амины могут накапливаться только при некоторых неблагоприятных условиях развития. Обычно они подвергаются дальнейшим превращениям. Основной путь превращения аминов – их окисление. Окисление моноаминов катализируется монооксидазами. Продуктами реакции являются соответствующий альдегид и аммиак: +Н2О2 + О2 O R  CH2NH2 RC + NH3 + H2O2 CH2NH2 RC + NH3 + H2O2H Окисление диаминов катализируется диаминооксидазами с образованием аминоальдегидов и аммиака: +Н2О2 + О2 O N  H2CH2RCH2NH2 NH2CH2RC + NH3 + H2O2 H2CH2RCH2NH2 NH2CH2RC + NH3 + H2O2H Альдегиды могут окисляться дальше в соответствующие кислоты. Из аминов в растениях синтезируются различные гетероциклические соединения, в частности алкалоиды. 4.Орнитиновый цикл. Из аминокислот, поступающих с белками в пищу, в организме синтезируются белковые вещества различных органов и тканей. В процессе жизнедеятельности клеток и тканей белки распадаются, и образовавшиеся аминокислоты также претерпевают распад. Аминокислоты могут окисляться до конечных продуктов – мочевины, аммонийных солей, углекислого газа, серной и фосфорной кислот и воды. Конечным продуктом распада простых белков является мочевина. Процесс образования мочевины происходит через орнитиновый цикл: 1 карбомилфосфатсинтетаза ) О N  H3 + CO2 + АТФ NH2–C–OPO3H2 + АДФ H3 + CO2 + АТФ NH2–C–OPO3H2 + АДФ
2 орнитинкарбомилтрансфераза ) СН2NН2 NН2  NН2–С–О– PO3H2 + (СН2)2 С=О NН2–С–О– PO3H2 + (СН2)2 С=ОО СНNН2 NН + Н3РО4 СООН (СН2)3 СНNН2 СООН
3) NН2 СООН NН2 СООН аргининсукцинатсин-тетаза С=О СН2  NН + + АТФ АДФ + Н3РО4 + С=N–СН NН + + АТФ АДФ + Н3РО4 + С=N–СНСНNН2 NН СН2 (СН2)3 СООН СНNН2 (СН2)3 СООН СООН СНNН2 СООН
4 аргининсукцинатлиаза ) NН2 А  ргинин-янтарная кислота С=NН СООН ргинин-янтарная кислота С=NН СООНNН СН (СН2)3 + СН СНNН2 СООН СООН
5) NН2 NН2 NН2 аргиназа С=NН (СН2)2  NН + Н2О + С=О NН + Н2О + С=О(СН2)3 СНNН2 СНNН2 СООН NН2 СООН
Фумаровая кислота может вновь присоединять молекулу аммиака и превращаться в аспарагиновую кислоту, которая необходима для синтеза аргинин-янтарной кислоты. Суммарное уравнение биосинтеза мочевины: С  О2 + 2 NН2 + 3 АТФ + 2 Н2О СО(NН2)2 + 3 АДФ + 3 Н3РО4 О2 + 2 NН2 + 3 АТФ + 2 Н2О СО(NН2)2 + 3 АДФ + 3 Н3РО4 |
