Химия. Ответы на задание. Химия Ответы на задание. 1. Составить электронную формулу атома F
 Скачать 98.48 Kb. Скачать 98.48 Kb.
|
|
1. Составить электронную формулу атома F? У атома фтора в ядре 9 протонов, значит на электронной оболочке 9 электронов, поэтому электронная формула его 1s2,2s2,2p5. 2. Определите тип гибридизации атомных орбиталей в молекуле хлорида бериллия BeCl2, каково ее строение и полярность?Каждый атом хлора, входящий в состав молекулы BeCl2, обладает одним неспаренным электроном: 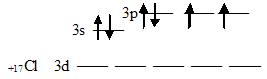 Неспаренный электрон участвует в образовании ковалентной связи с атомом бериллия. Атом бериллия в основном состоянии (1s22s22p0) неспаренных электронов не имеет: Соответственно, для участия в образовании химических связей по обычному ковалентному механизму атом бериллия должен перейти в возбуждённое состояние (1s22s12p1): 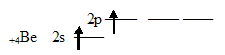 При перекрывании этих двух электронов с неспаренными электронами атомов хлора образуется две - связи Ве — Cl. При этом должны образоваться одна s — p, а другая - p — p связи. Эти связи неравноценны, но фактические измерения показывают, что обе - связи в молекуле BeCl2 одинаковы и молекула имеет линейное строение. Установлено, что центральным атомом в молекуле хлорида бериллия является атом Ве (Cl — Be — Cl). Объяснить это можно тем, что s- и р-орбитали образуют две равноценные гибридные sр-орбитали, которые вытянуты в противоположных направлениях. Два гибридных sр-облака в результате взаимного отталкивания располагаются относительно ядра атома таким образом, угол между ними составляет 1800 (рис. 1. и рис. 2.). В результате такого расположения гибридных орбиталей молекулы BeCl2, где Ве является центральным атомом, имеет линейную конфигурацию, т.е. ядра всех атомов располагаются на одной прямой (рис. 1. и рис. 2.). 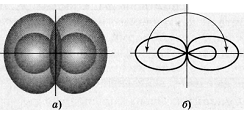 Рис. 1. Взаимное расположение sp-гибридных орбиталей одного атома Рис. 2. Трёхатомная молекула BeCl2 При переходе BeCl2 в твёрдое состояние тип гибридизации изменяется. Между отдельными молекулами BeCl2 возникают новые ковалентные связи. В итоге при конденсации BeCl2 образуются линейные полимерные цепи. Объяснить это можно тем, что в общее число электронов в молекуле BeCl2недостаточно для того, чтобы целиком заполнить внешний электронный слой атома бериллия. Так в молекуле BeCl2: В наружном слое атома бериллия имеются две свободные р-орбитали, а у атома хлора имеются неподелённые электронные пары; поэтому атом Ве способен быть акцептором неподелённых электронных пар, а атом Cl – донором. При охлаждении газообразного хлорида бериллия между отдельными молекулами BeCl2 возникают ковалентные связи по донорно-акцепторному механизму (рис. 3.). При конденсации BeCl2 возникает линейный полимер, в котором атомы хлора играют роль мостиков, связывающих атомы бериллия. (рис. 4.). 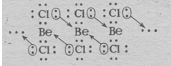 Рис. 3. Ковалентные связи по донорно-акцепторному механизму между молекулами BeCl2  Рис. 4. Схема строения линейного полимера (BeCl2)n Считается, что благодаря sp-гибридизации молекула BeCl2 имеет линейную форму и все три ее атома находятся на о 3. Уравняйте электронно-востановительную реакцию методом электронного баланса: HNO2 + KMnO4 + H2SO4 = MnSO4 + HNO3 + K2SO4 + H2O 5 HNO2 + 2 KMNO4 + 3 H2SO4 = 2 MNSO4 + 5 HNO3 + K2SO4 + 3 H2O 2KMnO4 + 3H2SO4 + 5HNO2 = 2MnSO4 + K2SO4 + 5HNO3 + 3H2O Mn(+7) +5e- --> Mn(+2) I 2 N(+3) -2e- ------> N(+5) I 5 4. Составьте уравнение реакций протекающих при гидролизе Na2SO3 Na2SO3 – соли сильного основания и слабой кислоты, поэтому гидролиз проекает по аниону. Na2SO3+HOH=NaHSO3+NaOH SO3(2-) +HOH=HSO3(-) + OH(-) Гидролиз по аниону, среда щелочная Первая стадия гидролиза Молекулярное уравнение Na2SO3+H2O⇄NaOH+NaHSO3 Полное ионное уравнение 2Na+ + SO32- + H2O ⇄ Na+ + OH- + Na+ + HSO3- Краткое ионное уравнение SO32- + H2O ⇄ HSO3- + OH- Вторая стадия гидролиза Молекулярное уравнение NaHSO3 + H2O ⇄ NaOH + H2SO3 Полное ионное уравнение Na+ + HSO3- + H2O ⇄ Na+ + OH- + H2SO3 Краткое ионное уравнение HSO3- + H2O ⇄ H2SO3 + OH- Т.к. в результате гидролиза образовались гидроксид-ионы (OH-), то раствор будет имееть щелочную среду (pH > 7) 5. Закончите реакции ионного обмена и напишите ее в ионно-молекулярном виде HCOONa+HNO2 - Реакция протекает между такими веществами как азотная кислота и формиат натрия. В результате прохождения реакции образуется такие вещества как: соль нитрат натрия и муравьиная кислота. Молекулярное уравнение химической реакции выглядит следующим образом: HCOONa + HNO2 = HCOOH + NaNO2 Ионное уравнение реакции можно записать так: H + + COO - + Na + + H + + NO2 - = H + + COOH - + Na + NO2 - . |
