Физика. 1. Волновая и квантовая природа света. Корпускулярноволновой дуализм. Квантовая теория света
 Скачать 0.92 Mb. Скачать 0.92 Mb.
|
|
Оптика 1.Волновая и квантовая природа света. Корпускулярно-волновой дуализм. Квантовая теория света. Согласно этой теории, световое излучение испускается и поглощается частицами вещества не непрерывно, а диксретно, то есть отдельными порциями - квантами света. Она полностью объясняет с единых позиций все свойства света. Характерной чертой квантовой теории света является объяснение всех явлений, в том числе и тех, ко торые ранее казались объяснимыми лишь с позиций волновой теории. Волнова́ятео́риясве́та — одна из теорий, объясняющих природу света. Основное положение теорииосновывается на том, что свет имеет волновую природу, то есть ведёт себя как электромагнитная волна (отдлины которой зависит цвет видимого нами света). Теория подтверждается многими опытами и данное поведение света наблюдается в таких физических явлениях, как дисперсия, дифракция и интерференция света. Корпускулярно-волновой дуализм — является важнейшим универсаль ным свойством природы, которое состоит в том, что каждому микрообъекту присущи сразу и корпускулярные, и волновые характеристики. Например, электрон,нейтрон,фотон в одних условиях ведут себя как частицы, которые двигаются по классическим траекториям и имеют определенную энергию и импульс, а в других — обнаруживают свою волновую природу, которая характерна для явлений интерференции и дифракции частиц. 2.Законы отражения и преломления света. Абсолютный и относительный показатель применения и их физический смысл. Закон отражения света: Падающий луч, перпендикуляр к границе раздела двух сред в точке падения и отраженный луч лежат в одной плоскости, причем угол падения равен углу отражения. Закон преломления: Падающий луч, перпендикуляр к границе раздела сред в точке падения и преломленный луч лежат в одной плоскости, причем отношение синуса угла падения к синусу угла преломления постоянно для данной пары сред и равно показателю преломления второй среды относительно первой. Показатель преломления среды относительно вакуума называют абсолютным показателем преломления. Он равен отношению скорости света c в вакууме к скорости света υ в среде: n=c/v Постоянную величину n называют относительным показателем преломления второй среды относительно первой. Относительный показатель преломления двух сред равен отношению их абсолютных показателей преломления: n=n2/n1 Физический смысл показателя преломления – это отношение скорости распространения волн в первой среде υ1 к скорости их распространения во второй среде υ2: n=v1/v2 3.Интерференция света. Когерентность. Условия усиления и ослабления света при интерференции. Интерференция заключается в усилении или ослаблении интенсивности световых волн при их наложении. Интерферировать могут только когерентные световые волны. Волны являются когерентными, если для них выполняются 2 условия:
Волны максимально усиливают друг друга, если направление световых векторов совпадают, разность фаз кратна 2π радиан: ∆φ=2πm, где m = 1, 2, 3…– целое число. Волны ослабляют друг друга, если направление световых векторов противоположны, разность фаз кратна нечетному числу π радиан: ∆φ= (2m+1)π. 4.Дифракция света. Дифракция Френеля и дифракция Фраунгофера. Принцип Гюйгенса-Френеля. Дифра́кциясве́та — явление огибания светом преграды или прохождения через узкое отверстие. Если препятствие находится на конечном расстоянии от источника света, то фронт световой волны, падающий на препятствие, представляет собой сферу- дифракция Френеля. Если препятствие находится бесконечно далеко от источника света, то волновой фронт, достигающий препятствие, представляет собой сферу бесконечного радиуса, поверхность можно считать плоской- дифракция Фраунгофера Принцип Гюйгенса-Френеля Каждая точка сферического фронта представляет собой источник когерентных волн, которые интерферируют между собой огибающие эти волны 5.Дифракционная решетка. Дифракционная решетка – оптическое устройство, представляющее собой совокупность большого числа параллельных, равноотстоящих друг от друга щелей одинаковой ширины. Число штрихов может доходить до 2000-3000 тысяч на 1 мм. Расстояние, через которое повторяются штрихи на решётке, называют периодом дифракционной решётки. Обозначают буквой d. Формула дифракционной решётки: d — период решётки, α — угол максимума данного цвета, k — порядок максимума, λ — длина волны. 6.Поперечность световых волн. Явление поляризации света. Согласно теории Максвелла свет представляет собой э/м волну в которой происходят э/м колебания. Как видно из рисунка колебания происходят в 2ч взаимно перпендикулярных областях, поэтому световая волна является поперечной. Поляризация света – процесс упорядочения колебаний вектора напряжённости электрического поля при прохождении света сквозь некоторые вещества или при отражении светового потока. 7.Закон Малюса. I = I0• cos2α Формула является выражением закона Малюса: интенсивность света I, выходящего из анализатора, пропорциональна квадрату косинуса угла α между направлением плоскостей пропускання вектора Е поляризатора и анализатора. 8.Закон Брюстера. Тангенс угла падения, при котором отраженный свет полностью поляризован, равен относительному показателю преломления сред: 9.Излучательная и поглощательная способность нагретых тел. Понятие абсолютно черного тела. Лучеиспускательная способность тела есть количество энергии, излучаемое в единицу времени единицей поверхности нагретого тела, имеющего температуру Т, в окружающую среду с температурой абсолютного нуля. Поглощательная способность тела - отношение поглощаемого телом потока излучения к падающему на него монохроматическому потоку излучения частоты v; Она зависит от вещества, из которого тело состоит, от формы тела и от его температуры. Абсолютно чёрное тело — физическое тело, которое при любой температуре поглощает всё падающее на него электромагнитное излучение во всех диапазонах и совсем не отражает. 10.Законы теплового излучения: закон Кирхгофа, Стефана-Больцмана, закон смещения Вина. Закон Кирхгофа: Отношение лучеиспускательной способности к лучепоглощательной есть величина постоянная и равная излучательной способности абсолютно черного тела. Закон Стефана-Больцмана: Энергетическая светимость абсолютно черного тела пропорциональна четвертой степени абсолютной температуры: Закон смещения Вина: Произведение длины волны, на которую приходится максимум спектральной плотности энергетической светимости черного тела, на его температуру есть величина постоянная. 11.Формула Планка излучательной способности черного тела. h = 6,62 ∙ 10-34 Дж∙с – постоянная Планка, k – постоянная Больцмана, с – скорость света в вакууме. 12.Фотоэффект. Законы фотоэффекта. Уравнение Эйнштейна для внешнего фотоэффекта. Фотоэффект это вырывания электронов из вещества под действием падающего на него света. Законы фотоэффекта 1. Число фотоэлектронов, вырываемых за 1 с с поверхности катода, пропорционально интенсивности света, падающего на это вещество. 2. Кинетическая энергия фотоэлектронов не зависит от интенсивности падающего света, а зависит линейно от его частоты. 3. Красная граница фотоэффекта зависит только от рода вещества катода. 4. Фотоэффект практически безинерционен, так как с момента облучения металла светом до вылета электронов проходит время Уравнение Эйнштейна: Энергия падающего фотона расходуется на совершение электроном работы выхода из металла и на сообщение электрону кинетической энергии. 13.Постулаты Бора. Модель атома водорода по Бору. Первый постулат Бора гласит: существуют особые, станционарные состояния атома, находясь в которых атом не излучает энергию, при этом электроны в атоме движутся с укорением. Каждому стационарному состоянию соответствует определенная энергия Еn. 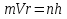 Согласно второму постулату Бора излучение света происходит при переходе атома из стационарного состояния с большей энергией в стационарное состояние с меньшей энергией. Энергия излученного фотона равна разности энергий стационарных состояний: 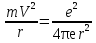    14.Корпускулярно-волновой дуализм микрочастиц. Теория де Бройля. Микрочастицы – это элементарные частицы (электроны, протоны, нейтроны и т.д.), а также сложные частицы, образованные из небольшого числа элементарных частиц (атомы, молекулы, ядра атомов). Наиболее ярко корпускулярно-волновойдуализм проявляется у элементарных частиц. Электрон, нейтрон, фотон в одних условиях ведут себя как хорошо локализованные в пространстве материальные объекты (частицы), двигающиеся с определёнными энергиями и импульсами по классическим траекториям, а в других – как волны, что проявляется в их способности к интерференции и дифракции. В 1924 г. французским ученым Луи де Бройлем была озвучена гипотеза о том, что корпускулярно-волновой дуализм присущ каждому без исключения виду материи — электронам, протонам, атомам, причем количественные соотношения между волновыми и корпускулярными свойствами частиц те же, что и установленные раньше для фотонов. Т.е., если частица обладает энергией Е и импульсом, абсолютное значение которого равняется p, значит, с этой частицей связана волна частотой v=E/h и длиной 15.Соотношения неопределенностей Гайзенберга. Нельзя одновременно измерить точно координаты частицы и её импульс 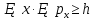 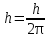 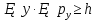 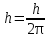 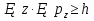 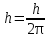 Для обнаружения частицы необходимо чтобы хотя бы 1 фотон света отразился и долетел до наблюдателя. Если длина волны больше частицы то она пройдёт мимо  Утверждение о том, что произведение неопределенностей значений двух сопряженных переменных не может быть по порядку меньше постоянной Планка h, называется соотношением неопределенностей Гейзенберга. 16.Волновая функция и ее физический смысл. Уравнение Шредингера. Волновая функция - функция координат и времени. Квадрат модуля пси-функции(плотность вероятности) определяет вероятность того, что частица будет обнаружена в пределах объема dV - физический смысл имеет не сама пси-функция, а квадрат ее модуля. Уравнение Шредингера в общем виде записывается так:  U- потенциальная эенергия=   где m – масса частицы, i2 – мнимая единица, где m – масса частицы, i2 – мнимая единица, 17.Главное, орбитальное и магнитное квантовые числа. Главное квантовое число n определяет энергетические уровни электрона в атоме. Орбитальное квантовое число e=(n-1) определяет величину момента импульса электрона в атоме. Магнитное квантовое число m характеризует ориентацию в пространстве орбитального момента импульса электрона. Принимает значения от -l до +l, где l – орбитальное квантовое число. 18.Спиновое квантовое число. Спин электрона. S=+1/2 и -1/2. Квантование спина, т.е. электроны имеют собственный магнитный момент, и этот момент может иметь только 2 напр-ия: по полю и против Четвертое квантовое число называется спиновым квантовым числом. Оно обозначается mS или S и может принимать значения +1/2 и -1/2. Наличие спинового квантового числа объясняется тем, что электрон обладает собственным моментом импульса, не связанным с перемещением в пространстве вокруг ядра. Спин – это внутреннее квантовое свойство электрона – у него нет классического аналога. Спин квантуется по закону: 19.Состав атомного ядра. Изотопы. Атомное ядро — это центральная часть атома, состоящая из протонов и нейтронов (которые вместе называются нуклонами). Протон— положительно заряженная частица, заряд которой по абсолютной величине равен заряду электронаe= 1,6 · 10-19 Кл. Нейтрон — это эле ментарная частица, не имеющая заряда, т. е. нейтральная. Число Z называется зарядовым числом ядра или атомным номером. Массовым числом ядра Аназывается общее число нуклонов, т. е. протонов и нейтронов, содер жащихся в нем. Число нейтронов в ядре обозначается буквой N. Таким образом, массовое число равно: А = Z + N. Изотопы — это разновидности атомов одного и того же химического элемента, атомные ядра которых имеют одинаковое число прото нов (Z) и различное число нейтронов (N). 20.Радиоактивность. α, β, ɣ - излучение. Закон радиоактивного распада. Период полураспада. Радиоактивностью - называется способность атомного ядра самопроизвольно распадаться с испусканием частиц. Она сопровождается превращением одного химического элемента в другой и всегда сопровождается выделением энергии.  Альфа-излучение — это поток тяжелых положительно заряженных частиц. Возникает в результате распада атомов тяжелых элементов, таких как уран, радий и торий. В воздухе альфа-излучение проходит не более пяти сантиметров и, как правило, полностью задерживается листом бумаги или внешним омертвевшим слоем кожи. Однако если вещество, испускающее альфа-частицы, попадает внутрь организма с пищей или воздухом, оно облучает внутренние органы и становится опасным. Бета-излучение — поток отрицательно заряженных электронов. это электроны, которые значительно меньше альфа-частиц и могут проникать вглубь тела на несколько сантиметров. От него можно защититься тонким листом металла, оконным стеклом и даже обычной одеждой. Попадая на незащищенные участки тела, бета-излучение оказывает воздействие, как правило, на верхние слои кожи. Если вещество, испускающее бета-частицы, попадет в организм, оно будет облучать внутренние ткани. Гамма-излучение — Это жесткое э/м излучение с длиной волны 10 в -13 м. это фотоны, т.е. электромагнитная волна, несущая энергию. В воздухе оно может проходить большие расстояния, постепенно теряя энергию в результате столкновений с атомами среды. Интенсивное гамма-излучение, если от него не защититься, может повредить не только кожу, но и внутренние ткани. Плотные и тяжелые материалы, такие как железо и свинец, являются отличными барьерами на пути гамма-излучения. Закон радиоактивного распада. Число радиоактивных ядер, которые еще не распались убывает со временем, согласно закону: N=N0 e-λt N – число ядер, не распавшихся за время t. N0 – число не распавшихся ядер в начальный момент времени (t=0) λ – постоянная распада, различна для разных радиоактивных веществ. Период полураспада – это время, в течение которого распадается половина радиоактивных ядер. Молекулярная физика и термодинамика 1.Основные положения МКТ. Термодинамические системы и термодинамические параметры. Идеальный газ. В основе молекулярно-кинетической теории лежат три основных положения: 1. Все вещества – жидкие, твердые и газообразные – образованы из мельчайших частиц – молекул, которые сами состоят из атомов. Молекулы химического вещества могут быть простыми и сложными, т.е. состоять из одного или нескольких атомов. Молекулы и атомы представляют собой электрически нейтральные частицы. 2. Атомы и молекулы находятся в непрерывном хаотическом движении. 3. Частицы взаимодействуют друг с другом силами, имеющими электрическую природу. Гравитационное взаимодействие между частицами пренебрежимо мало. Системы, состоящие из большого числа частиц, называются термодинамическими системами Параметры, описывающие состояние термодинамической системы, называется термодинамическими параметрами. Термодинамические системы характеризуются определённым числом независимых термодинамических параметров, которые принимают любое значение. Число независимых параметров зависит от характера термодинамической системы, т.е. выбор параметров произволен, но число их определено для данной системы. Для идеального одноатомного газа таких параметров будет три - P, V, T. Идеа́льныйгаз — абстрактная математическая модель газа, удобная для описания поведения реальных газов при не слишком больших давлениях и температурах. Газ считается идеальным, если он удовлетворяет 3м условиям:
2.Основное уравнение МКТ и следствия из него. Основное уравнение МКТ связывает давление идеального газа на стенки сосуда со средней кинетической энергией его молекул: 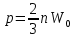 где n- концентрация молекул, где n- концентрация молекул, 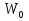 - кинетическая энергия 1ой молекулы - кинетическая энергия 1ой молекулыУмножим всё на V тогда: 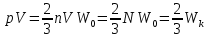 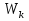 - кинетическая энергия всех молекул - кинетическая энергия всех молекулСледствия из основного уравнения МКТ
Таким образом температура является мерой кинетической энергии, а следовательно внутренней энергии газа.
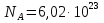 моль моль
P=P1+P2+…+Pn где: k = 1,38∙10–23 Дж/К – постоянная Больцмана Закон трех постоянных: где: R = 8,31 Дж/(моль∙К) – универсальная газовая постоянная. Следующей важной формулой является формула для средней кинетической энергии поступательного движения молекул газа: Ну и наконец, самыми главными и часто применяемыми следствиями из основного уравнения МКТ являются следующие формулы: 3.Уравнение Менделеева-Клапейрона. Важнейшим следствием из уравнения МКТ явл-ся уравнение состояния идеального газа или ур-ие М-К-на: 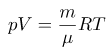 4.Число степеней свободы. Внутренняя энергия системы. Под числом степеней свободы атома или молекул понимается число независимых движений в которых одновременно может участвовать атом или молекула. Для определения положения молекулы в простр-ве Для одноатомного i=3, для двухатомного i=5 При достаточно высоких температурах 700-800К i=6 Числом степеней свободы механической системы называется количество независимых величин, с помощью которых может быть задано положение системы в пространстве. Внутренней энергией термодинамической системы называют сумму всех видов кинетической и потенциальной энергии частиц (молекул, атомов, электронов и т.д.), входящих в неё. Внутренняя энергия является функцией состояния термодинамической системы, т.е. она однозначно определяется параметрами состояния и не зависит от пути перехода в это состояние. Таким образом, U = Ек+ Еп 5.Эквивалетность теплоты и работы. Первый закон термодинамики. Как известно изменить темп-ру тела, а следовательно изменить его внутреннюю энергию можно 2мя способами:
Таким образом, сообщение телу кол-ва теплоты  U и совершение над телом мех-ой работы А совершенно эквивалентны. Поэтому эти величины измеряются в Дж. U и совершение над телом мех-ой работы А совершенно эквивалентны. Поэтому эти величины измеряются в Дж.Различие между теплотой и работой состоит в том, что они являются различными формами передачи энергии. Теплота представляет собой такую форму передачи энергии, которая определяется либо непосредственным контактом между телами (теплопроводность, конвекция), либо лучистым переносом энергии. Работа представляет собой иной механизм передачи энергии. В случае механической работы обязательно имеет место изменение объема тела. Принято считать, что подвод теплоты связан с повышением температуры тела, определяемой энергией микрочастиц тела. Первый закон термодинамики является законом сохранения и превращения энергии при тепловых процессах формулируется так: Количество теплоты ΔQ сообщаемое системе расходуется на изменение внутренней энергии и на совершение мех-ой работы: Δ Q= ΔU+А Изменение внутренней энергии системы при переходе ее из одного состояния в другое равно сумме работы внешних сил и количества теплоты, переданного системе: ΔU = A + Q, где ΔU — изменение внутренней энергии, A — работа внешних сил, Q — количество теплоты, переданной системе. 6.Применение первого закона термодинамики для изопроцессов. При изохорном процессе объем газа не меняется и поэтому работа газа равна нулю. Изменение внутренней энергии равно количеству переданной теплоты: При изотермическом процессе внутренняя энергия идеального газа не меняется. Все переданное газу количество теплоты идет на совершение работы: При изобарном процессе передаваемое газу количество теплоты идет на изменение его внутренней энергии и на совершение работы при постоянном давлении. Q=dU+A 7.Адиабатный процесс. Уравнение Пуассона. Адиабатный процесс- это процесс без теплообмена с внешней средой. При адиабатном процессе энергообмен рабочего тела с окружающей средой происходит только в форме работы, энергообмена в форме теплоты нет. Следовательно, изменение внутренней энергии при адиабатном процессе происходит только за счет совершении работы: Уравнение Пуассона описывает адиабатный процесс, протекающий в идеальном газе. Адиабатным называют такой процесс, при котором отсутствует теплообмен между рассматриваемой системой и окружающей средой: Уравнение Пуассона имеет вид: Здесь V – объем, занимаемый газом, P – его давление, а величина k называется показателем адиабаты, i- число степеней свободы. 8.Политропные процессы. Политропными процессами в т/д принято называть все процессы описываемые общим ур-ем вида: 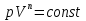 n — «показатель политропы n — «показатель политропыПолитропный процесс, политропический процесс — термодинамический процесс, во время которого удельная теплоёмкость газа остаётся неизменной. С=const Показатель политропы Кривая на термодинамических диаграммах, изображающая политропный процесс, называется «политропа». Для идеального газа уравнение политропы может быть записано в виде: где р — давление, V — объем газа, n — «показатель политропы». В зависимости от вида процесса, можно определить значение n: Изотермический процесс: Изобарный процесс: Адиабатный процесс: Изохорный процесс: 9.Энтропия и ее физический смысл. Формулы Клаузиуса и Больцмана. Определение по Клаузиусу явл-ся термодинамическим Энтропией называется отношение теплоты, подводимой к термодинамической системе в некотором процессе, к абсолютной температуре этого тела. Энтропия порождается всеми процессами, она связана с потерей системы способности совершать работу. Определение энтропии по Больцману явл-ся статистическим Формула Больцмана: S=k*lnG k-постоянная Больцмана, G-термодинамическая вероятность. Физический смысл энтропии по Больцману: Энтропия явл-ся мерой беспорядка в расположении частиц термодинамических систем 10.Второй закон термодинамики. Теорема Нернста. Формулировка: в замкнутых термодинамических системах самопроизвольные процессы протекают таким образом, что в результате энтропия системы не уменьшается, а возрастает либо остаётся постоянной 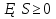 - неравенство Клаузиуса- 2ой закон т/д - неравенство Клаузиуса- 2ой закон т/дТак же второй закон термодинамики имеет следующие 2 формулировки: --- Теплота не может переходить самопроизвольно от менее нагретого тела к более нагретому. --- Невозможен процесс, единственным результатом которого является превращение теплоты в работу. Теорема Нернста: При приближении к нулю температуры, энтропия системы так же стремится к нулю: 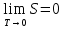 – 3-ий закон т/д – 3-ий закон т/д11.Круговые термодинамические процессы (циклы). КПД цикла. Круговые термодинамические процессы - это замкнутые т/д процессы в которых система периодически возвращается в исходное состояние Циклом или круговым процессом называется совокупность термодинамических процессов, в результате осуществления которых рабочее тело возвращается в исходное состояние. Прямым циклом называется цикл, в результате осуществления которого получается по ложительная работа, передаваемая во внешнюю среду. Обратным циклом называется цикл, в котором работа расширения lр меньше работы сжа тия lсж Цикл является обратимым, если он состоит только из обрати мых термодинамических процессов. КПД цикла- это отношение полезной механической работы к кол-ву теплоты, полученную от нагревателя:  12.Цикл Карно. КПД цикла Карно. В основе действия любой тепловой машины лежит цикл Карно. Этот цикл практически невозможно осуществить, поэтому он называется идеальным циклом.
В термодинамике цикл Карно́ или процесс Карно — это обратимый круговой процесс, состоящий из двух адиабатических и двух изотермических процессов. В процессе Карно термодинамическая система выполняет механическую работу и обменивается теплотой с двумя тепловыми резервуарами, имеющими постоянные, но различающиеся температуры. Резервуар с более высокой температурой называется нагревателем, а с более низкой температурой — холодильником. 13.Цикл Отто. Работа бензинового двигателя. 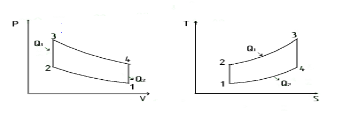 Линия 1-2 – процесс адиабатного сжатия рабочего вещества (смесь паров бензина и воздуха). Линия 2-3 –процесс изохорного подвода теплоты, (горение топлива внутри рабочей камеры). Линия 3-4 – процесс адиабатного расширения продуктов сгорания (обратный ход поршня). Линия 4-1 - процесс изохорного отвода тепла. Уравнение цикла Отто: Бензиновый двигатель – особый вид поршневого ДВС (двигателя внутреннего сгорания), в котором воспламенение ТС (смеси топлива и воздуха) в цилиндрах осуществляется принудительно при помощи электрической искры, а в качестве топлива используется бензин. 14.Двигатель Дизеля. Основным отличием этих двигателей было то, что в цилиндре сжимался чистый воздух. Поэтому в моторах Дизеля достигалась большая степень сжатия от 25 до 40, что резко повышало их мощность и КПД
Реальным называется газ, между молекулами которого действуют силы межмолекулярного взаимодействия, состоящие из сил притяжения и сил отталкивания. , 16.Изотермы реального газа. При достаточно низкой температуре Т1 некоторому давлению газа Р1 соответствует 3 разных объёма Va Vb Vc. Это означает, что для реальных газов при достаточно низких темп-ах отсутствует зависимость давления от объёма На участке АС газ находится в переходном состоянии от пара. Левее точки А сила притяжения между молекулами меньше и газ переходит в жидкое состояние 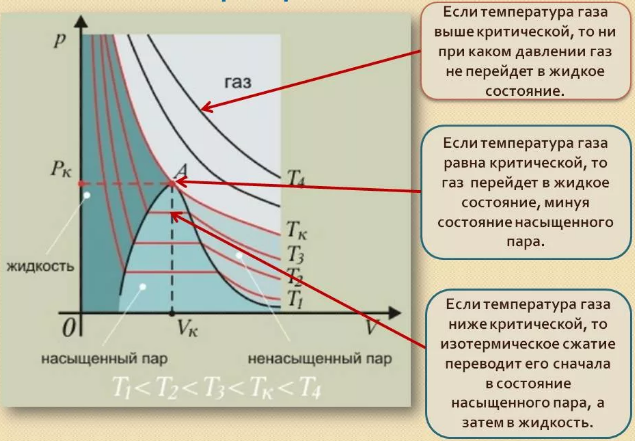 17.Агрегатное и фазовое состояние вещества. Понятие термодинамической фазы. Равновесие фаз. Фазовые переходы первого и второго рода. Агрегатные состояния вещества различаются по характеру теплового движения молекул или атомов. Обычно говорят о трех агрегатных состояниях — газообразном, твердом и жидком. В газах молекулы почти не связаны силами притяжения и движутся свободно, заполняя весь сосуд. Структура кристаллических твердых тел характеризуется высокой упорядоченностью — атомы расположены в узлах кристаллической решетки, возле которых они совершают лишь тепловые колебания. В результате кристаллические тела имеют строго ограниченную форму, а при попытке каким-то образом изменить ее возникают значительные упругие силы, противодействующие такому изменению. Фазовое состояние — понятие, основанное на структурном представлении термина «фаза». Фазовое состояние вещества определяется только характером взаимного расположения атомов или молекул, а не их относительным движением. Наличие дальнего порядка (полная упорядоченность) соответствует кристаллическому фазовому состоянию, ближнего порядка — аморфному фазовому состоянию, полное отсутствие порядка — газообразному фазовому состоянию.  Равнове́сие фаз в термодинамике — состояние, при котором фазы в термодинамической системе находятся в состоянии теплового и механического равновесия. Тепловое равновесие означает, что все фазы вещества в системе имеют одинаковую температуру. Механическое равновесие означает равенство давлений по разные стороны границы раздела соприкасающихся фаз. Фазовый переход I рода (например, плавление, кристаллизация и т. д.) сопровождается поглощением или выделением теплоты, называемой теплотой фазового перехода. Фазовые переходы I рода характеризуются постоянством температуры, изменениями энтропии и объема. Фазовые переходы II рода связаны с изменением симметрии: выше точки перехода система, как правило, обладает более высокое симметрией, чем ниже точки перехода. |

 где k=1,38*10 в -13
где k=1,38*10 в -13