110 Физические основы молекулярной физики
 Скачать 1.9 Mb. Скачать 1.9 Mb.
|
|
меньшеймолярной массой и таким же числом молекул, то 1) высота максимума увеличится 2) площадь под кривой уменьшится 3) максимум кривой сместится вправо, в сторону больших скоростей 4) максимум кривой сместится влево, в сторону меньших скоростей :4 S116 – МУО+КЗ Распределение Больцмана – 4 задания 1. [Уд1] (ВО1). Распределение Больцмана описывает распределение частиц по 1) координатам 2) кинетическим энергиям 3) импульсам 4) скоростям :1 2. [Уд1] (ВОМ). Распределение Больцмана можно использовать, если справедливы утверждения: 1) температура в разных частях системы одинакова 2) температура в разных частях системы неодинакова 3) импульсы всех молекул системы одинаковы 4) система находится в состоянии равновесия :1,4 3. [Уд1] (ВО1). Установленная вертикально закрытая с обоих концов труба наполнена газообразным кислородом M = 3210-3 кг/моль. Высота трубы h = 200 м, ускорение силы тяжести g = 9,8 м/с2. Стенки трубы имеют всюду одинаковую температуру Т = 293 К. Давление газа внутри трубы вблизи ее основания равно Р0 = 105 Па. Давление Рh в трубе вблизи верхнего его конца равно … кПа. 1) 87 2) 110 3) 97 4) 100 :3 4. [Уд1] (ВО1). На взлетной площадке барометр показывает давление P0 = 100 кПа, а в кабине вертолета барометр показывает давление P = 90 кПа. Если температура воздуха (Т = 293 К) и ускорение силы тяжести (g = 9,8 м/с2) не изменяются с высотой и, молярная масса воздуха равна M = 2910-3 кг/моль, то высота h, на которой летит вертолет, равна … м. 1) 800 2) 900 3) 1000 4) 750 :2 C116 – МУО+КЗ Распределение Максвелла – 4 задания 1. [Уд1] (ВОМ) Абсолютное число dN молекул идеального газа, скорости которых при данной температуре T заключены в интервале от V до V + dV, зависит от: 1) температуры газа 2) от общего числа N молекул этого газа 3) от объема, занимаемого газом 4) от значения скорости V, в окрестности которой выбран рассматриваемый интервал dV :1,2,4 2. [Уд1] (ВО1). Функция распределения Максвелла 1) не имеет экстремальный вид 2) является величиной безразмерной 3) может быть величиной отрицательной 4) при заданной температуре может соответствовать двум различным скоростям молекул газа :4 3. [Уд1] (ВОМ). В статистике Максвелла функция распределения имеет вид 1) f(V) - относительное число молекул, скорости которых лежат в единичном интервале скоростей вблизи заданного значения скорости V. 2) f(V)dV - относительное число молекул, скорости которых заключены в интервале скоростей от V до V+dV. 3) f(V)NdV - число молекул, скорости которых заключены в интервале скоростей отV до V+dV. 4) 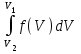 - абсолютное число молекул, скорости которых заключены в интервале от скорости V1 до скорости V2. - абсолютное число молекул, скорости которых заключены в интервале от скорости V1 до скорости V2.:1,2,3 4. [Уд1] (ВОМ). На рисунке изображен график функции распределения Максвелла молекул идеального газа по модулю скоростей. Тогда площадь заштрихованной полоски есть: 1) относительное число молекул 2) вероятность того, что скорость данной молекулы имеет значение, заключенное в интервале от V до V + dV. 3 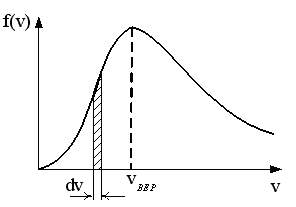 ) доля молекул, скорости которых заключены в интервале от V до V + dV. ) доля молекул, скорости которых заключены в интервале от V до V + dV.4) число частиц, скорости которых заключены в интервале от V до V + dV. :1,2,3 Дисциплина: Физика Тема: 120 Термодинамика V124 – П Энтропия и второе начало термодинамики. S124 –П Энтропия и второе начало термодинамики (10 заданий) . 1 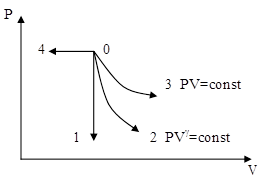 . [Уд1] (ВОМ). Система может перейти из состояния 0 в состояния 1,2,3,4 (см. рисунок). Энтропия системы уменьшается в процессах: . [Уд1] (ВОМ). Система может перейти из состояния 0 в состояния 1,2,3,4 (см. рисунок). Энтропия системы уменьшается в процессах:1) 0 1 2) 0 2 3) 0 3 4) 0 4 :1, 4 2 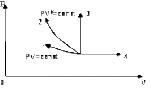 . [Уд1] (ВОМ). Система может перейти из состояния 0 в состояния 1,2,3,4 (см. рисунок). Энтропия системы возрастает в процессах: . [Уд1] (ВОМ). Система может перейти из состояния 0 в состояния 1,2,3,4 (см. рисунок). Энтропия системы возрастает в процессах:1) 0 1 2) 0 2 3) 0 3 4) 0 4 :3, 4 3. [Уд1] (ВОМ). Один моль гелия и один моль азота, находящиеся в закрытых сосудах, нагрели от температуры Т1 до температуры Т2. Тогда 1) изменения энтропий этих газов не зависят от объемов сосудов 2) изменения энтропий этих газов не зависят от скорости нагрева 3) ΔSN2 =ΔSHe 4) ΔSN2 >ΔSHe :2, 4 4. [Уд1] (ВО1). Изотермическое расширение одного моля азота проведено до удвоения объема. Такое же увеличение объема осуществлено для моля гелия. Тогда 1) ΔSN2 >ΔSHe 2) ΔSN2 <ΔSHe 3).Δ SN2 =Δ SHe 4) изменения энтропий этих газов зависят от скорости нагрева :3 5. [Уд1] (ВОМ). Правильные утверждения: 1) равновесие термодинамическое состояние – это такое состояние термодинамической системы, при котором все ее термодинамические параметры остаются постоянными сколь угодно долго. 2) термодинамический процесс – это любое изменение термодинамического состояния системы. 3) неравновесный процесс – процесс, состоящий из ряда следующих друг за другом равновесных состояний. 4) обратимый процесс всегда является равновесным процессом. : 1, 2, 4 6. [Уд1] (ВО1). Воду массой m = 0,1 кг нагревают от 0С до 100С и превращают в пар. Удельная теплоемкость воды cУД = 4,19103 Дж/кгК. Изменение энтропии при нагревании равно … Дж/К. 1) 131 2) 250 3) 347 4) 589 :1 7. [Уд1] (ВО1). При изобарическом расширении массы m = 8 г гелия от объема V1 = 10 л до объема V2 = 25 л приращение S энтропии равно … Дж/К. 1) 14,9 2) 38,1 3) 37,6 4) 43,5 :2 8. [Уд1] (ВО1). При изотермическом расширении массы m = 6 г водорода от давления p1 = 100 кПа до давления p2 = 50 кПа приращение S энтропии равно … Дж/К. 1) 17,3 2) 52,8 3) 87,6 4) 46,5 :1 9. [Уд1] (ВО1). Масса m = 10 г кислорода изохорически нагревается от температуры t1 = 500 C до температуры t2 = 1500 С, приращение S энтропии равно … Дж/К. 1) 1,75 2) 2,45 3) 8,76 4) 4,96 :1 10. [Уд1] (ВО1). Масса m = 10 г кислорода изобарически нагревается от температуры t1 = 500 C до температуры t2 = 1500 С, приращение S энтропии равно… Дж/К. 1) 1,75 2) 2,45 3) 7,63 4) 6,58 :2 C124 –П Тепловые двигатели (4 задания). 1. [Уд1] (ВО1). Н 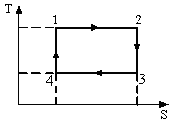 а рисунке изображен цикл Карно в координатах (Т,S), где S – энтропия. Адиабатное расширение происходит на этапе а рисунке изображен цикл Карно в координатах (Т,S), где S – энтропия. Адиабатное расширение происходит на этапе 1) 4 – 1 2) 2 – 3 3) 1 – 2 4) 3 - 4 :2. 2. [Уд1] (ВО1). Н  а рисунке изображен цикл Карно в координатах (Т,S), где S – энтропия. Адиабатное сжатие происходит на этапе а рисунке изображен цикл Карно в координатах (Т,S), где S – энтропия. Адиабатное сжатие происходит на этапе 1) 4 – 1 2) 2 – 3 3) 1 – 2 4) 3 - 4 :1. 3. [Уд1] (ВО1). Н  а рисунке изображен цикл Карно в координатах (Т,S), где S – энтропия. Изотермическое расширение происходит на этапе а рисунке изображен цикл Карно в координатах (Т,S), где S – энтропия. Изотермическое расширение происходит на этапе 1) 4 – 1 2) 2 – 3 3) 1 – 2 4) 3 - 4 :3. 4. [Уд1] (ВО1). Н  а рисунке изображен цикл Карно в координатах (Т,S), где S – энтропия. Изотермическое сжатие происходит на этапе а рисунке изображен цикл Карно в координатах (Т,S), где S – энтропия. Изотермическое сжатие происходит на этапе 1) 4 – 1 2) 2 – 3 3) 1 – 2 4) 3 - 4 :4. V125 – М Энтропия и второе начало термодинамики. S125 –М Энтропия и второе начало термодинамики (17 заданий). 1. [Уд1] (ВО1). В изотермическом процессе изменение энтропии идеального газа рассчитывается по формуле 1) 2) 3) 4) :3. 2. [Уд1] (ВО1). В изобарическом процессе изменение энтропии идеального газа рассчитывается по формуле 1) 2) 3) 4) :4. 3. [Уд1] (ВО1). В изохорическом процессе изменение энтропии идеального газа рассчитывается по формуле 1) 2) 3) 4) :2. 4. [Уд1] (ВО1). В адиабатическом процессе изменение энтропии рассчитывается по формуле 1) 2) 3) 4) :1. 5. [Уд1] (ВО1). При поступлении в термодинамическую систему тепла δQ в ходе необратимого процесса приращение ее энтропии 1) 2) 3) 4) :2 6. [Уд1] (ВОМ). Правильные утверждения о свойствах термодинамической вероятности: 1) термодинамическая вероятность – однозначная функция состояния системы 2) в равновесном состоянии термодинамическая вероятность максимальна 3) термодинамическая вероятность – величина мультипликативная 4) термодинамическая вероятность – величина аддитивная. : 1, 2, 3 7. [Уд1] (ВОМ). Правильные утверждения: 1) Энтропия замкнутой системы c течением времени не убывает 2) Нельзя передать тепло от менее нагретого тела к более нагретому без изменений в окружающих телах. 3) Для адиабатически замкнутой системы Δ S 0. 4) Энтропия замкнутой системы стремится к минимуму. :1, 2, 3 8. [Уд1] (ВОМ). Формулировкой второго начала термодинамики могут служить утверждения: 1) Невозможно периодически действующее устройство, которое превращало бы тепло в работу полностью. 2) Энтропия замкнутой системы стремится к минимуму. 3) Всякая система, предоставленная сама себе, стремится перейти в наиболее вероятное макросостояние. 4) Наиболее вероятным изменением энтропии адиабатически замкнутой неравновесной системы является ее возрастание. :1, 3, 4 9. [Уд1] (ВО1). Формулировкой второго начала термодинамики может служить утверждение 1) Энтропия – мера атомного (молекулярного) беспорядка в системе. 2) Количество тепла, подведенное к системе, затрачивается на изменение ее внутренней энергии и на совершение системой работы против внешних сил. 3) S = ln W, где W– термодинамическая вероятность системы 4) В адиабатически замкнутой системе энтропия при любом процессе не может убывать. :4 10. [Уд1] (ВО1). Воду массой m = 0,1 кг, находящуюся при температуре кипения, превращают в пар. Удельная теплота парообразования воды = 2,26106 Дж/К. Изменение энтропии при парообразовании равно … Дж/К. 1) 231 2) 606 3) 347 4) 589 :2 11. [Уд1] (ВО1). Один моль кислорода занимающий при температуре Т1 = 200 К объем V1 = 10-2 м3 при нагревании до температуры Т2 = 400 К расширяется до объема V2 = 410-2 м3. Изменение энтропии равно … Дж/К. 1) 25,9 2) 61,7 3) 34,7 4) 85,9 :1 12. [Уд1] (ВО1). При переходе массы m = 8 г кислорода от объема V1 = 10 л при температуре t1 = 80С к объему V2 =40 л при температуре t2 = 300С приращение S энтропии равно … Дж/К. 1) 1,9 2) 4,8 3) 5,4 4) 6,9 :3 13. [Уд1] (ВО1). При переходе массы m = 6 г водорода от объема V1 = 20 л под давлением p1 = 150 кПа к объему V2 = 60 л под давлением p2 = 100 кПа приращение S энтропии равно … Дж/К. 1) 14,9 2) 53,4 3) 65,9 4) 70,6 :4 14. [Уд1] (ВО1). Масса m = 10,5 г азота изотермически расширяется от объема V1 = 2 л до объема V2 = 5 л, приращение S энтропии при этом процессе равно … Дж/К. 1) 2,9 2) 5,8 3) 8,6 4) 4,5 :1 15. [Уд1] (ВО1). В результате нагревания массы m = 22 г азота его термодинамическая температура увеличилась от T1 до T2 = 1,2 T1, а энтропия увеличилась на S = 4,16 Дж/К. Данный процесс производился при 1) постоянном объеме 2) постоянном давлении 3) адиабатическом расширении 4) адиабатическом сжатии :2 16. [Уд1] (ВО1). Масса m = 6,6 г водорода расширяется изобарически от объема V1 до объема V2 = 2V1 приращение S энтропии равно … Дж/К. 1) 14,9 2) 53,4 3) 70,6 4) 66,5 :4 17. [Уд1] (ВОМ). Правильные утверждения о свойствах энтропии: 1) энтропия – многозначная функция состояния системы 2) в равновесном состоянии энтропия максимальна 3) в равновесном состоянии энтропия минимальна 4) энтропия – величина аддитивная. : 2, 4 C125 –М Тепловые двигатели (12 заданий). 1. [Уд1] (ВО1). На рисунке изображен цикл Карно в координатах (Т,S), где S – энтропия. Количество теплоты, полученной от нагревателя, определяется по формуле 1  ) ) 2) 3) |
