Органика. 17 ВОПРОС. 17. Пиримидин и его гидрокси и аминопроизводные урацил, тимин, цитозин. Лактимлактамная таутомерия, ароматичность, свойства
 Скачать 219.42 Kb. Скачать 219.42 Kb.
|
|
17. Пиримидин и его гидрокси- и аминопроизводные: урацил, тимин, цитозин. Лактим-лактамная таутомерия, ароматичность, свойства. Наиболее важный из диазинов. Пиримидин – низкоплавкое кристаллическое вещество, хорошо растворимое в воде. 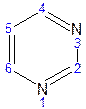 Сопряженная кольцевая система молекулы пиримидина состоит из шести p-электронов (4 электрона от атомов углерода и 2 электрона от двух атомов азота) и обеспечивает его высокую ароматичность, энергия сопряжения равна 109,2 кДж/моль (для бензола–150,7 кДж/моль). Наличие двух электроотрицательных атомов азота в цикле приводит к еще более неравномерному распределению электронной плотности, чем в пиридине. Здесь наблюдается сильное наложение мезомерного и индуктивногоэффектов. В положениях 2,4 и 6, где влияние отрицательного индуктивного эффекта (–I-эффект) атомов азота проявляется особенно сильно, будет наибольший положительный d-электронный заряд, т.е. наименьшая электронная плотность, в то же время положение 5 испытывает наименьшую потерю электронов, где и будет наибольшая электронная плотность. Нуклеофильные реагенты атакуют положения 2, 4, 6, а электрофильные – положение 5 в соответствии с поляризацией этих положений. Взаимодействие неподеленных электронных пар атомов азота с p-электронами в ароматической системе приводит к уменьшению основности атомов азота пиримидина и поэтому она значительно ниже, чем у пиридина. Вследствие этого протонирование по атомам азота пиримидина протекает лишь в очень сильных кислотах и приводит к образованию соли только по одному атому азота. Сам пиримидин инертен к электрофильной атаке. И только введение электронодонорных заместителей (–NH2, –OH, –SH) в положения 2, 4, 6 делает возможным электрофильную атаку положения 5 кольца пиримидина. Пиримидин с двумя электронодонорными заместителями вступает в электрофильное замещение как бензол, а с тремя электронодонорными заместителями в кольце реагирует легко, подобно фенолу. Например, нитрование требует двух электронодонорных групп: 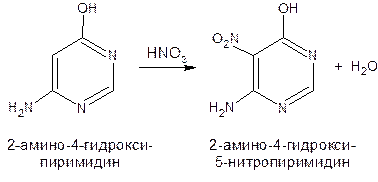 Для галогенирования достаточно одной электронодонорной группы. Так, 2-аминопиримидин хлорируется и бромируется в положение 5: 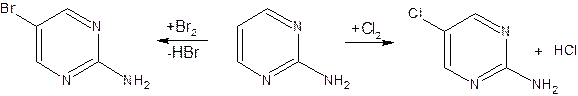 Значительно больше распространены в ряду пиримидина реакции нуклеофильного замещения. При этом речь идет о нуклеофильном замещении различных групп, находящихся в положениях 2, 4, 6. Так, при действии амида натрия на 6-метилпиридин образуются 2-амино- и 2,4-диамино-6-метилпиримидин: 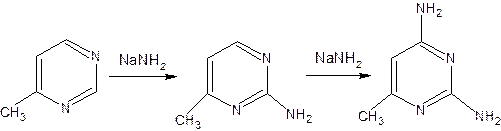 Следует отметить, что алкильные группы в положениях 2, 4 и 6 пиримидина обладают повышенной активностью: легко вступают в конденсацию с альдегидами и в реакцию азосочетания. При гидролизе нуклеиновых кислот получаются три важных производных пиримидина: цитозин (4-амино-2-гидроксипиримидин), тимин (2,4-дигидрокси-5-метилпиримидин) и урацил (2,4-дигидроксипиримидин), которые относятся к группе пиримидиновых оснований. Одним из важных свойств пиримидиновых азотистых оснований является возможность их существования в двух таутомерных формах – лактим-лактамной формах, в зависимости от значения рН среды, при рН 7,0 они находятся в лактамной форме, которая и является главной таутомерной формой: 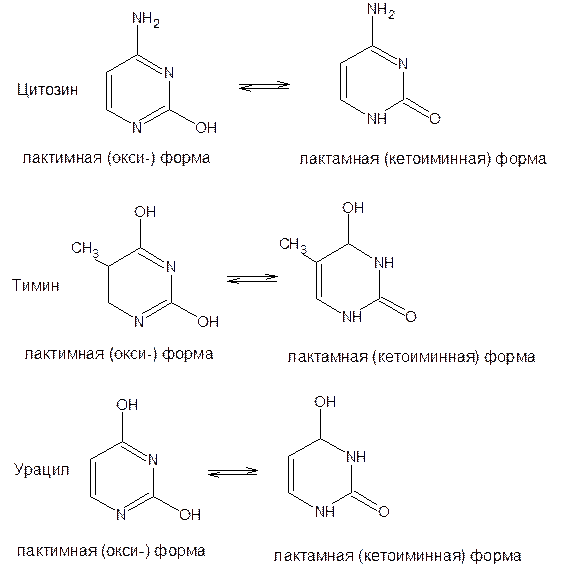 Лактимная форма присутствует только в растворах в кислой среде в весьма незначительном количестве. Помимо главных пиримидиновых оснований в составе нуклеиновых кислот открыты минорные пиримидиновые основания: 5-метил и 5-оксиметилцитозин, дигидроурацил, псевдоурацил, 1-метилурацил, 4-тиоурацил и др. На долю минорных оснований приходится до 10% всех нуклеотидов транспортных рибонуклеиновых кислот (тРНК), что имеет важный физиологический смысл – защита молекулы РНК от действия гидролитических ферментов. Биологически активные производные пиримидина. Важную биологическую роль играют гидрокси- и аминопроизводные пиримидина. 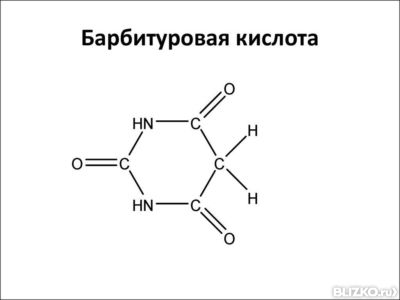 Барбитуровая кислота — 2,4,6-тригидроксипиримидин (2,4,6-пиримидинтрион, N,N-малонилмочевина). Соединение, относящееся к классу уреидов. Представляет собой бесцветные кристаллы с tпл 245 °C (протекает с разложением), растворимые в горячей воде. Плохо растворяется в холодной воде и этаноле, хорошо — в горячей воде, в простых эфирах. Производные барбитуровой кислоты, содержащие алкильные или арильные заместители, а также их соли, называются барбитуратами. Таумерия барбитурово кислоты 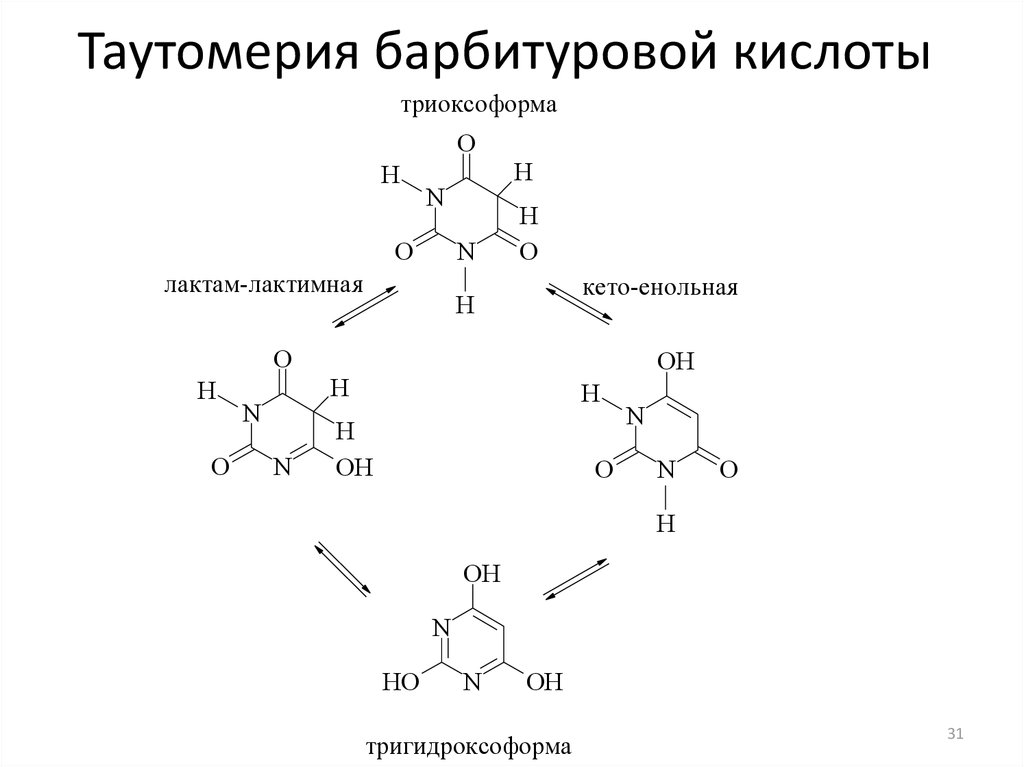 Производные барбитуровой кислоты, содержащие заместитель в положении 5 называется барбитуратами и применяется как снотворные средства. Для барбитуратов свойственно лактам – лактимная таутомерия.  Урацил, тимин и цитозин – нуклеиновые основания; входят в состав нуклеозидов, нуклеотидов,нуклеиновых кислот. Существуют в таутомерныхоксо- и гидроксиформах, переходымежду которыми осуществляются за счет миграции протона между кислородом иазотом кольца. Ураци́л (2,6-диоксипиримидин) — органическое вещество из группы пиримидиновых оснований; белый порошок или иглоподобные кристаллы, растворимые в горячей воде; молярная масса 112. Урацил обладает амфотерными (кислотными и основными) свойствами, способен к таутомерии. Впервые он был обнаружен в 1900 году в продуктах расщепления дрожжевых нуклеиновых кислот. Уроцил содержится во всех живых клеток в составе уридиловых нуклеотидов, рибонуклеиновых кислот (РНК), является одной из четырех букв генетического кода. В ДНК вместо урацила входит тимин. 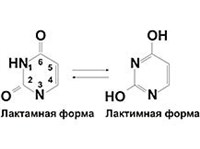 Тими́н (5-метилурацил) — природное органическое соединение из группы пиримидиновых оснований; белые кристаллы (пластинки или иглы), хорошо растворимые в горячей воде, плохо растворимые в органических растворителях. Тимин содержится во всех организмах в составе дезоксирибонуклеиновой кислоты (ДНК) и ряда коферментов углеводного обмена. В небольших количествах он встречается в транспортной рибонуклеиновой кислоте. С углеводом дезоксирибозой соединение образует нуклеозид тимидин. Синтетический аналог тимина — 5-бромурацил — используется в исследовательских целях как сильный мутаген: замещая тимин в цепи ДНК, 5-бромурацил нарушает правильное образование пар нуклеотидов по принципу комплементарности, что ведет к ошибкам при репликации ДНК и считывании генетического кода. Тимин является одной из четырех «букв» генетического кода. Цитози́н (диоксигексааминопиримидин) — природное органическое соединение из группы пиримидиновых оснований; представляет собой белые кристаллы или тонкие блестящие пластинки; его молекулярная масса равна 111,1. Цитозин содержится во всех живых клетках, входя в состав нуклеотидов — соединений, из которых состоят нуклеиновые кислоты, коферменты. С углеводом рибозой соединение образует нуклеозид цитидин. Цитозин растворим в воде, слабо растворим в эфире, не растворим в спирте. Производные цитозина, вырабатываемые организмом, участвуют в клеточном метаболизме, в образовании ДНК и РНК. Цитозин является одной из четырех «букв» генетического кода. Лактим-лактамная таутомерияСоединение( обычно понятие применяется к циклическим системам) может существовать в двух формах: лактимной и лактамной. 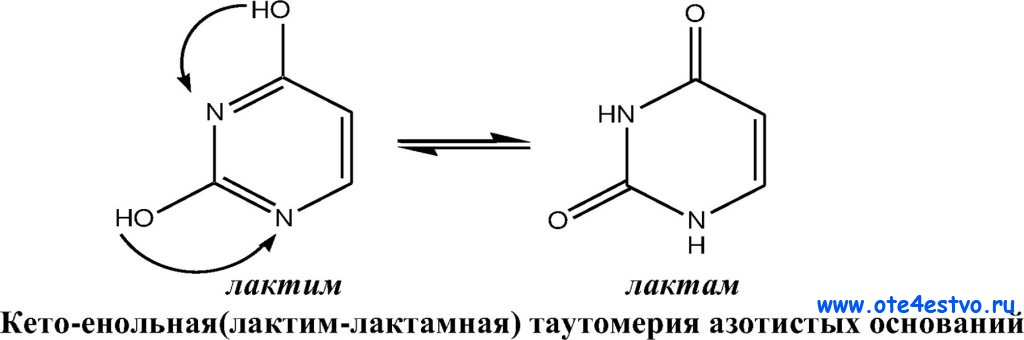 ( атом Н связан с азотом, ( им- обозначает азот с двойной связью )как в аммиаке) Образование лактимной формы связано с перемещением атома водорода из соседнего NН-кислотного центра к более электроотрицательному атому кислорода( этот раздел будет подробно изучен в теме «Нуклеиновые кислоты) Медико- биологическое значение лактим-лактамной таутомерии Для образования комплементарных пар азотистых оснований: тимин, гуанин – цитозин соединения ( Г, Ц, Т ) должны иметь лактамное строение. На рисунках приведены структурные формулы азотистых оснований в лактамной форме. 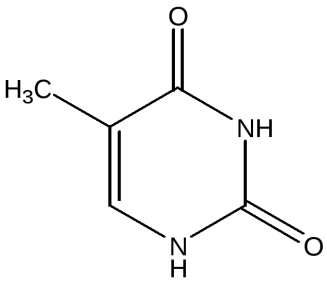 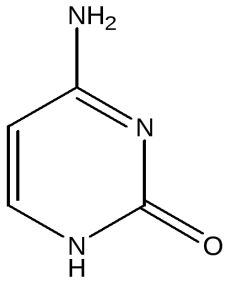 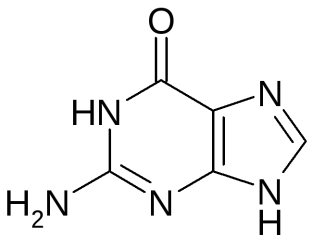 Тимин Цитозин Гуанин Производные пиримидина Пиримидиновые нуклеиновые основания: тимин (2,4-дигидрокси-5-метилпиримидин), урацил(2,4-дигидроксипиримидин), цитозин (2-гидрокси –4-аминопиримидин). Входят в состав нуклеиновых кислот в лактамной форме.    |
