1)Эквивалент это реальная или условная частица, которая в кислотноосновных реакциях присоединяет (или отдает) один ион Н или он, в окислительновосстановительных реакциях принимает (или отдает) один электрон,
 Скачать 181.94 Kb. Скачать 181.94 Kb.
|
|
Ковалентная связь (атомная связь, гомеополярная связь) — химическая связь, образованная перекрытием (обобществлением) парывалентных электронных облаков. Обеспечивающие связь электронные облака (электроны) называются общей электронной парой. Характерные свойства ковалентной связи — направленность, насыщаемость, полярность, поляризуемость — определяют химические и физические свойства соединений. Электроны тем подвижнее, чем дальше они находятся от ядер. Различают две разновидности ковалентной связи: неполярную и полярную. В случае неполярной ковалентной связи электронное облако, образованное общей парой электронов, или электронное облако связи, распределяется в пространстве симметрично относительно ядер обоих атомов. Примером являются двухатомные молекулы, состоящие из атомов одного элемента: Н2, Сl2, О2, N2, F2 и др., в которых электронная пара в одинаковой мере принадлежит обоим атомам. В случае полярной ковалентной связи электронное облако связи смещено к атому с большей относительной электроотрицательностью. Примером могут служить молекулы летучих неорганических соединений: НСl, Н2О, Н2S, NН3 и др. Образование молекулы НСl можно представить схемой Н.+ .Сl: = Н :Cl: 33) Ионная связь — прочная химическая связь, образующаяся между атомами с большой разностью электроотрицательностей, при которой общая электронная параполностью переходит к атому с большей электроотрицательностью.Это притяжение ионов как разноименно заряженных тел. Если химическая связь образуется между атомами, которые имеют очень большую разность электроотрицательностей (ЭО > 1.7 по Полингу), то общая электронная пара полностью переходит к атому с большей ЭО. Результатом этого является образование соединения противоположно заряженных ионов : 34)виды межмолекулярного взаимодействия. Межмолекулярное взаимодействие — взаимодействие между электрически нейтральными молекулами или атомами. Силы межмолекулярного взаимодействия можно достаточно обоснованно подразделить на три вида - электростатические, поляризационные (индукционные) и дисперсионные. Между одноимённо заряженными телами возникает электростатическое (или кулоновское) отталкивание, а между разноимённо заряженными — электростатическое притяжение. Индукционные (или поляризационные) силы действуют между полярной и неполярной молекулами. Полярная молекула создаёт электрическое поле, которое поляризует молекулу с электрическими зарядами, равномерно распределёнными по объёму. Положительные заряды смещаются по направлению электрического поля, а отрицательные — против. В результате у неполярной молекулы индуцируется дипольный момент. ДИСПЕРСИОННОЕ ВЗАИМОДЕЙСТВИЕ , составляющая межмолекулярного взаимодействия , определяемая квантовомех. флуктуациями электронной плотности частиц (молекул, атомов). Мгновенное распределение электрич. заряда молекулы, к-рому отвечает мгновенный дипольный момент молекулы (или более высокого порядка мультипольный момент), индуцирует электрич. мультипольные моменты в др. молекуле. Энергия взаимод. этих мгновенных мультипольных моментов и есть энергия Д. в. Едисп. | ||
| 31)валентность атомов. Вале́нтность — способность атомов химических элементов образовывать определённое число химических связей с атомами других элементов. Поскольку валентность атома зависит от числа неспаренных электронов, полезно рассмотреть структуры атомов в возбужденных состояниях, учитывая валентные возможности. Запишем электронографические формулы распределения электронов по орбиталям в атоме углерода. С их помощью определим, какую валентность проявляет углерод С в соединениях. Звездочкой (*) обозначают атом в возбужденном состоянии: 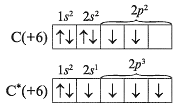 Таким образом, углерод проявляет валентность IV за счет расспаривания 2s2-электронов и перехода одного из них на вакантную орбиталь. КРАТНОСТЬ СВЯЗИ - число электронных пар, обобществлённых двумя соседними атомами молекулы в результате ковалентнойхимической связи. Так, в молекуле этана Н3С-СН3 связь С-С одинарная, К. с. равна единице (одна общая пара электронов). Для p- и d-электронных облаков перекрывание осуществляется вдоль оси, по которой они вытянуты, а образующаяся при этом связь называется s (сигма)-связью. s-Связь имеет осевую симметрию, и оба атома могут вращаться вдоль линии связи, т.е. той воображаемой линии, которая проходит через ядра химически связанных атомов. После образования между двумя атомами s-связи для остальных электронных облаков той же формы и с тем же главным квантовым числом * остается только возможность бокового перекрывания по обе стороны от линии связи. В результате образуется p (пи)-связь. Она менее прочна, чем s-связь: перекрывание происходит диффузными боковыми частями орбиталей. Таким образом, углерод проявляет валентность IV за счет расспаривания 2s2-электронов и перехода одного из них на вакантную орбиталь. КРАТНОСТЬ СВЯЗИ - число электронных пар, обобществлённых двумя соседними атомами молекулы в результате ковалентнойхимической связи. Так, в молекуле этана Н3С-СН3 связь С-С одинарная, К. с. равна единице (одна общая пара электронов). Для p- и d-электронных облаков перекрывание осуществляется вдоль оси, по которой они вытянуты, а образующаяся при этом связь называется s (сигма)-связью. s-Связь имеет осевую симметрию, и оба атома могут вращаться вдоль линии связи, т.е. той воображаемой линии, которая проходит через ядра химически связанных атомов. После образования между двумя атомами s-связи для остальных электронных облаков той же формы и с тем же главным квантовым числом * остается только возможность бокового перекрывания по обе стороны от линии связи. В результате образуется p (пи)-связь. Она менее прочна, чем s-связь: перекрывание происходит диффузными боковыми частями орбиталей. | 32)гибридизация атомных орбиталей. Гибридизация орбиталей — гипотетический процесс смешения разных (s, p, d) орбиталей центрального атома многоатомной молекулы с возникновением того же числа орбиталей, эквивалентных по своим характеристикам. Гибридизация одной s- и одной p-орбитали (sp-гибридизация) происходит, например, при образовании галогенидов бериллия, цинка, кадмияи ртути. Атомы этих элементов в нормальном состоянии имеют во внешнем слое два спаренных s-электрона. В результате возбуждения один из s-электронов переходит в p-состояние – появляется два неспаренных электрона, один из которых s-, а другой p-электрон 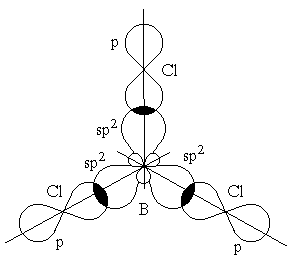 Перекрывание sp2-орбиталей бора и p-орбиталей хлора в молекуле BCl3. sp3-гибридизация Происходит при смешивании одной s- и трех p-орбиталей, образуя четыре равноценные по форме и энергии sp3-гибридные орбитали. Могут образовывать четыре σ-связи с другими атомами или заполняться неподеленными парами электронов. Оси sp3-гибридных орбиталей направлены к вершинам правильного тетраэдра. Тетраэдрический угол между ними равен 109°28', что соответствует наименьшей энергии отталкивания электронов. Так же sp3-орбитали могут образовывать четыре σ-связи с другими атомами или заполняться неподеленными парами электронов.Гибридизация одной s- и трех p-орбиталей (sp3-гибридизация) характерна, например, для углерода и его аналогов – кремния и германия. Перекрывание sp2-орбиталей бора и p-орбиталей хлора в молекуле BCl3. sp3-гибридизация Происходит при смешивании одной s- и трех p-орбиталей, образуя четыре равноценные по форме и энергии sp3-гибридные орбитали. Могут образовывать четыре σ-связи с другими атомами или заполняться неподеленными парами электронов. Оси sp3-гибридных орбиталей направлены к вершинам правильного тетраэдра. Тетраэдрический угол между ними равен 109°28', что соответствует наименьшей энергии отталкивания электронов. Так же sp3-орбитали могут образовывать четыре σ-связи с другими атомами или заполняться неподеленными парами электронов.Гибридизация одной s- и трех p-орбиталей (sp3-гибридизация) характерна, например, для углерода и его аналогов – кремния и германия. | 36) Комплексные соединения— частицы (нейтральные молекулы или ионы), которые образуются в результате присоединения к данному иону (или атому), называемому комплексообразователем, нейтральных молекул или других ионов, называемых лигандами. Комплексное соединение – химическое вещество, в состав которого входят комплексные частицы. Комплексные соединения имеют важное значение для живых организмов, так гемоглобин крови образует комплекс с кислородом для доставки его к клеткам, хлорофилл находящийся в растениях является комплексом. Вернер разделил все неорганиче ские вещества на так называемые со единения первого и высшего поряд ка. К соединениям первого порядка он отнёс главным образом достаточ но простые по своей структуре веще ства (Н2О,NaCl, PCl3). Соединениями высшего порядка учёный предложил считать продукты взаимодействия между собой соединений первого порядка — кристаллогидраты, амми акаты, полисульфиды, двойные соли, а также комплексные соединения. Комплексное соединение, по Вернеру, должно иметь в своей структу ре центральный атом (ион), который равномерно окружён различными ионами или нейтральными молекула ми, позднее их назвали лигандами. Число донорных атомов лигандов, непо средственно связанных с централь ным атомом, называется его коорди национным числом. Вернер предложил в каждом ком плексе различать две координацион ные сферы: внутреннюю и внешнюю. При записи состава комплексных со единений принято центральный атом вместе со всеми ионами и молекула ми, входящими во внутреннюю сфе ру, заключать в квадратные скобки. Вне скобок остаются лишь внешнесферные ионы, нейтрализующие заряд комплексного иона; в ряде комп лексов внешняя сфера может и отсут ствовать. 37)диссоциация комплексных соединений. Константа нестойкости комплексного иона характеризует прочность (устойчивость) внутренней сферы комплексного соединения. Значения констант нестойкости комплексных ионов находятся в определенной зависимости от электронного строения иона-комплексообразователя и энергетического состояния комплексного иона. [Cu(NH3)4]2+ Кнест = [Cu2+] * [NH3]4 / [Cu(NH3)42+] Устойчивость. Комплексные соединения в растворе определяется константой диссоциации К его комплексного иона: |
| 38) Химическая связь в комплексных соединениях и их строение: В кристаллических комплексных соединениях с заряженными комплексами связь между комплексом и внешнесферными ионами ионная, связи между остальными частицами внешней сферы – межмолекулярные (в том числе и водородные). В молекулярных комплексных соединениях связь между комплексами межмолекулярная. В большинстве комплексных частиц между центральным атомом и лигандами связи ковалентные. Все они или их часть образованы по донорно-акцепторному механизму (как следствие – с изменением формальных зарядов). В наименее прочных комплексах (например, в аквакомплексах щелочных и щелочноземельных элементов, а также аммония) лиганды удерживаются электростатическим притяжением. Связь в комплексных частицах часто называют донорно-акцепторной или координационной связью. Рассмотрим ее образование на примере аквакатиона железа(II). Этот ион образуется по реакции: FeCl2кр + 6H2O = [Fe(H2O)6]2 | 39) Окисли́тельно-восстанови́тельные реа́кции (ОВР) — это встречно-параллельные химические реакции, протекающие с изменением степеней окисления атомов, входящих в состав реагирующих веществ, реализующихся путём перераспределения электронов между атомом-окислителем и атомом-восстановителем. Межмолекулярные — реакции, в которых окисляющиеся и восстанавливающиеся атомы находятся в молекулах разных веществ, например: Н2S + Cl2 → S + 2HCl Внутримолекулярные — реакции, в которых окисляющиеся и восстанавливающиеся атомы находятся в молекулах одного и того же вещества, например:2H2O → 2H2 + O2 Диспропорционирование(самоокисление-самовосстановление) — реакции, в которых один и тот же элемент выступает и как окислитель, и как восстановитель, например: Cl2 + H2O → HClO + HCl Репропорционирование (конпропорционирование) — реакции, в которых из двух различных степеней окисления одного и того же элемента получается одна степень окисления, например:NH4NO3 → N2O + 2H2O. | 40) важнейшие окислители и восстановители. Окисли́тель — вещество, в состав которого входят атомы, присоединяющие во время химической реакции электроны, иными словами, окислитель — это акцептор электронов. Это: O2 кислород, O3 озон, Пероксиды, Hal2 галогены, ClO− гипохлориты, ClO3− хлораты, HNO3 азотная кислота, H2SO4, конц. серная кислота, Шестивалентный хром, MnO2 оксид марганца(IV), MnO4− перманганаты, Катионы металлов и H+ . ВОССТАНОВИТЕЛИ, вещества, отдающие электроны в окислит.-восстановит. р-циях. К сильным В. принадлежат щелочные и щел.-зем. металлы, Al, Si, С, Н2 и ряд др. простых веществ, гидриды металлов и соед., содержащие неметаллы с отрицат. степенями окисления ( 41)стандартные электродные потенциалы. В электрохимии стандартный электродный потенциал, обозначаемый Eo, E0, или EO, является мерой индивидуального потенциала обратимого электрода (в равновесии) в стандартном состоянии, которое осуществляется в растворах при эффективной концентрации в 1 моль/кг и в газах при давлении в 1 атмосферу или 100 кПа (килопаскалей). Объёмы чаще всего взяты при 25 °C. Основой для электрохимической ячейки, такой как гальваническая ячейка всегда является окислительно-восстановительная реакция, которая может быть разбита на две полуреакции:окисление на аноде (потеря электрона) и восстановление на катоде (приобретение электрона). Реакция протекает самопроизвольно в прямом направлении, если ее ЭДС положительна, т. е. ЭДС = Eo окисл - Eo восст > 0. Если ЭДС окажется отрицательной, то реакция протекает в обратном направлении. Так реакция 2 Fe (3+) + 2 I (-) = 2Fe(2+) + I2 будет протекать только слева направо,но не в обратном направлении. |
| 1. общая характеристика подгруппы галогенов. В подгруппу галогенов входят фтор, хлор, бром, иод и астат (ас тат - радиоактивный элемент, изучен мало). Это р-элементы VII группы периодической системы Д.И. Менделеева.На внешнем энергетичес ком уровне их атомы имеют по 7 электронов ns2np5. Этим объясняется общность их свойств.Они легко присоединяют по одному электрону, проявляя степень окисления -1. Такую степень окисления галогены имеют в соединениях с водородом и металлами. Однако атомы галогенов, кроме фтора, могут проявлять и положительные степени окисления : +1, +3, +5, +7. У атома хлора один неспаренный электрон на 3р-подуровне и обычном (невозбужденном) состоянии хлор одновалентен. Но посколь ку хлор находится в третьем периоде,то у него имеется еще пять орбиталей 3d-подуровня, в которых могут разместиться 10 электронов. Водные растворы водородных соединений галогенов являются кислотами: НF — фтороводородная (плавиковая), НСl — хлороводородная (соляная), НВr — бромводородная,НI — йодоводородная. 4. |
