химия. химия 2 задания. 2 2e s процесс окисления восстановитель
 Скачать 311.65 Kb. Скачать 311.65 Kb.
|
|
H2S + Cl2 → 2 HCl + S  S2- - 2e = S процесс окисления восстановитель Cl2 + 2e = 2 Cl- процесс восстановления  окислитель S2- + Cl2 = 2 Cl- + S Самопроизвольно протекающие реакции характеризуются отрицательной величиной энергии Гиббса ∆Go298. Энергии Гиббса окислительно-восстановительной реакции может быть выражена как работа электрического тока, совершаемая в гальваническом элементе, и может быть связана с ЭДС элемента. Эта связь для стандартных условий дается соотношением где ∆G0 – стандартная энергия Гиббса реакции, Дж; z – число молей электронов, переходящих от окислителя к восстановителю в данной реакции, моль (определяется как наименьшее общее кратное от принятых и отданных электронов); F – постоянная Фарадея, равная 96 484 Кл/моль; ∆E0 – стандартная ЭДС гальванического элемента, в основе которого лежит данная реакция, В. Значения ∆E0 вычисляют через стандартные потенциалы полуреакций окисления и восстановления, причем от потенциала окислителя нужно вычитать потенциал восстановителя: ∆ Е = ЭДС = 1,36 – (- 0,48) = + 1,84 В ∆ G = - 4 · 1,84 · 96484 = - 710122 Дж, реакция протекает в прямом направлении. Задание 2. HBr Тип гибридизации sp, у атома брома 1 неспаренный электрон и у атома водорода тоже 1. Объединяясь они образуют одинарную связь и их электронные облака перекрываются в одной плоскости, вдоль линии соединяющей ядра их атомов. S-p перекрывание. sp-Гибридизация. Этот тип гибридизации наблюдается при образовании атомом двух связей за счет электронов, находящихся на s-орбитали и на одной p-орбитали (одного и того же энергетического уровня). При этом образуются две гибридные q-орбитали, направленные в противоположные стороны под углом 180 º SiF4 В молекуле SiF4 валентный электронный слой содержит четыре пары электронов:  Поэтому в обоих случаях электронные облака атома кремния будут максимально удалены друг от друга при sp3-гибридизации, когда их оси направлены к вершинам тетраэдра. При этом в молекуле SiF4 все вершины тетраэдра заняты атомами фтора, так что эти молекулы имеют тетраэдрическую конфигурацию с атомом кремния в центре тетраэдра: 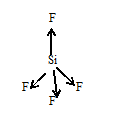 В тетраэдрических молекулах SiF4 дипольные моменты связей Si—F взаимно компенсируют друг друга, так что суммарные дипольные моменты обоих молекул будут равны нулю. Эти молекулы неполярны, несмотря на полярность связей Si—F. SnCl2 Центральный атом - олова - имеет 4 электрона на внешнем электронном уровне (IV группа) 2s22p2. Два из них не спарены, могут образовать две одинарные (σ) связи с атомами хлора: 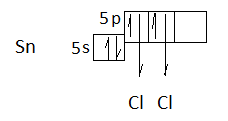 При этом у атома олова одна пара электронов осталась неподеленной. Неподеленная электронная пара участвует в отталкивании наравне с другими, образующими связь. Тип гибридизации: одна s и две р – орбитали дают три гибридные sp2- орбитали. Эти три орбитали располагаются на максимальном удалении друг от друга - по плоскому треугольнику, под углом 1200. Форма молекулы, однако – уголок, т.к. одна из орбиталей – это просто неподеленная пара, не «заметная» в стуктуре молекулы, но вносящая вклад в расталкивание орбиталей. Реальный угол в молекуле хлорида олова (II) меньше 1200 и равен 1000 за счет того, что неподеленная электронная пара отталкивается сильнее, чем пары, образующие связи.  TlF – фторид таллия  Тип гибридизации sp, у атома таллия 1 неспаренный электрон и у атома фтора тоже 1. Объединяясь они образуют одинарную связь и их электронные облака перекрываются в одной плоскости, вдоль линии соединяющей ядра их атомов. S-p перекрывание. sp-Гибридизация. Этот тип гибридизации наблюдается при образовании атомом двух связей за счет электронов, находящихся на s-орбитали и на одной p-орбитали (одного и того же энергетического уровня). При этом образуются две гибридные q-орбитали, направленные в противоположные стороны под углом 180 º [WS4]2- Распределение электронов по орбиталям выглядит следующим образом: +74W)2)8)18)32)12)2; 1s22s22p63s23p63d104s24p64f145s25p65d46s2. Внешний энергетический уровень атома вольфрама содержит 6 электронов, которые являются валентными. Энергетическая диаграмма основного состояния принимает следующий вид:               W – 6e = W6+ +74W6+ ….5d0 6s0 … 5d 6s 6p  - лиганды Тип гибридизации sp2 d – плоский квадрат LiI – йодид лития Электронную конфигурацию атома лития можно записать: +3 Li)2)1; 1s22s1. Литий, так же, как и водород и гелий относится к семейству s-элементов. Энергетическая диаграмма атома лития (на ней изображаются только валентные электроны) имеет вид: Тип гибридизации sp, у атома лития 1 неспаренный электрон и у атома йода тоже 1. Объединяясь они образуют одинарную связь и их электронные облака перекрываются в одной плоскости, вдоль линии соединяющей ядра их атомов. S-p перекрывание. sp-Гибридизация. Этот тип гибридизации наблюдается при образовании атомом двух связей за счет электронов, находящихся на s-орбитали и на одной p-орбитали (одного и того же энергетического уровня). При этом образуются две гибридные q-орбитали, направленные в противоположные стороны под углом 180 º |
