|
|
27. Соединения серы
27. Соединения серы
|
При взаимодействии серы с водородом образуется H2S - сероводород. Сероводород – это бесцветный газ с резким запахом (запах тухлых яиц). Этот газ очень ядовит, вызывает отравление даже при незначительном содержании в воздухе. Сероводород тем более опасен, что он может накапливаться в организме. Он соединяется с железом гемоглобина крови, что может привести к обморочному состоянию и смерти от кислородного голодания. Токсичность сероводорода усиливается, если в воздухе содержатся пары органических веществ.
Вместе с тем H2S имеет лечебное значение, он является составной частью некоторых минеральных вод (Пятигорск, Серноводск, Мацеста).
Вулканические газы в своем составе также содержат сероводород. Сероводород постоянно образуется на дне Черного моря, но на поверхность он не выходит, так как на глубине в 150 метров происходит его окисление кислородом, в результате чего образуется сера. Сероводород образуется при гниении белка, поэтому испорченные мясо, тухлые яйца имеют такой специфический запах.
|
Раствор сероводорода в воде называют сероводородной кислотой. Сероводородная кислота является слабой и обладает летучестью. Соли сероводородной кислоты называются сульфидами. К растворимым в воде относятся сульфиды щелочных и щелочноземельных металлов, сульфид аммония; сульфиды остальных металлов нерастворимы и окрашены в различные цвета.
|
Сероводород является сильным восстановителем. При горении сероводорода при недостатке кислорода образуются вода и сера,
2H2S + O2 = 2H2O + 2S↓
в избытке – вода и сернистый газ.
2H2S + 3O2 = 2H2O + 2SO2↑
|
Оксид серы четыре или сернистый газ – это бесцветный газ с резким характерным запахом. Оксид серы четыре – кислотный оксид, который при растворении в воде образует слабую сернистую кислоту – H2SO3, которая очень неустойчива и легко вновь разлагается на воду и сернистый газ.
SO2 + H2O = H2SO3
|
Ввиду того, что сернистая кислота – это слабая двухосновная кислота, ей соответствуют два типа солей: средние, которые называются сульфитами, и кислые – гидросульфиты.
средние – сульфиты (Na2SO3, BaSO3)
кислые – гидросульфиты (NaHSO3, Ba(HSO3)2
|
При взаимодействии оксида серы четыре при повышенных температурах и в присутствии катализатора (например, оксида ванадия или платины) с кислородом образуется оксид серы шесть.
2SO2 + O2 = 2SO3
|
Оксид серы шесть – это бесцветная летучая жидкость, обладающая удушающим запахом. При растворении этого оксида в воде образуется серная кислота – H2SO4.
SO3 + H2O = H2SO4
|
Химически чистая серная кислота – это бесцветная маслянистая жидкость, которая тяжелее воды. Серную кислоту используют в качестве водоотнимающего реагента, так как она обладает высокой гигроскопичностью.
|
Концентрированная серная кислота способна отнимать воду у органических веществ, которые вследствие этого процесса обугливаются. Для подтверждения этого можно провести небольшой опыт. Для этого в высокий стеклянный стакан необходимо поместить сахар и смочить его водой, затем, постоянно перемешивая содержимое стакана, влить концентрированную серную кислоту. Через несколько минут содержимое стакана начнет чернеть, вспучиваться и подниматься вверх в виде рыхлой массы. При этом стакан будет теплым и даже горячим, что говорит о том, что этот процесс экзотермический.
|
Оксид серы шесть хорошо растворяется в концентрированной серной кислоте, раствор SO3 в серной кислоте называют олеумом.
|
Правило разбавления концентрированной серной кислоты: нельзя приливать воду к кислоте, следует осторожно, тоненькой струйкой вливать кислоту в воду, непрерывно перемешивая раствор.
|
Химические свойства концентрированной и разбавленной серной кислот сильно отличаются друг от друга.
|
Химические свойства разбавленной серной кислоты аналогичны свойствам типичных кислот. Разбавленная серная кислота взаимодействует с металлами, стоящими в ряду активности металлов до водорода с образованием соли и выделением водорода,
3H2SO4 + 2Al = Al2(SO4)3 + 3H2↑
взаимодействует с основными и амфотерными оксидами металлов с образованием соли и воды, реагирует с основаниями в результате чего образуются соль и вода, взаимодействует с амфотерными гидроксидами с образованием соли и воды, а также реагирует с солями, реакция идет в случае, если в результате ее образуется либо нерастворимое вещество, либо газ, либо вода.
H2SO4 + CaO = CaSO4 + H2O
3H2SO4 + Al2O3 = Al2(SO4)3 + 3H2O
H2SO4 + 2NaOH = Na2SO4 + 2H2O
H2SO4 + Zn(OH)2 = ZnSO4 + 2H2O
H2SO4 + CaCO3 = CaSO4 + H2O + CO2↑
|
Серная кислота является двухоснОвной кислотой, поэтому ей, как и сернистой кислоте, соответствуют два типа солей: средние – сульфаты и кислые – гидросульфаты.
средние – сульфаты (K2SO4, CaSO4);
кислые – гидросульфаты (KHSO4, Ca(HSO4)2
|
Для качественного обнаружения серной кислоты и её солей чаще всего используют хлорид бария. В результате серная кислота или её соли с хлоридом бария образуют белый нерастворимый сульфат бария, выпадающий в осадок.
Ba2+ + SO42- = BaSO4↓
|
Химические свойства концентрированной серной кислоты отличаются от разбавленной. Так, серная кислота способна взаимодействовать с металлами, стоящими в ряду активности металлов после водорода. Например, при взаимодействии концентрированной серной кислоты с медью образуются сульфат меди, вода и выделяется сернистый газ. При этом окислителем является сера, а восстановителем медь. 2H2SO4 + Cu = CuSO4 + 2H2O + SO2↑
|
В реакциях между концентрированной серной кислотой и металлами, стоящими в ряду активности металлов до водорода, могут образовываться сера, оксид серы четыре или сероводород, что зависит от положения металла в ряду активности, а также от условий протекания реакции. Например, при взаимодействии концентрированной серной кислоты с цинком образуются сульфат цинка, вода и выделяется сероводород.
5H2SO4 + 4Zn = 4ZnSO4 + H2S↑ + 4H2O
|
Таким образом, в реакциях между концентрированной серной кислотой и металлами в результате не образуется водород, что связано с тем, что в данном случае в роли окислителя выступают сульфат-ионы, а не катионы водорода.
|
Некоторые металлы, например, железо и алюминий, пассивируются концентрированной серной кислотой, то есть она с ними не взаимодействует, поэтому ее можно перевозить и хранить в стальных и алюминиевых цистернах.
|
Нелетучая сильная серная кислота также способна вытеснять другие кислоты из их солей. Например, при взаимодействии концентрированной серной кислоты с кристаллами хлорида натрия образуются гидросульфат натрия и хлороводород.
H2SO4 + NaCl = NaHSO4 + HCl↑
|
Серная кислота является одним из главных продуктов основного химического производства, в подтверждение чего можно сказать о масштабах ее мирового производства, которые достигают сотен миллионов тонн. Серную кислоту используют в различных областях промышленности. Производство минеральных удобрений, соляной, уксусной и многих других кислот, моющих средств, взрывчатых веществ, лекарств, красителей нельзя представить без серной кислоты. Также ее используют в металлургии, как электролит в кислотных аккумуляторах, для очистки нефтепродуктов и т.д.
|
Не менее важны соли серной кислоты, которые используют в качестве минеральных удобрений, в строительстве, для борьбы с вредителями растений, в производстве соды и стекла, в медицине. Например, медный и железный купоросы используются в сельском хозяйстве для борьбы с вредителями растений, английская соль применяется в медицине, гипс используют в медицине и строительстве.
|
Получение серной кислоты на производстве проводят в три стадии.
1. Получение оксида серы четыре: оксид серы четыре получают окислением серы, сероводорода или колчедана кислородом. 2. Получение оксида серы шесть: оксид серы шесть окисляют кислородом при повышенных температурах в присутствии катализатора (платины, оксида ванадия или железа). 3. Получение серной кислоты: на данном этапе оксид серы шесть растворяют в концентрированной серной кислоте, в результате чего получают олеум.
1. Получение SO2:
S + O2 = SO2
2H2S + 3O2 = 2SO2 + 2H2O
4FeS2 + 11O2 = 2Fe2O3 + 8SO2
2. Получение SO3:
2SO2 + O2 = 2SO3
3. Получение H2SO4:
SO3 растворяют в концентрированной H2SO4, в результате чего получают олеум
SO3+ H2O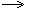 H2SO4 H2SO4
|
Производство серной кислоты наносит огромный урон природе, так как выбросы и отходы сернокислотных заводов приводят к гибели растений, негативно влияют на дыхательную систему человека и животных, ускоряют коррозию металлов, разрушают сооружения из известняка и мрамора, приводят к закислению почв и т.д.
| |
|
|
 Скачать 57 Kb.
Скачать 57 Kb.