3. Гиббсті фазалар ережесі. Туелсіз компоненттер
 Скачать 222.58 Kb. Скачать 222.58 Kb.
|
|
3.Гиббстің фазалар ережесі. Тәуелсіз компоненттер. Құрамындағы тәуелсіз компоненттердің санына сәйкес термодинамикалық жүйелер бір компонентті, компонентті, екі компонентті, үш компонентті т.б. болып бөлінеді. Мұндағы компонент саны кезкелген фазаның құрамын анықтауға болатын заттың ең аз мөлшерімен анықталады. Мысалы, мырыш нитратын суда ерітіп, енді осы ерітіндіден су мен мырыш нитратын әр түрлі әдістермен бөліп кристаллогидраттар алады. Әйтсе де бұл жүйе екі компонентті, өйткені су мен мырыш нитратынан бұл жүйенің кез келген кристаллогидратты фазасын алуға болады. Күрделі жүйенің тәуелсіз компоненттер санын осы заттардың концентрациялармен байланысқан теңдеу санын шегеру арқылы анықтайды. Ал тепе-теңдік жағдайында фаза саны шексіз болмайды. Мұндағы фазалар саны 1876 жылы Гиббс тұжырымдаған фазалар ережесінің көмегімен анықталады. Жүйеге мысалы, электрлік не магниттік өріс, гравитациялық күштер, температура, қысым сияқты тағы да басқа сыртқы күштер әсер етуі мүмкін. Жүйеге жоғарыда келтірілген факторлардың арасындағы қысым мен температурадан басқаларды ешбір әсер етпейтін болса, Гиббстің фазалар ережесін мынадай теңдеумен өрнектеуге болады: С = К - Ф + n п - сыртқы факторлардың (С,Т,р) саны Егер тепе-теңдікке екі ғана фактор (Т, р) әсер етсеФ + С = k +2 Ф-тепе-теңдік жағдайындағы гетерогенді жүйеде болатын фазалар саны; С- жүйедегі еркіндік дәреже саны немесе варианттылық; k- жүйедегі компоненттер саны. Тек қана қатты немесе сұйық фазалардан тұратын жүйелердің тепе-теңдігіне қысым қатты әсер етпейді, сондықтан да С = К - Ф + 1 Жүйелер фазалардың санына байланысты бір, екі фазалы, т.б.; тәуелсіз компоненттердің санына қарай бір-, екі-, үш компонентті; еркіндік дәрежесінің саны бойынша вариантсыз (С=O), бір (С=1), екі (С=2) т.б. болып жіктьеледі. Тепе-теңдік гетерогенді жүйеге сыртқы факторлар арасынан тек қысым мен температура әсер еткенде, фазалар саны мен еркіндік дәреже санының қосындысы компонент санына екіні қосқанға тең. Мұндай Гиббстің фазалар ережесі немесе тек фазалар ережесі дейді. Фазалар ережесі. Барлық аумағындағы химиялық және термодинамикалық қасиеттері бірдей, бір текті жүйенің басқа бөліктерімен бөліну беткейлері арқылы шектелген бөлігі фаза деп аталады. Фазалар қарапайым және аралас болып жіктеледі. Қарапайым фаза дербес (жекеленген) бір химиялық заттан тұрады, мысалы, судағы эмульсия тәріздес бензол. Аралас фаза екі немесе одан да көп химиялық дербес (жекеленген) заттардан тұрады. Мысалы, әртүрлі сұйық немесе қатта ерітінділер. Мысалы ас тұзының судағы ерітіндісінде мынадай заттар бар: Н2О, NaCI, гидратталған Na+, CI-, H+, OH-, ал тәуелсіз компоненттер екеу: Н2О және NaCI, себебі иондар дербес күйде жүйеден бөліне алмайды. Тепеөтедіктегі жүйенің барлық фазаларын түзу үшін жеткілікті болып есептелетін құрам бөліктердің ең аз мөлшері тәуелсіз компоненттердің саны (К) деп аталады. Мысалы: СаСО3 СаО + СО2 реакциясы жүретін жүйеде: құрам бөліктер үшеу: СаСО3, СаО, СО2, ал тәуелсіз компоненттер екеу: кез келген екі зат. Яғни бөліктердің санынан олардың арасында жүретін мүмкін реакциялардың санын алып тастағанға тең.Мысалы:SrCO3 SrO + CO2 (қ) (қ) (газ) жүйесінде 3 фаза (ә қатты, 1 газ). 2 тәуелсіз компоненттер бар, сондықтан да С = 2-3+2 =1., яғни жүйе бір вариантты. 4.Кристаллогидраттардың ерігіштік диаграммаларының ерекшеліктері және есептеулер жүргізу. Егер жүйе компоненнтері арасында химиялық әрекеттесу болса, онда ерігіштік диаграммасы күрделенеді. Ерігіштік қисығының бірқалыпты ауысуы жүзеге асады: ерітіндімен тепе тең қатты фаза өзгермеген жағдайда. Егер ерігіштік қисығында сыну пайда болса, онда қатты фазаның құрамы өзгерді деген сөз, мысалы, кристаллогидарт, қос тұз түзілді. Гидраттың түзілуі кезінде қос жүйенің диаграммасы екі бөлікке бөлінеді: су –гидрат және – сусыз тұз. Гидраттар қатарын түзетін тұздар үшін ерігіштік қисығында бірнеше сынықтардың пайда болуы кристалды судың молекулаларының санының өзгеруімен байланысты болады. Гидраттар белгілі бір температураға дейін тұрақты болады, оны айналу нүктесі деп атайды. Осылай мирабилитті 32.40С дейін қыздырғанда, кристалды су бөлінуі және сусыз тұздың түзілуі жүреді: Nа2SО4·10Н2О ↔ Nа2SО4 + 10Н2О (тұз кристалды суда балқиды). 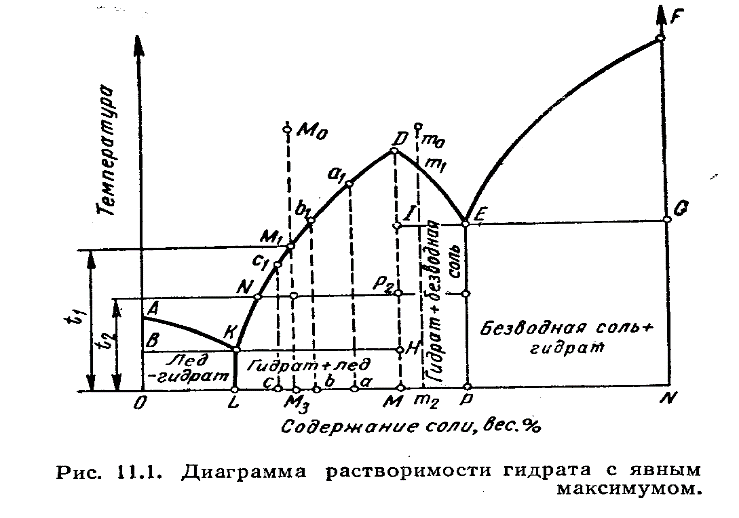 Егер DМ перпендикулярын жүргізсек, ол диаграмманы екі бөлікке бөледі.АК қисығы мұзбен тепе теңдіктегі ерітінділердің құрамын сипаттайды, ЕҒ қисығы сусыз тұзбен қаныққан ерітінділердің құрамын сипаттайды. КD және DЕ қисықтарында температураны төмендеткенде М құрамды гидрат бөлінетін қаныққан ерітінділедің құрамдары сипатталған. Диагараммада ерігіштік қисықтарының минимумдерінде жататын нүктелер бар, оларда кристаллизация немесе еру процестері кезінде ерітінді құрамы қатты фазаның құрамымен сәйкес болады. Яғни эвтектикалық тепе теңдік орнайды. Эвтектика деп берілген қысымда екі немесе одан да көп қатты фазалармен (одан біруақытта кристталдана алатын)тепе теңдікте бола алатын сұйық ерітіндіні немесе балқыманы атаймыз. Компоненттер санына байланысты қос, үштік эвтектика және т.б. деп бөледі. Е эвтектикалық нүктесінде М гидраты мен тұзының бірігіп бөлінуі жүреді. К нүктесі жүйенің криогидратты нүктесі, онда М гидраты мен мұз қоспасы бөлінеді. АВК және ЕFG –аймақтарында сәйкес қатты фазалардың артық мөлшері бар қаныққан ерітінділер: КDН и DIЕ – М гидратының кристалдану өрістері. ВН және IG бөліктері төрт фазадан тұратын жүйелерге жауап береді: бу, L или Р құрамды ерітінді және екі қатты фаза– ВН бөліктегі М гидраты мен мұз немесе IG бөліктегі гидрат пен сусыз тұз. ВКLО, КНМL, ЕLМР и ЕGNР аймақтарында үшфазалы жүйелерге жауап беретін нүктелер орналасқан: бу және екі қатты фаза. D нүктесі –айқын максимум; ол гидраттың ерігіштік қисығының КD и DЕ тармақтарының қиылысу жерінде түзіледі және диаграммада ерекше орын алады. Осы нүктенің абциссасы гидрат құрамын анықтайды, ал максимум формасы оның берілген температурадағы тұрақтылығын анықтайды. Ерігішті қисығындағы максимумның ұшталған формасы осы максимумға сәйкес температурада гидраттың тұрақты екенін көрсетеді. Егер біріншісі бөліктеп ыдыраса, онда максимум нүктесі жайпақтау болады; қисықтығы кем болған сайын, оның тұрақтылығы да кем болады. Жүйенің гидратпен суынуы оның онсыз суынуына ұқсас. Р шамасынан көп ерітіндінің бастапқы концентрациясында суыну N сусық тұзының бөлінуімен жүреді. Ерігіштік қисықтарының максимумдарында жататын диаграмма нүктелерінде еру немесе кристаллизация процестері сұйық фазаның құрамы қатты фазаның құрамы мен сәйкес болатындай жүреді. Жайпақталған максимум гидрат тұрақсыз екенін көрсетеді және ол бөліктерге ыдырайды және олардың бөлінуі қатты фазаның бөліну температурасын төмендетеді. Сондықтан D максимум нүктесі төмен ығысады және екі тармақтардың қиылысу орнына ерігіштік диаграммасында дөңгелектену пайда болады. 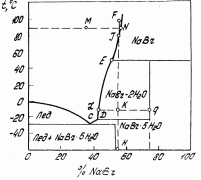 Мысал (есептеу). NаВr және NаВr·2Н2О қандай мөлшерін алуға болады оларды фракциялық кристализациялау жолымен (1000 кг 55% NаВr 100 до -10°С). 55% NаВr суытқанда жүйенің фигуративті нүктесі FН сәулесі бойынша ығысады). Сұйық фаза бастапқыда қаныққан сусыз болады, ол қатты фазаға 50.6°С температураға дейін бөлінеді, яғни сұйық фазақұрамды фигуративті нүкте Е нүктесіне дейін ығысқанша дейін. Сусыз NаВr кристалдарын бөлгеннен кейіне 50.6°С температурасында әрі қарай -10°С дейін NаВr·2Н2О кристаллизациясы жүреді. 50.6°С дейін бөлінген NаВr мөлшерін есептейік. Ол үшін диаграмма бойынша қаныққан ерітіндінің құрамын анықтау үшін 50.6°Ста (Е): 51% NаВr и 49% Н2О. Сусыз NаВr, бөлінгендіктен, яғни сұйық фвзвдвғы су мөлшері өзгеріссіз қалады, есептеу өзгермейтін компонент бойынша жүргізіледі. Бастапқы ерітіндіде: 1000·0.55 = 550 кг NаВr, 1000·0.45 = 450 кг Н2О. Е ерітіндісінде 450 кг Н2О болады. Бұл ерітіндідегі NаВr мөлшерін есептейміз: 49/51 = 450/Х, Х = 51· 450/49 = 468 кг NаВr Осылай, сусыз NаВr мөлшері (қатты фазаға бөлінетін): 550 – 468 =82 кг. 17. NаВr кристалдарын бөлгеннен кейін Е ерітіндісінде қалады: 1000 – 82 = 918 кг, соның ішінде NаВr 468 кг, Н2О 450 кг. NаВr·2Н2О мөлшерін есептеу үшін, Е ерітіндісін -10°Сқа дейін суытқанда бөлінетін, диаграммада - 10°С (L) қаныққан ерітіндінің құрамын анықтаймыз: 43% NаВr и 57% Н2О. Материалды баланстың жалпы теңдеуі түрі: 918 кг ерітіндісі Е = Х кг NаВr + Y кг Н2О + Z кг L ерітіндісі немесе 468 кг NаВr + 450 кг Н2О = Х кг NаВr + Y кг Н2О + Z(43% NаВr + 57% Н2О) Жеке теңдеулерді құрамыз: NаВr бойынша 468 = Х + 43 Z Н2О бойынша 450 = Y +57 Z, Х/Y = 102.92 / 2·18 = 2.86 мұнда 102.92 және 18 – молекулярные массы NаВr и Н2О. Бұл теңдеулерді шеше отыра есептейміз: Х = 175.5 кг, Y = 61.5 кг, Z = 6.81 кг. Қалған ерітіндінің мөлшері L: Z·100 = 6.81·100 = 681 кг. Кристалл массалары NаВr·2Н2О: 175.5 +61.5 =237 кг. Осылай, суытқанда фракциялыө кристаллизацияда 1000 кг 55% NаВr 100 ден -10°С дейін қатты фазаға бөлінеді: NаВr – 82 кг, NаВr·2Н2О – 237 кг. Қалғаны 43% NаВr – 681 кг. Қатты фазаға жалпы шығымы NаВr: (82 +175.5/550) ·100 = 46.8% |
