4. Объемная доля неона в воздухе составляет около 1%
 Скачать 1.61 Mb. Скачать 1.61 Mb.
|
4.Объемная доля неона в воздухе составляет около 1%. Рассчитайте, сколько молекул неона содержится в 10 л воздуха, в каком объеме воздуха содержится 1022 молекул неона. 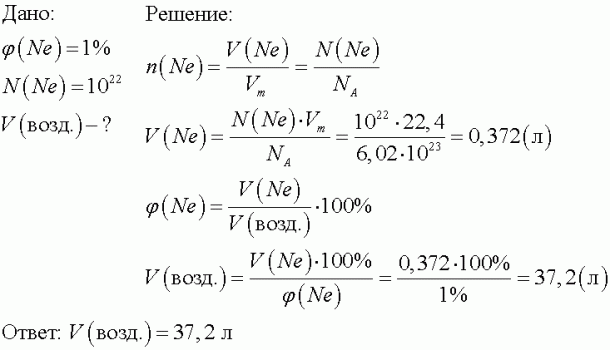 а) нитрат кальция + силикат натрия; б) гидроксид железа (II) + серная кислота; в) ацетат кальция + серная кислота; 26. Напишите электронные формулы атомов элементов с порядковыми номерами 5 и 27. Укажите семейства этих элементов, покажите распределение электронов этих атомов по квантовым ячейкам.
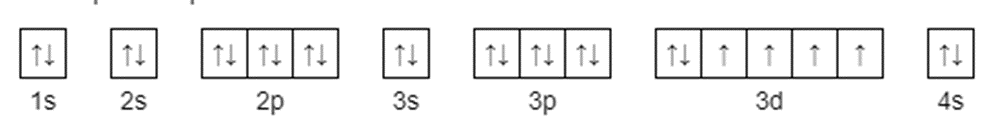 35. Рассчитайте, какие значения может принимать магнитное квантовое число при орбитальных числах l = 0, 1, 2, 3. Приведите примеры элементов s, p-, d- и f- семейств, дайте определения. Подуровни обозначают буквами: Орбитальное квантовое число l 0 1 2 3 Обозначение энергетического подуровня s p d f Таким образом, при l=0, 1, 2, 3 электроны находятся соответственно на s-, p-, d-, fподуровнях. Электроны различных подуровней называют s-, p-, d-, f-электронами. В этом случае говорят также о состояниях s-, p-, d-, f-электронов или s-, p-, d-, f-атомных орбиталях. на s-подуровне имеется единственная s-орбиталь и она расположена симметрично относительно ядра атома. Для p-подуровня l=1 и ml приобретает три значения: –1, 0, 1, т. е. р-подуровень имеет три р-орбитали и они ориентированы по трем осям координат. dподуровень с l=2 имеет пять значений ml: –2, –1, 0, 1, 2 и, следовательно, пять dорбиталей, которые ориентированы по пяти разным направлениям. f-подуровень с l=3 имеет семь значений ml: –3, –2, –1, 0, 1, 2, 3, т. е. семь f-орбиталей. Число ориентаций fорбиталей равно семи. 47. Укажите, как будет меняться характер химической связи в ряду: NaCl → MgCl2 → AlCl3 → SiCl4 → PCl5 → SCl2 → Cl2.  У хлора 3,16, у натрия 0,93. Значит разница 3,16-0,93=2,23 будет больше 1,7 и связь ионная. 57. Объясните, почему при изменении давления смещается равновесие системы N2 + 3H2 2NH3 и не смещается N2 + O2 2NO. Ответ мотивируйте на основании скорости прямой и обратной реакции в этих системах до и после изменения давления в 2 раза. Напишите выражения для констант равновесия каждой из данных систем.   К -го раствора азотной кислоты, плотность которой 1,054 г/мл, добавили 5 л 2%-го раствора этой кислоты плотностью 1,009 г/мл. Вычислите массовую долю полученного раствора, его молярную, молярную концентрацию эквивалентов и моляльную концентрации (ρ = 1,025 г/мл). Дано: ρHNO₃=10% Vm=3 л ρ = 1,009 г/мл  80. К 200 г воды добавили 5 г сульфата калия. Определить его массовую долю, молярную, моляльную концентрацию и молярную концентрацию эквивалентов раствора, если его плотность 1,03 г/мл.  89. При смешивании растворов Al2(SO4)3 и Na2S каждая из взятых солей гидролизуется необратимо до конца с образованием соответствующих основания и кислоты. Выразите этот совместный гидролиз ионномолекулярным и молекулярным уравнениями. 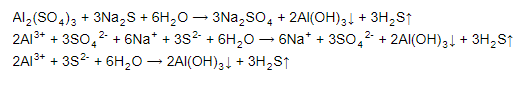 93. Определите заряд комплексных ионов и комплексообразователей, напишите уравнения диссоциации комплексных соединений K[SbBr6]; Na2[SbCl4]; (NH4)2[Sb(SO4)2]. Назовите комплексные соединения. Исходя из степени окисления азота в соединениях NH3, HNO2, HNO3, N2H4 определите, какое из них является только окислителем, только восстановителем и какие могут проявлять как окислительные, так и восстановительные свойства.  На основании электронных уравнений расставьте коэффициенты в уравнении реакции, идущей по схеме:CrCl3 + Br2 + KOH + K2CrO4 + KBr + KCl + H2 104-   |
