Эссе. эссе. 4 Зертханалы жмыс Фосфор жне оны осылыстары Аспаптар мен реактивтер
 Скачать 24.33 Kb. Скачать 24.33 Kb.
|
|
№4 Зертханалық жұмыс Фосфор және оның қосылыстары Аспаптар мен реактивтер: таразы, хлор алуға дайындалған құрал, әмбебап қағазы, су моншасы, сақиналары бар штатив, оттық, сыйымдылығы 200мл колба, газөткізгіш түтігі және воронкасы бар тығын, фарфор табақша, сыйымдылығы 10мл стакан, пышақ, пинцет, асбес сеткасы, шыны түтікше, микрокалькулятор; сүзгі қағазы, мақта,ақ және қызыл фосфор, кальций фосфиді Ca3P2,марганец диоксиді MnO2 немесе калий пермаганаты KMnO4натрий дигидроортофосфаты NaH2PO4,натрий гидроортофосфаты Na2HPO4 фосфор (III) хлориді PCI3, фосфор(V) хлоридіPCI5, ерітінділер: күкірт қышқылы H2SO4 (1:1) азот қышқылы (r=1,41г/см3 және 2н), тұз қышқылы (конц., r=1,18г/см3 және 4н) сірке қышқылы CH3COOH (2н), ортофосфор қышқылы H3PO4 (1н), аммоний молибдаты (NH4)2MoO4 (2%-ті), кальций хлориді CaCI2 (2н), натрий метафосфаты NaPO3 (1н), натрий дигидрофосфаты NaH2PO4 (1н) натрий гидрофосфаты Na2HPO4 (1н), натрий карбонаты Na2CO3 (2н), күміс нитраты AgNO3 (0,1н), натрий ацетаты NaCH3COO (0,5н),темір (III) хлориді FeCI3 (1н), алюминий сульфаты AI2(SO4)3 (1н), белок. Фосфор аллотропиясы (жұмысты тартпа шкафта жургізу керек) а) аздап қызыл фосфорды пробиркаға салып, мақтамен жауып, штативке көлбеу бекіту, жайлап қыздыру, қыздырғанда фосфор буы пробиркадан шығып жануы мүмкін, сақ болындар, жануды болдырмау керек. Пробирканың қабырғаларында ақ фосфор дағы түзіледі. Пробирканы қараңғы жерге апарып, ақ фосфордың жарық шығаруын байқау. Ақ фосфорды пробиркадан шыны таяқшамен алып ауада ұстау, не байқалады. Жүріп жатқан реакция тендеуін жазыңыз. Тәжірибе нәтижесінен фосфордың қай аллотропиялық түрі активтілеу екені туралы қорытынды шығару (тәжірибеден кейін пробирканы зертхана қызметкеріне өткізу). б) бұл тәжірибені оттан әрірек жүргізу керек. Ақ фосфор түйірін сүзгі қағазында кептіру. 1 мл күкіртті көміртекте еріту (пробирканы абайлап, жаймен шайқау). Сүзгі қағаздың бөлігін алынған ерітіндіге батыру. Қағазды қысқышпен қаңылтыр үстіне ұстап, күкіртті көміртектің ұшып барып, ақ фосфордың езінен өзі тұтануын байқау (пробирканы ерітіндісімен зертхана қызметкеріне өткізу). Осы әдіспен қызыл фосфорын да күкіртті көміртекте еруін сынау. Ақ және қызыл фосфордың күкіртті көміртекте ерігіштігін салыстыру. Фосфинді алу және оның қасиеттері. Фарфор табақшаға эквивалентті концентрациясы 4 моль/л-ге тең тұз қышқылын аздап құйып, 2—3 түйір кальций фосфоридін пинцетпен салу. Газдың бөлінуін және тұтануын байқау. Реакция теңдеулерін жазу. Фосфор және азоттың сутекті қосылыстарының тұрақтылығын салыстыру. Фосфор (V) оксидін алу (жұмысты тартпа шкафта өткізу). Асбест торға қойылған фарфор табақшаға аздап 0,4—0,5 г қызыл фосфор салып, табақшаның үстіне құрғақ воронканы төңкеріп бекіту, қызыл фосфорды қыздырылған шыны таяқшамен тұтандыру. Воронка қабырғасында қандай зат түзіледі. Реакция теңдеуін жазыңыз. Фосфордың бәрі жанып болғанда воронканы штатив сакинасына қойып 5а-тәжірибеге сақтау. Фосфор қышқыл иондарына тән реакциялар: а) натрий гидрофосфатының ерітінділеріне күміс нитратының ерітіндісін қосу. Түзілген тұнбаның құрамы қандай? Түсі қандай? Азот қышқылын қосқанда не байқалады, сынау. Тиісті реакция тендеулерін жазу. ә) аммоний молибдаты азот қышқылымен қышқылдандырылған ерітіндісінің аз көлеміне фосфор қышқылы немесе оның тұзының ерітіндісінің бірнеше тамшысын қосу. Қоспаны қыздыру. Не байқалады? Тұнбаның түсі және түрі қандай? Байқау. Осы реакцияның теңдеуі: Н3РО4 + 12(NH4)2Mo04 + 21 HNO3 = (NH4) Н4 [Р (Мо207)6] + 21 NH4NO3 + 10Н2О б) екі бөлек пробиркада мета- және дифосфат ерітінділеріне күміс нитраты ерітінділерін қосу. Тұнбаға түскен заттың түсі қандай? Азот қышқылының ерітіндісін қосқанда не байқалады? Реакция теңдеулерін жазыңыз. Күмістің мета- және дифосфаттары қандай ортада тұнбаға түседі? в) белоктың судағы ерітіндісін 2 пробиркаға құйып, бір пробиркаға натрий метафосфатының ерітіндісін, ал екіншісіне натрий дифосфатынын ерітіндісін, кейін екеуіне де сірке қышқылын құю. Белок, натрий метафосфаты және сірке қышқылы құйылған пробиркада не байқалады? Бақылау сұрақтар: Фосфор атомының электрондық формуласын жазыңдар. Фосфордың максимал коваленттігі қандай? Фосфор қосылыстарында қагдай тотығу дәрежелерін көрсетеді? Фосфордың қандай аллотропиялық түр өзгерістері бар? Олардың химиялық активтігінің әр түрлі екенін түсіндіріңдер. Фосфордың ең маңызды химиялық қасиеттерін атап айтыңдар. Оның тотығу-тотықсыздану және диспропорциялану реакция теңдеулерін келтіріңдер. Фосфинді алу реакция теңдеуін жазыңдар. Аммиак пен фосфиннің электрондонорлық қасиеттерін салыстырыңдар, олардың айырмашылығын түсіндіріңдер. Тотығу-тотықсыздану реакцияларында фосфин қндай қасиет көрсетеді? Фосфин (III) және (V) оксидтерінің графикалық формуласын жазыңдар. Оксидтердің химиялық қасиеттері қандай? Фосфор (V) оксидінің сатылай гидротациялану теңдеуін жазыңдар. Фосфор қышқылының графикалық формуласын жазыңдар: фосфорлылау, фосфорлы, мета-, орто-, дифосфор қышқылдары, химиялық байланыстар сипатын, гибридтену, фосфордың күші, негізділігі қандай? Қайсысы тотықсыздандырғыш қасиет көрсетеді? Ортофосфор қышқылын алу әдістерін атап айтыңдар. Реакция теңдеулерін жазыңдар. Фосфор (III) және (V) галогениттерінің гидролизінің реакция теңдеулерін жазыңдар. Тақырыпты бекіту: Фосфордың химиялық қасиеттерінде азоттан қандай айырмашылық бар? Бұл айырмашылықты элементтердің периодтық жүйедегі орнына және атомдардың құрылысы негізінде түсіндіріңдер. кальцийдің гидро- және дигидрофосфаттының, натрий фсфитінің, натрий және кальций гидрофосфиттерінің графикалық формулаларын жазыңдар. Ортофосфор қышқылының сатылай диссоциациялану теңдеуін жазып, диссоциациялану тұрақтысын табу. Ортофосфор қышқылы ерітіндісінде қай аниондар көп болады? Түсіндіріңдер. Мына өзгерістерді іске асыруға қажет реакциялар теңдеулерін жазыңдар: а) 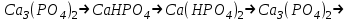 ә) 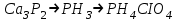 5. Фосфор (V) бромидінің, фосфор (III) иодидінің гидролиз теңдеулерін жазыңдар. 6. Реакция теңдеулерін электрондық теңдеу құрып толық жазыңдар, тотығу-тотықсыздану реакцияларын теңестіріңдер. 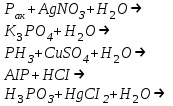 7.20т жай суперфосфат алу үшін 96%-ті күкірт қышқылы ерітіндісінің қандай көлемі және 80% Ca3(PO4)2 бар фосфориттің қандай масссасы қажет? 8. 0,31г кальций фосфатынан алынған фосфор қышқылын бейтараптау үшін натриц гидроксидінің 0,1н ерітіндісінің қандай көлемі қажет? Бұл реакция нәтижесінде натрий гидрофосфаты түзіледі. 9. 3г фосфор жанғанда 6,87г оксид түзіледі. Оксид буының ауа бойынша тығыздығы 9,8 болса, молекуласы неше атомнан тұрады? 10.Егер өнімнің іс жүзіндегі шығымы теорияға қарағанда 90% болса, 1кг фосфор алу үшін құрамында 30% Р2О3 бар фосфориттің қандай массасы қажет? |
