«Основы полимеразной цепной реакции. Компоненты реакционной смеси пцр». Актуальность пцр класс бтс и цель проектирования
 Скачать 0.94 Mb. Скачать 0.94 Mb.
|
|
Содержание Введение Актуальность ПЦР………………………………………………………………………………… Класс БТС и цель проектирования……………………………………………………………. 3. Схема взаимодействия технического объекта (ТО) с биологическим объектом (БО) и получения информации о состоянии БО………….. 3.1 Состав и структура ДНК и РНК…………………………………………………………… 3.2 Амплификация и отжиг…………………………………………………………………….. 3.2.1. Реактивы(компоненты реакционной смеси)…………………………… 3.3 Детекция продуктов амплификации методом гель-электрофореза…………………… Заключение…………………………………………………………………………………………………. Список использованной литературы……………………………………………………………………. Введение Полимеразная цепная реакция – это изящный метод, имитирующий естественную репликацию ДНК и позволяющий обнаружить единственную специфическую молекулу ДНК в присутствии миллионов других молекул. Открытие метода полимеразной цепной реакции (ПЦР) стало одним из наиболее выдающихся событий в области молекулярной биологии за последние десятилетия. Это позволило поднять медицинскую диагностику на качественно новый уровень. Суть метода заключается в многократном копировании (амплификации) в пробирке определенных участков ДНК в процессе повторяющихся температурных циклов. На каждом цикле амплификации синтезированные ранее фрагменты вновь копируются ДНК-полимеразой. Благодаря этому происходит многократное увеличение количества специфических фрагментов ДНК, что значительно упрощает дальнейший анализ. 1. Актуальность ПЦР Простота исполнения, непревзойденные показатели чувствительности и специфичности принесли новому методу небывалую популярность. За короткое время ПЦР-анализ распространился по всему миру, быстро выйдя из лабораторий научных институтов в сферу практического клинического использования. Диагностика инфекционных заболеваний, в том числе вызванных агентами,трудно поддающимися культивированию, генотипирование микроорганизмов, оценка их вирулентности, определение устойчивости микрофлоры к антибиотикам, генодиагностика и генетическая дактилоскопия, пренатальная диагностика, биологический контроль препаратов крови - вот далеко не полный перечень направлений медицины, где с успехом применяется ПЦР. В настоящее время появляются модификации ПЦР не требующие, амплификационного оборудования. Но, несмотря на это, на сегодняшний день ПЦР-анализ остается наиболее распространенной и динамично развивающейся технологией. Ежегодно на рынке появляются десятки новых тест-систем для ПЦР-анализа, предназначенных как для выявления нуклеотидных последовательностей различных микроорганизмов - возбудителей заболеваний, так и для исследования генов человека. Себестоимость ПЦР-анализа неуклонно снижается, что способствует все более широкому использованию метода в лечебных и диагностических учреждениях. Количество ПЦР-лабораторий в странах СНГ растет в геометрической прогрессии и, видимо, в ближайшее время ПЦР-анализ станет одним из самых распространенных методов лабораторной диагностики. 2. Класс БТС и цель проектирования. Класс БТС- клиническая диагностическая лабораторная техника на основе физико-химических методов .Разработка автоматического анализатора ДНК и РНК для определения специфических молекул РНК и ДНК в биопробах в присутствии миллионов других молекул. 3. Схема взаимодействия технического объекта (ТО) с биологическим объектом (БО) и получения информации о состоянии БО.  Рис. 1. Cтадии метода ПЦР. 1 – выделение ДНК, 2 – амплификация и отжиг, 3 – элетрофорез- детекция продуктов ПЦР в агарозном геле (флуоресцентный метод). 3.1 Состав и структура ДНК и РНК. Дезоксирибонуклеиновая кислота (ДНК) является универсальным носителем генетической информации у всех существующих на Земле организмов (исключение - РНК-содержащие микроорганизмы). ДНК представляет собой двойную нить, скрученную в спираль. Каждая нить состоит из соединенных последовательно нуклеотидов. Каждый нуклеотид состоит из остатка фосфорной кислоты присоединённого по 5'-положению к сахару дезоксирибозе, к которому также через гликозидную связь (C—N) по 1'-положению присоединено одно из четырёх азотистых оснований .Именно наличие характерного сахара и составляет одно из главных различий между ДНК и РНК, зафиксированное в названиях этих нуклеиновых кислот (в состав РНК входит сахар рибоза). Пример нуклеотида — аденозинмонофосфат — где основание, присоединённое к фосфату и дезоксирибозе, это аденин, показан на рис. 2. 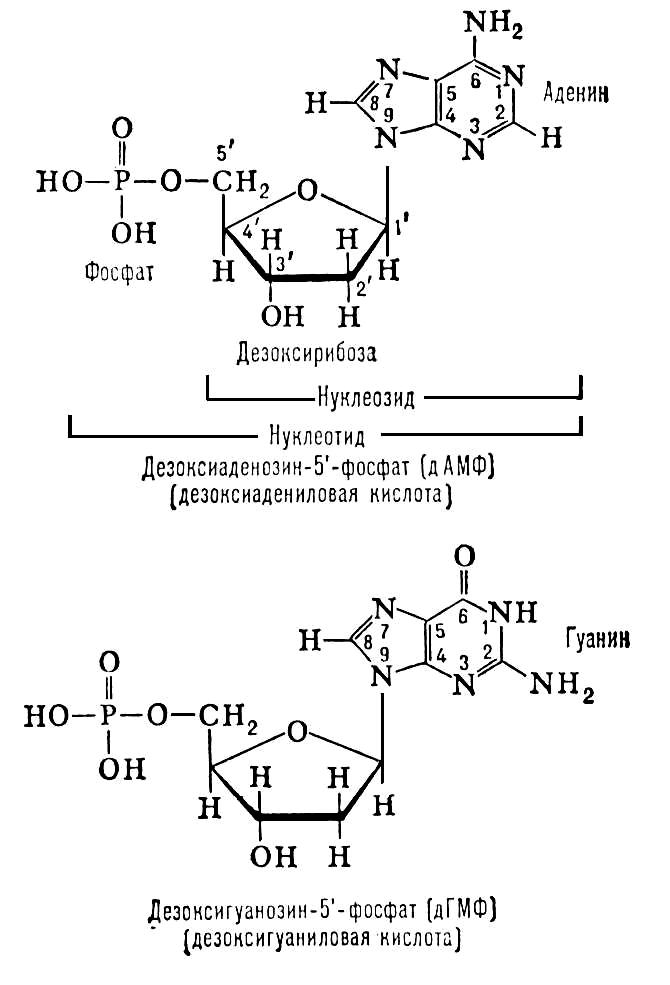 Рис.2. Строение нуклеотида(дАМФ), входящего в состав ДНК . Исходя из структуры молекул, основания, входящие в состав нуклеотидов, разделяют на две группы: пурины (аденин [A] и гуанин [G]) образованы соединёнными пяти- и шестичленным гетероциклами; пиримидины (цитозин [C] и тимин [T]) — шестичленным гетероциклом. В виде исключения, например, у бактериофага PBS1, в ДНК встречается пятый тип оснований — урацил ([U]), пиримидиновое основание, отличающееся от тимина отсуствием метильной группы на кольце, обычно заменяющее тимин в РНК. Следует отметить, что тимин и урацил не так строго приурочены к ДНК и РНК соответственно, как это считалось ранее. Так, после синтеза некоторых молекул РНК значительное число урацилов в этих молекулах метилируется с помощью специальных ферментов, превращаясь в тимин. Это происходит в транспортных и рибосомальных РНК. Полимер ДНК обладает довольно сложной структурой. Нуклеотиды соединены между собой ковалентно в длинные полинуклеотидные цепи. Эти цепи в подавляющем большинстве случаев (кроме некоторых вирусов, обладающих одноцепочечными ДНК-геномами), в свою очередь, попарно объединяются при помощи водородных связей в структуру, получившую название двойной спирали. Остов каждой из цепей состоит из чередующихся фосфатов и сахаров[11]. Фосфатные группы формируют фосфодиэфирные связи между третьим и пятым атомами углерода соседних молекул дезоксирибозы, в результате взаимодействия между 3'-гидроксильной (3' —ОН) группой одной молекулы дезоксирибозы и 5'-фосфатной группой (5' —РО3) другой. Асимметричные концы цепи ДНК называются 3' (три прим) и 5' (пять прим). Полярность цепи играет важную роль при синтезе ДНК (удлинение цепи возможно только путём присоединения новых нуклеотидов к свободному 3' концу).  Рис.3 . Структура ДНК и РНК. Как уже было сказано выше, у подавляющего большинства живых организмов ДНК состоит не из одной, а из двух полинуклеотидных цепей. Эти две длинные цепи закручены одна вокруг другой в виде двойной спирали, стабилизированной водородными связями, образующимися между обращёнными друг к другу азотистыми основаниями входящих в неё цепей. В природе эта спираль, чаще всего, правозакрученная. Направления от 3' конца к 5' концу в двух цепях, из которых состоит молекула ДНК, противоположны (цепи «антипараллельны» друг другу). Ширина двойной спирали составляет от 22 до 24 Å (ангстрем), или 2,2 — 2,4 нанометра, длина каждого нуклеотида 3,3 Å (0,33 нанометра). Подобно тому, как в винтовой лестнице сбоку можно увидеть ступеньки, на двойной спирали ДНК в промежутках между фосфатным остовом молекулы можно видеть ребра оснований, кольца которых расположены в плоскости, перпендикулярной по отношению к продольной оси макромолекулы. В двойной спирали различают малую (12 Å) и большую (22 Å) бороздки. Белки, например, факторы транскрипции, которые присоединяются к определённым последовательностям в двухцепочечной ДНК, обычно взаимодействуют с краями оснований в большой бороздке, где те более доступны. 3.2 Амплификация и отжиг. Каждый цикл амплификации включает 3 этапа, протекающие при различных температурных режимах (рис.3). 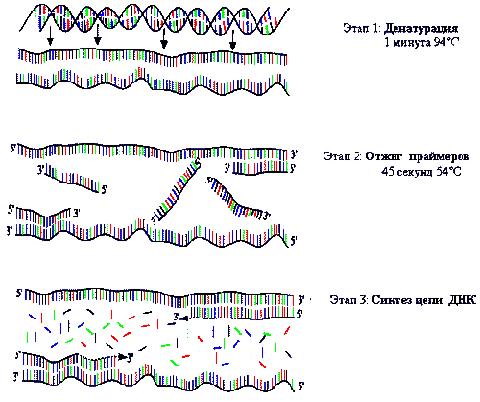 Рис.4. Этапы амплификации. 1 этап: денатурация ДНК.. Двухцепочечную ДНК-матрицу нагревают до 94 – 96ºС (или до 98ºС, если используется особенно термостабильная полимераза) на 0,5 – 2 минуты, чтобы цепи ДНК разошлись. Эта стадия называется денатурацией, так как разрушаются водородные связи между двумя цепями ДНК. Иногда перед первым циклом (до добавления полимеразы) проводят предварительный прогрев реакционной смеси в течение 2 – 5 минут для полной денатурации матрицы и праймеров. Такой прием называется горячим стартом, он позволяет снизить количество неспецифичных продуктов реакции . 2 этап: отжиг праймеров. – связывание праймеров с матричной ДНК. Когда цепи разошлись, температуру медленно понижают, чтобы парймеры могли связаться с одноцепочечной матрицей. Температура отжига зависит от состава праймеров и обычно выбирается 50-65ºС. Время стадии – 20 – 60 секунд. Неправильный выбор температуры отжига приводит либо к плохому связыванию праймеров с матрицей (при завышенной температуре), либо к связыванию в неверном месте и появлению неспецифичных продуктов (при заниженной температуре). Присоединение праймеров происходит комплиментарно к соответствующим последовательностям на противоположных цепях ДНК на границах специфического участка. 3 этап: достраивание цепей ДНК. Комплиментарное достраивание цепей ДНК происходит от 5'-конца к 3'-концу цепи в противоположных направлениях, начиная с участков присоединения праймеров. Материалом для синтеза новых цепей ДНК служат добавляемые в раствор дезоксирибонуклеозидтрифосфаты. Процесс синтеза катализируется ферментом taq-полимеразой и проходит при температуре 70-72оС. Время протекания синтеза - 20-40 сек. Образовавшиеся в первом цикле амплификации новые цепи ДНК служат матрицами для второго цикла амплификации, в котором происходит образование специфического фрагмента ДНК - ампликона. В последующих циклах амплификации ампликоны служат матрицей для синтеза новых цепей. Таким образом, происходит накопление ампликонов в растворе по формуле 2n, где n - число циклов амплификации. Поэтому, даже если в исходном растворе первоначально находилась только одна двухцепочечная молекула ДНК, то за 30-40 циклов в растворе накапливается около 108 молекул ампликона. Этого количества достаточно для достоверной визуальной детекции этого фрагмента методом электрофореза в агарозном геле. 3.2.1. Реактивы(компоненты реакционной смеси).  Рис.5. Принцип полимеразной реакции 1. Праймеры — синтетические олигонуклеотиды, состоящие из 15—30 нуклеотидов, комплементарных сайтам (участкам) на идентифициуемой матричной ДНК. Синтез праймеров — довольно трудоемкий процесс. В настоящее время подбор последовательности обеспечивается автоматически с использованием соответствующих программ. От правильности подбора праймеров зависит уровень амплификации ДНК. Особенно важно наличие комплементарности 3'-концевых нуклеотидов праймеров в выявляемой генетической структуре, так как отсутствие данного условия приводит к резкому снижению (в десятки раз) эффективности присоединения к 3-концу новых нуклеотидов, что, естественно, затрудняет последующий рост полинуклеотидной цепи. Конструирование праймеров проводится после определения нуклеотидных последовательностей в исследуемой ДНК методом секвенирования. Для подбора оптимальных условий ПЦР с выбранными праймерами применяют различные компьютерные программы, например, OLIGO. Для анализа сходства испытуемых ДНК с известными нуклеотидными последовательностями используют данные международных компьютерных банков Gen Bank и EMBL, поставляющих программы анализа DNASUN или DNASIS. 2. Смесьдезоксинуклеозидтрифосфатов (дНТФ) — дезоксиаденозинтрифосфат (дАТФ),дезоксигуанозинтрифосфат(дГТФ), дезоксицитидиктрифосфат(дЦТФ),дезокситимидинтрифосфат (дТТФ), — «строительный материал», используемый Taq-полимеразой для синтеза второй цепи ДНК. Необходимо помнить, что дНТФ при комнатной температуре легко распадаются, поэтому маточные их растворы разливают по 10—20 мкл и хранят в замороженном состоянии при температуре (—20°С——70°С). Для работы используют размороженные пробы (рабочие образцы), разведенные в 100 раз деионизированной водой (по 2 мкл каждого). Избыток угнетает активность полимеразы. 3. Taq-ДНК-полимераза (термостабильный фермент). Выделена из водорослей Thermus Aquaticus, живущих в горячих источниках, обладает ДНК-полимеразной активностью. Несколько лет назад удалось получить из бактерий Thermus Thermophilis Tth-ДНК-полимеразу, которая выполняет целый ряд функций, в том числе обеспечивает репарацию и репликацию ДНК и обладает обратнотранскриптазной активностью, позволяя получать из РНК комплементарную ДНК. Она способна удлинять короткие олиго-нуклеотидные последовательности (праймеры), присоединяя к их З-концу дополнительный нуклеотид при условии, что праймер, как уже отмечалось, комплементарен сайту цепи ДНК (матрице). Наращивание длины праймера с помощью полимеразы происходит до тех пор, пока не будет достигнут 5-конец матрицы. Экспериментально доказано, что процесс амплификации проходит более эффективно при использовании Taq-ДНК-полимеразы. 4. Буферный раствор для обеспечения оптимальных условий работы. 5. Ионы магния (Mg2+) — катализатор фермента Taq-ДНК-полимеразы. 6. Анализируемый образец — подготовленный к внесению в реакционную смесь препарат, служащий мишенью для последующего многократного копирования (например, ДНК микроорганизмов). При отсутствии ДНК-мишени специфический продукт амплификации не образуется. 7. Положительный контроль — образец ДНК выделяемой биологической системы. 8. Минеральное масло — наслаивается на поверхность реакционной смеси для предотвращения испарения и разбрызгивания продуктов ПЦР в случаях, если не применяется амплификатор с горячей крышкой. 3.3 Детекция продуктов амплификации методом гель-электрофореза. Выявление или детекцию наработанного продукта ПЦР (амплификата) чаще всего проводят при помощи его электрофореза в 2—3% геле агарозы или полиакриламидном геле (ПААГ), содержащем бромид этидия (специфический интеркалирующий флуоресцентный ДНК(РНК)-краситель). Поглощая ультрафиолетовый свет с максимальной длиной волны 256 нм, бромид этидия, связанный с участком ДНК (ампликоном), способен в соответствии с правилом Стокса флюоресцировать, что регистрируется в видимом спектре (610—620 нм) в виде оранжевой полоски. Получаемые результаты электрофореза ампликонов оценивают в проходящем ультрафиолетовом свете на специальных приборах. — трансиллюминаторах и сравнивают с положительным контролем (ДНК выявляемого микроорганизма, или известная ДНК). При положительном результате светящаяся полоска ДНК находится на том же уровне, что и положительный контроль вследствие одинаковой молекулярной массы наработанных ампликонов в контроле и изучаемом положительном образце. В отрицательном контроле должны отсутствовать светящиеся компактные полоски ДНК (рис. 6). Для такого выявления необходимо не менее 20 нг ДНК. Подбор оптимальных концентраций реагента и температуры отжига: подобрать оптимальные концентрации Taq-ДНК-полимеразы, праймеров и магния, повысить температуру отжига. 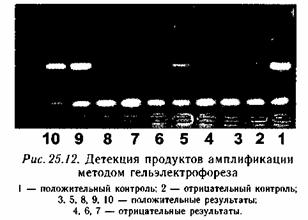 Рис.6 . Детекция продуктов амплификации методом гельэлектрофореза. 1-положительный контроль;2-отрицательный контроль; 3,5,8,9,10-положительный результат; 4,6,7-отрицательный результат. Теоретически продукты амплификации единичных молекул ДНК-мишени могут быть обнаружены с помощью электрофореза уже после 30-35 циклов. На практике это выполняется лишь в случаях, когда реакция проходит в условиях, близких к идеальным, что встречается не часто.Особенно большое влияние на эффективность амплификации оказывает чистота препарата ДНК, т.е. наличие в реакционной смеси тех или иных ингибиторов, избавиться от которых в ряде случаев сложно. Заключение Использование метода ПЦР для диагностики инфекционных заболеваний как бактериальной, так и вирусной природы имеет колоссальное значение для решения многих проблем микробиологии и эпидемиологии. Применение этого метода также способствует развитию фундаментальных исследований в области изучения хронических и малоизученных инфекционных заболеваний. ПЦР-метод позволил разработать новые диагностические тесты на генетические и инфекционные заболевания. В частности, его используют для ранней диагностики наличия в организме вируса иммунодефицита человека (ВИЧ), что не удается осуществить другими методами. При этом не требуется работать с радиоактивными изотопами, так как амплифицированный сегмент вирусной ДНК выявляется напрямую после электрофоретического разделения ДНК и окраски их бромистым этидием. Наиболее рационально и эффективно применение ПЦР для обнаружения микроорганизмов трудно культивируемых в лабораторных условиях, атипичных форм бактерий. К ним также относятся внутриклеточные паразиты и микроорганизмы, способные длительно персистировать в организме хозяина. Высокоспецифичная, чувствительная и быстрая диагностика многих тяжелых заболеваний способствует не только их эффективному лечению, но и предотвращению распространения инфекции. Наиболее эффективно и экономически обоснованно использование метода в урогинекологической практике - для выявления хламидиоза, уреаплазмоза, гонореи, герпеса, гарднереллеза, микоплазменной инфекции; в пульмонологии - для дифференциальной диагностики вирусных и бактериальных пневмоний, туберкулеза; в гастроэнтерологии - для выявления геликобактериоза ; в клинике инфекционных заболеваний - в качестве экспресс-метода диагностики сальмонеллеза, дифтерии, вирусных гепатитов В,С и G; В гематологии - для выявления цитомегаловирусной инфекции, онковирусов. В криминалистике ПЦР используют для сравнения так называемых «генетических отпечатков пальцев». Необходим образец генетического материала с места преступления — кровь, слюна, сперма, волосы и т. п. Его сравнивают с генетическим материалом подозреваемого. Достаточно совсем малого количества ДНК, теоретически — одной копии. ДНК расщепляют на фрагменты, затем амплифицируют с помощью ПЦР. Фрагменты разделяют с помощью гель-электрофореза. Полученную картину расположения полос ДНК и называют генетическим отпечатком пальцев (англ. genetic fingerprint). На лизатах индивидуальных сперматозоидов человека продемонстрирована возможность одновременно анализировать два локуса, расположенных на разных негомологичных хромосомах. Такой подход обеспечивает уникальную возможность тонкого генетического анализа и изучения хромосомной рекомбинации, ДНК-полиморфизма и др. Метод анализа индивидуальных сперматозоидов сразу нашел практическое применение в судебной медицине, так как HLA-типирование гаплоидных клеток позволяет определять отцовство. ПЦР нашла применение и в персонализированной медицине. Известно, что большинство лекарств действуют не на всех пациентов, для которых они предназначены, а лишь на 30-70 % их числа. Кроме того, многие лекарства оказываются токсичными или аллергенными для части пациентов. Причины этого — отчасти в индивидуальных различиях в восприимчивости и метаболизме лекарств и их производных. Эти различия детерминируются на генетическом уровне. Например, у одного пациента определенный цитохром (белок печени, отвечающий за метаболизм чужеродных веществ) может быть более активен, у другого — менее. Для того, чтобы определить, какой разновидностью цитохрома обладает данный пациент, предложено проводить ПЦР-анализ перед применением лекарства. Такой анализ называют предварительным генотипированием (англ. prospective genotyping). Список использованной литературы Глик Б., Пастренак Дж. Молекулярная биотехнология. Принципы и применение – Москва: Мир, 2002. 2. Сингер М., Берг П. Гены и геномы – Москва: Мир, 1998. 3. Сергеева Н. Т. Биологически активные вещества – Калининград: КГТУ, 2005. 4. Щелкунов С. Н. Генетическая инженерия — Новосибирск: Сиб. унив. изд-во, 2004 |
