|
Алканы. Алканы (парафины) это углеводороды, в которых все связи
АЛКАНЫ (ПАРАФИНЫ) – это углеводороды, в которых все связи одинарные. Их называют НАСЫЩЕННЫМИ в отличие от углеводородов с кратными связями.
Общая формула
CnH2n+2
|
Все атомы углерода в алканах имеют sp3- гибридизацию.
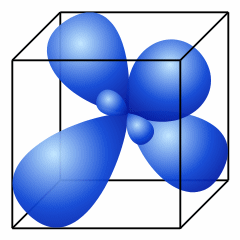
|
Физические свойства:
Первые четыре члена гомологического ряда С1 – С4 – бесцветные газы,
C5–C17 – жидкости,
начиная с C18 – твердые вещества.
Все алканы легче воды, не растворимы в воде и не смешиваются с ней.
С увеличением длины цепочки увеличиваются температуры кипения и плавления.
У алканов с разветвленным углеродным скелетом температуры кипения и плавления ниже, чем у неразветвленных с таким же числом атомов углерода в молекуле.
|
Типы атомов углерода
  вторичныйтретичный вторичныйтретичный
С
│
С   –С–С–С–С первичный –С–С–С–С первичный
│ │
С С
четвертичный
Гомологический ряд – это совокупность органических соединений, отличающихся друг от друга по составу на одну или несколько СН2-групп (гомологическая разность).
Представители одного гомологического ряда называются гомологами.
Первые пять членов ряда алканов:
СН4 – метан
С2Н6 – этан
С3Н8 – пропан
С4Н10 – бутан
С5Н12 – пентан
Виды изомерии у алканов и галогеналканов.
1) Для алканов возможна только структурная изомерия углеродного скелета (начиная с С4)
2) Для галогеналканов, нитроалканов характерна также изомерия положения заместителей – галогенов, нитрогрупп (начиная с С3)
СН3-СН2-СН2-Сl 1-хлорпропан СН3-СН-СН3 2-хлорпропан
׀
Cl
Получение алканов:
1) Реакция Вюрца: действие металлического натрия на моногалогенопроизводные углеводородов:
2CH3–CH2Br + 2Na CH3–CH2–CH2–CH3 +2NaBr
Происходит удвоение углеродного скелета. Реакция подходит для получения симметричных алканов.
|
2) Декарбоксилирование солей карбоновых кислот (реакция Дюма): сплавление со щелочами солей карбоновых кислот. Так получают метан при нагревании ацетата натрия с гидроксидом натрия.
CH3COONa + NaOH -t CH4 + Na2CO3
|
3) Электролиз растворов солей карбоновых кислот (синтез Дюма):
2CH3COONa + 2H2O –(эл.ток)2СО2 + Н2 + С2Н6 + 2NaOH
катод: идёт разрядка воды 2Н2О + 2е Н2 + 2ОН-
анод: разрядка аниона кислоты: 2СН3СОО- -2е 2СО2 + СН3-СН3
|
4) Метан также можно получить гидролизом карбида алюминия.
Al4C3 + 12H2O 3CH4 + 4Al(OH)3
|
5) Гидрирование непредельных или циклических углеводородов в присутствии катализаторов (платины, палладия, никеля). R–CH=CH–R' + H2 -kat R–CH2–CH2–R'
 (циклопропан) + H2 -Pd CH3 –CH2 –CH3(пропан) (циклопропан) + H2 -Pd CH3 –CH2 –CH3(пропан)
|
6) Предельные углеводороды от C1 до C11 выделяют фракционной перегонкой нефти, природного газа или смесей углеводородов, получаемых гидрированием угля.
|
7) Гидрирование угля, оксида углерода в присутствии катализаторов (железо, кобальт, никель) при повышенной температуре:
n C + (n+1) H2 –400С,p CnH2n+2
n CO + (2n+1) H2 –200С,Ni CnH2n+2+ n H2O
|
Химические свойства алканов.
Алканы не взаимодействуют с концентрированными кислотами, щелочами, перманганатом калия, бромной водой. Не вступают в реакции присоединения. Для них свойственны реакции замещения водородных атомов и расщепления. Эти реакции вследствие прочности связей C–C и C–H протекают или при нагревании, или на свету, или с применением катализаторов.
1)Галогенирова-ние: радикальное замещение.
Газообразные хлор и бром на свету.
|
А) хлорирование: неизбирательно, образуется смесь продуктов:
СН3-СН2-СН3 + Cl2–(свет) CH3-CH2-CH2Cl + CH3-CHCl-CH3 + HCl
Б) бромирование:
CH3 CH3
│ │
СН3-СН2-СН-СН3 +Br2 –(свет)СН3-СН2-С-СН3 + HBr
│
Избирательность бромирования: Br
третичный > вторичный > первичный атом углерода.
|
2) Нитрование
(реакция М.И. Коновалова):
|
нагревание до 1400С с разбавленной (10%-ной) азотной кислотой:
CH3 CH3
│ │
СН3-СН2-СН-СН3 + HNO3 СН3-СН2-С-СН3 + H2O
│
Избирательность нитрования: NO2
третичный > вторичный > первичный атом углерода.
|
3) Крекинг
|
а) CH3–CH2–CH2–CH3 -400°C CH3-CH3 + CH2=CH2
б) длительное нагревание метана: CH4 -1500°C C+ 2H2
в) мгновенное нагревание (пиролиз метана)
2CH4 -1500°C H–C≡C–H + 3H2
|
4) Изомеризация: при нагревании с катализатором.
|
СН3-СН2-СН2-СН3 -(100о, AlCl3) CH3-CH-CH3
│
CH3
|
5) Горение
|
CH4 + 2O2 CO2 + 2H2O
C5H12 + 8O2 5CO2 + 6H2O
|
6) Дегидрирование и циклизация.
|
СН3-СН3 –(кат, t) CH2=CH2 + Н2
В присутствии катализатора гексан и гептан превращаются в бензол и толуол соответственно.
СН3-СН2-СН2-СН2-СН2-СН3 –(кат, t)  + 4 Н2 + 4 Н2
|
7) Окисление
|
2CH4 + O2 -t, кат 2СН3ОН
CH4 + [O] -t, кат НСООН
CH4 + [O] -t, кат НСНО
2С4Н10 + 5O2 -t, кат 2СН3СООН + 2Н2О
|
ЦИКЛОАЛКАНЫ (ЦИКЛОПАРАФИНЫ)
- предельные циклические углеводороды. Общая формула гомологического ряда CnH2n.
|

|
|
|
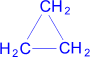
Циклопропан
|
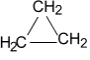
Циклобутан
|
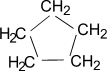
Циклопентан
|
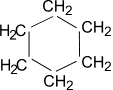
Циклогексан
|
Малые циклы
|
Большие циклы
|
Строение циклоалканов.
Каждый атом углерода в циклоалканах находится в состоянии sp3-гибридизации и образует четыре σ-связи С-С и С-Н.
Углы между связями зависят от размера цикла. В малых циклах С3 и С4 углы между связями С-С сильно отличаются от тетраэдрического угла 109,5°, что создает в молекулах напряжение и обеспечивает их высокую реакционную способность.
σ-связи в циклопропане называют "банановыми". По свойствам они напоминают p-связи.
Поэтому циклопропан способен вступать в реакции присоединения (с разрывом цикла).
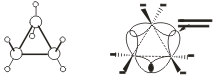
Большие циклы очень устойчивы и не склонны к разрыву. Так, молекула циклогексана не является плоским многоугольником и принимает различные конформации.
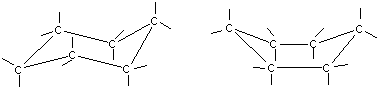
a б
Конформации шестичленного цикла: а — кресло: 6 — ванна.
И в конформации кресла, и в конформации ванны связи вокруг каждого атома углерода имеют тетраэдрическое расположение. Отсюда — несравнимо большая устойчивость обычных циклов по сравнению с малыми циклами, отсюда — их возможность вступать в реакции замещения, но не присоединения.
Изомерия: 1. Структурная изомерия, связанная:
a) с числом углеродных атомов в кольце – например, 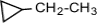 (этилциклопропан), (этилциклопропан), 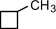 (метилциклобутан); b) с числом углеродных атомов в заместителях – (метилциклобутан); b) с числом углеродных атомов в заместителях – 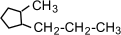 (1-метил-2-пропилциклопентан), (1-метил-2-пропилциклопентан), 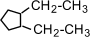 (1,2-диэтилциклопентан) c) с положением заместителя в кольце – (1,2-диэтилциклопентан) c) с положением заместителя в кольце – 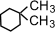 (1,1-диметилциклогексан), (1,1-диметилциклогексан), 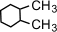 (1,2-диметилциклогексан) (1,2-диметилциклогексан)
2. Межклассовая изомерия: циклоалканы изомерны алкенам (с С3Н6).
3. Геометрическая цис-транс-изомерия:
Например, в молекуле 1,2-диметилциклопропана две группы СН3 могут находиться по одну сторону от плоскости цикла (цис-изомер) или по разные стороны (транс-изомер):
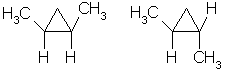
цис-изомер транс-изомер
Получение.
1. Отщепление двух атомов галогена от дигалогеналканов (синтез Густавсона):
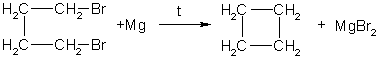
Вместо магния может использоваться цинк.
2. При каталитическом гидрировании ароматических углеводородов образуются циклогексан или его производные:
t°,р,Ni
C6H6 + 3H2 → C6H12.
Химические свойства
1) Гидрирование. При каталитическом гидрировании трех-, четырех- и пятичленные циклы разрываются с образованием алканов.
|
 (циклопропан) + H2 -120ºC,Ni CH3–CH2–CH3 (циклопропан) + H2 -120ºC,Ni CH3–CH2–CH3
 (циклопентан)+ H2-300ºC,PdCH3–CH2–CH2–CH2–CH3 (циклопентан)+ H2-300ºC,PdCH3–CH2–CH2–CH2–CH3
Пятичленный цикл разрывается только при высоких температурах.
|
2) Галогенирование. Циклопропан и циклобутан при галогенировании разрываются, присоединяя атомы галогена
|
 + Br2 BrCH2–CH2–CH2Br (1,3- дибромпропан) + Br2 BrCH2–CH2–CH2Br (1,3- дибромпропан)
|
Циклопарафины с пяти- и шестичленными циклами вступают при галогенировании в обычные для парафинов реакции замещения.
|
 + Cl2 + Cl2  (хлорциклопентан) + HCl (хлорциклопентан) + HCl
|
3)Гидрогалоге-нирование. Циклопропан и циклобутан взаимодействуют с галогеноводородами с разрывом цикла.
|
|
+ HBr CH3–CH2–
|
CH-CH3
│
Br
|
Реакция осуществляется в соответствии с правилом Марковникова. Другие циклопарафины с галогеноводородами не реагируют.
|
4) Дегидрирование.
|
Производные циклогексана дегидрируются в производные бензола:
C6H12 –(Pt, t°C) C6H6 + 3H2
|
5) Нитрование.
|
Для больших циклов характерны реакции замещения, как для алканов: галогенирование на свету, нитрование.
Циклопентан + HNO3 нитроциклопентан + вода.
|
6) Горение
|
С3Н6 + О2 = СО2 + Н2О
|
|
|
|
 Скачать 156 Kb.
Скачать 156 Kb.
 вторичныйтретичный
вторичныйтретичный
 –С–С–С–С первичный
–С–С–С–С первичный 

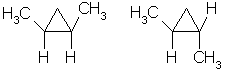
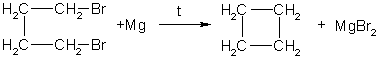


 (циклопропан) + H2 -Pd CH3 –CH2 –CH3(пропан)
(циклопропан) + H2 -Pd CH3 –CH2 –CH3(пропан)


