Статья химия. Аномальные свойства воды
 Скачать 73.43 Kb. Скачать 73.43 Kb.
|
|
АНОМАЛЬНЫЕ СВОЙСТВА ВОДЫ К.А. Пономарева, АГУ г. Майкоп Научный руководитель – к.г.н., доцент Н.П. Очерет Вода в нашей жизни - самое обычное и самое распространенное вещество. Однако с научной точки зрения это самая необычная, самая загадочная жидкость. Это и повлекло за собой выбор темы: «Аномальные свойства воды», при изучении дисциплины «Гидрохимический мониторинг», второй курс факультета естествознания, по специальности «Химия» с дополнительной специальностью «Биология», что дает возможность понять многие явления и процессы, протекающие в живых и растительных клетках, учитывая, что во всяком организме вода представляет собой среду, в которой протекают химические процессы, обеспечивающие жизнедеятельность организма. Кроме того, она сама принимает участие в целом ряде биохимических реакций, а ее аномальные свойства обеспечивают условия для жизни на нашей планете. Литературные источники свидетельствуют о том, что аномальные (уникальные) свойства воды определяются структурой ее молекул, которые состоят из атома кислорода, связанного с двумя атомами водорода полярными ковалентными связями. Более электроотрицательный атом кислорода притягивает электроны атомов водорода сильнее, в результате общие пары электронов смещены в молекулах воды в его сторону. Поэтому, хотя молекула воды в целом не заряжена, каждый из двух атомов водорода имеет частично положительный заряд, а атом кислорода несет частично отрицательный заряд. Молекула воды поляризована и является диполем. В отдельно рассматриваемой молекуле воды ядра водорода и кислорода так расположены друг относительно друга, что образуют как бы равнобедренный треугольник – со сравнительно крупным ядром кислорода в вершине и двумя мелкими ядрами водорода у основания. Каждая молекула воды стремится связаться водородной связью с четырьмя соседними молекулами. [1]. 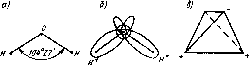 Рис. 1 Строение молекулы воды. а) – угол между связями О-Н, б) – структура электронного облака молекулы, в) – расположение полюсов заряда. Оказывается, все многообразие свойств воды и необычность их проявления в конечном счете определяются физической природой этих атомов и способом их объединения в молекулу. Если строение молекулы воды в общих чертах установлено, то структура воды по-прежнему остается загадкой для ученых. Специфика структуры воды обусловлена особыми свойствами взаимодействий между молекулами воды, где действуют какие-то особые силы, которые отсутствуют в родственных ей гидридах. Эти силы принято называть водородными связями, которые возникают в результате специфического распределения в них электронной плотности на атомах водорода и кислорода [2]. Исследователи считают, что основой структуры является сетка водородных связей, охватывающих все молекулы воды, а многочисленные аномалии воды связанны с ее деформацией, причем сетка водородных связей в воде существует во всем интервале существования жидкости – от точки плавления до точки кипения: с ростом температуры водородные связи не разрываются, а постепенно изменяют свою конфигурацию. 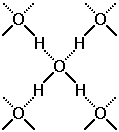 Рис. 2 Водородные связи Изучение строения молекулы воды, физико-химических аномальных свойств, наличие водородных связей между молекулами воды позволило объяснить важнейшую роль воды в жизнедеятельности клетки. Роль воды в клетке очень велика. Полярность молекул и способность образовывать водородные связи делают воду хорошим растворителем для огромного количества неорганических и органических веществ. Кроме того, в качестве растворителя вода обеспечивает как приток веществ в клетку, так и удаление из нее продуктов жизнедеятельности. Не менее важна и чисто химическая роль воды. Под действием некоторых катализаторов – ферментов – она выступает в реакции гидролиза, в результате образуются новые вещества с новыми свойствами. Связанная вода входит в состав некоторых клеточных структур, находясь между молекулами белка, мембранами, волокнами и соединена с некоторыми белками. Кроме того, в живых системах большая часть химических реакций протекает в водных растворах. Вода является теплорегулятором за счет хорошей теплопроводности и большой теплоемкости воды. При изменении температуры окружающей среды внутри клетки температура остается неизменной, то есть вода обладает рядом свойств, имеющих исключительно важное значение для других организмов [3]. Установлено, что ряд удивительных свойств воды связан с ее теплоемкостью. Легче всего вода нагревается и быстрее всего охлаждается в своеобразной «температурной яме», соответствующей +370С – температуре человеческого тела. 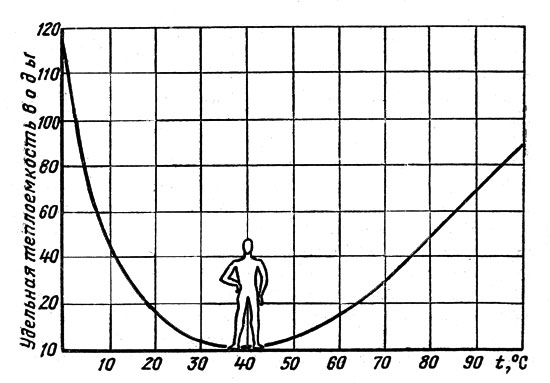 Рис.3 Температурная зависимость удельной теплоемкости воды. Теплоемкость воды своих минимальных значений достигает около +370С. Это нормальная температура тела человека. Именно при температуре +36,60С – +370С сложнейшие реакции обмена веществ в организме человека наиболее интенсивны. Вода в организме человека составляет 70 – 90% от веса тела. Не обладай вода такой теплоемкостью, как сейчас, обмен веществ в теплокровных и холоднокровных организмах был бы не возможен. Такие удивительные свойства воды, помогающие нашему организму сохранять стабильную температуру, имеют значение и для жизни всей нашей планеты. Так, благодаря аномально высокой теплоемкости воды, на континентах не происходит резкого перепада температур зимой и летом, ночью и днем, поскольку они окружены своеобразным термостатом – водами Мирового океана. Летом он не дает Земле перегреваться, а зимой постоянно снабжает континенты теплом. Ни одно вещество в мире не поглощает и не отдает окружающей среде столько тепла, сколько вода. Теплоемкость воды в десять раз больше теплоемкости стали и в тридцать раз больше ртути. Вода сохраняет тепло на Земле. Исследуя воду, особенно ее водные растворы, ученые раз за разом убеждались, что вода обладает аномальными свойствами, присущими только ей. Так, если бы вода была бы нормальным соединением, таким, например, как ее аналоги по шестой группе Периодической системы Д.И. Менделеева Н2S, Н2Sе, Н2Те, то в жидком состоянии вода существовала бы в пределах от минус 950С до минус 700С, а не такая, какая существует сейчас. Ненормальные температуры плавления (00С) и кипения (1000С) воды далеко не единственная аномальность в этом случае. Для всей биосферы исключительной особенностью воды является ее способность при замерзании увеличивать, а не уменьшать свой объем, то есть уменьшать плотность. Вода единственная жидкость на Земле, лед которой не тонет за счет того, что его объем на 1/11 больше объема воды. Если бы лед не всплывал, а тонул, то все бы водоемы промерзали бы до дна, испарение бы резко сократилось, все пресноводные животные и растения погибли бы. Жизнь на Земле стала бы невозможной [4]. Вода практически не сжимается, создавая тургорное давление, определяя объем и упругость клеток и тканей. Так, именно гидростатический скелет поддерживает форму у круглых червей, медуз и других организмов. Высокая удельная теплоемкость и высокая теплопроводность делают воду идеальной жидкостью для поддержания теплого равновесия клетки и организма [5]. Величина вязкости у воды имеет идеальные значения для обеспечения жизненных процессов в организме. Вода характеризуется оптимальным для биологических систем значением силы поверхностного натяжения, которая возникает благодаря образованию между молекулами воды и молекулами других веществ. Благодаря силе поверхностного натяжения происходит капиллярный кровоток, восходящий и нисходящий токи растворов в растениях [6]. Молекулы воды связаны силой поверхностного натяжения, которая позволяет им подниматься вверх по капиллярам, преодолевая силу земного притяжения [7]. Без этого свойства воды жизнь на Земле была бы также невозможна. Таким образом, изучение аномальных свойств воды, по дисциплине «Гидрохимический мониторинг», дало возможность нам, студентам, на основе знаний химии воды понять процессы, протекающие в живых и растительных организмах, и объяснить явления, обеспечивающие условия для жизни на нашей планете. ЛИТЕРАТУРА: Ахметов Н.С. Общая и неорганическая химия. – М. : Высшая школа, 2005. Габриелян О.С. Общая и неорганическая химия : учеб. пособие для студентов учреждений высш. проф. образования / О.С. Габриелян, И.Г. Остроумов, Е.Г. Турбина. – М.: Издательский центр «Академия», 2011. – 480 с. – (Сер. Бакалавриат). Глинка Н.Л. Общая химия: учеб. Пособие для вузов. – Л. : Химия, 2001. Неорганическая химия. Т. 2, 3. / А.А. Дроздов, В.П. Зломанов, Г.Н. Мазо, Ф.М. Спиридонов ; под ред. Ю.Д. Третьякова. – М. : Издательский центр «Академия», 2004 – 2006. Варламов С. Тепловые свойства воды // Квант, №3, 2002. Неорганическая химия. Т. 1 / М.Е. Тамм, Ю.Д. Третьяков ; под ред. Ю.Д. Третьякова. – М .: Издательский центр «Академия», 2004. Неорганическая химия элементов / Ю.Д. Третьяков, Л.И. Мартыненко, А.Н. Григорьев и др. – Кн. 1, 2. М. : Химия, 2007. |
