Биохимия. Апофермент и Кофермент
 Скачать 168.64 Kb. Скачать 168.64 Kb.
|
|
Министерство образования и науки Российской Федерации РОССИЙСКИЙ ГОСУДАРСТВЕННЫЙ СОЦИАЛЬНЫЙ УНИВЕРСИТЕТ (РГСУ) Факультет физической культуры РЕФЕРАТ по дисциплине «Биохимия человека» на тему «Апофермент и Кофермент» Выполнил: студент группы ФК-1 Руденко Р.А. Проверил: преподаватель Карташев В. П. Москва 2020 Оглавление Введение Основная часть Выводы Список реферируемой литературы Введение Тема данного реферата: «Апоферменты и Коферменты». Насколько мы знаем в нашем организме действует очень много ферментов, которые способствуют осуществлению обменных процессов(ускорению)-дыхание, пищеварение, мышечное сокращение, фотосинтез, которые и определяют сам процесс жизни Предмет исследования реферата-Что же такое ферменты, и какую роль они играют в организме. Метод исследования — реферирование и краткий анализ литературы по данной теме, её обобщение и сравнение. Основная часть Ферменты могут быть простыми белками, но гораздо чаще – сложными. Их небелковая часть именуется кофермент, которая, комплексируясь с апоферментом, способна участвовать в разных реакциях. Белковая часть энзима определяет локализацию фермента в клетке; за счёт своего заряда способен крепиться к органоидам и находиться строго в одном месте, что позволяет выделить следующие виды его организации: внутриклеточная разрозненная, когда энзимы разбросаны по клетке; структурно-функциональная — мультиэнзимный комплекс, связанный с мембраной, когда продукт предыдущей реакции служит субстратом следующей. Органоспецифичная, в этом случае ферменты регистрируются в определённом органе. Аргиназа – участник синтеза мочевины, находится только в гепатоцитах, а кислая фосфатаза, гидролизующая моноэфиры ортофосфорной кислоты, — в клетках простаты. Апофермент отвечает за специфичность действия катализатора. Каждому энзиму часто соответствует определённый субстрат (сорбитол-ДГ окисляет только сорбитол). Из сближенных при укладке белка фрагментов строится активный центр. Радикалы поверхностно расположенных аминокислот способны связываться с различными соединениями, что меняет активность фермента (работа аллостерического центра). Ни сам по себе апофермент каталитической активностью не наделены, и только их комплекс (холофермент) активен. При упаковке белка-фермента в пространстве формируется активный центр, куда пристраивается субстрат, который должен обладать комплементарностью. Существует аллостерический центр, группировки которого обладают лигандностью и образуют непрочные связи с другими по природе веществами. В конечном итоге это приводит к сдвигам в конформации активного центра, изменяя степень его комплементарности к субстрату, что влияет на активность фермента. Энзимы имеют не только третичную структуры, но и более сложную организацию. Это – мультимеры, которые включают парное число протомеров, например, как КФК, ЛДГ 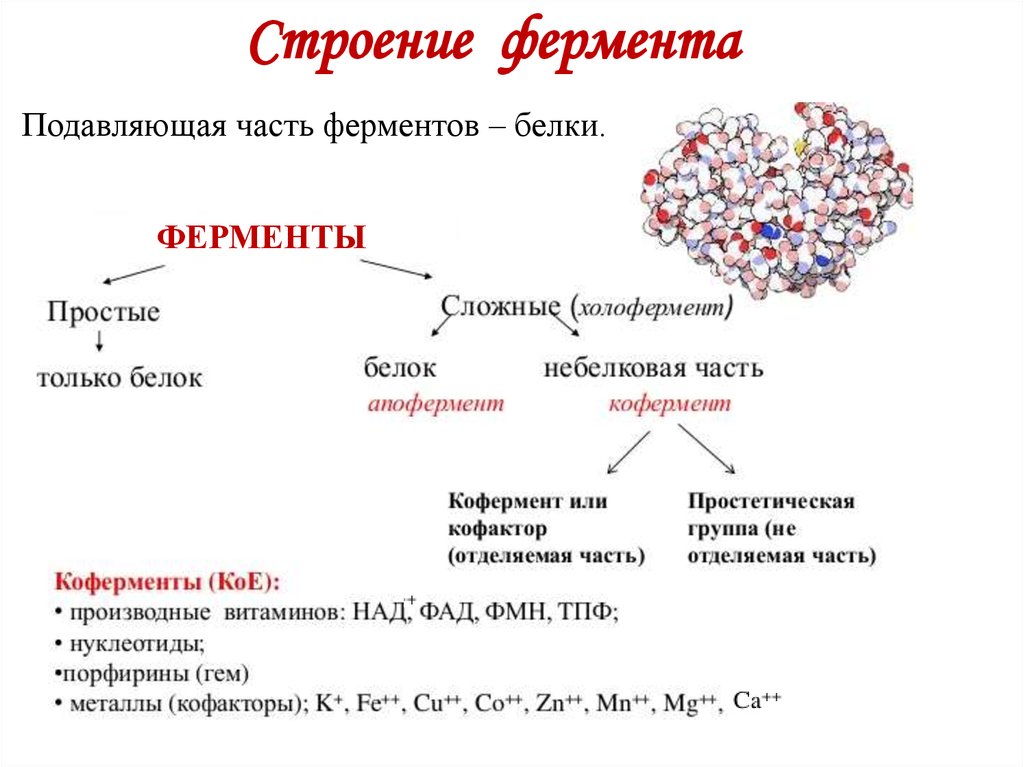 Механизм действия энзимов и его регуляция Главным условием эффективной деятельности биокатализатора является образование фермент-субстратного комплекса. При этом группировки активного центра, имеющие обязательно полярное строение, смещают электроны к одному из атомов разрываемой связи, что резко снижает прочность и приводит к её разрыву с образованием продукта реакции. Из-за нарушения комплементарности он теряет способность крепиться к активному центру и освобождается. На скорости катализируемой реакции сказываются концентрации субстратов, ферментов, коферментов (прямая зависимость), наличие эффекторов (активаторов и ингибиторов) – веществ, изменяющих конформацию активного центра или взаимодействующих с группировками апофермента, что приводит к перестройке последнего и отсюда – сдвигам в укладке активного центра, делая его более, или менее комплементарным субстрату. В зависимости от локализации образующейся связи и её прочности различают следующие виды ингибирования: а) конкурентное и неконкурентное; б) обратимое и необратимое. Первый вариант основан на том, с каким центром взаимодействует эффектор. Если он обладает структурным сходством с субстратом, то, способен встраиваться в активный центр. Если ингибитор не имеет структурного сходства с субстратом и взаимодействует с аллостерическим центром, то возникает неконкурентное ингибирование. Физиологические ингибиторы образуют с энзимами непрочные связи, что позволяет восстановить деятельность фермента (обратимое ингибирование). Токсический эффект различных ядов объясняется их способностью образовывать прочные комплексы с биокатализаторами (необратимое ингибирование). Активаторы ускоряют реакции за счет различных катионов металлов или анионов (фосфорилирование). Активация протеаз в ЖКТ идет за счет частичного протеолиза. Чтобы предотвратить гидролиз собственных мембранных белков, эти ферменты синтезируются в виде зимогенов (проферментов); и только попав в полость соответствующего органа, они активируются. Очень чувствительны каталитические белки к колебаниям температуры и рН среды. Первый показатель, находясь в пределах оптимума (примерно 400 у человека в клетках), способствует образованию Е-S –комплексов в максимальных количествах; гипертермия на 1-1,50 увеличивает скорость движения частиц в среде, тем самым препятствует комплексированию энзима с субстратом. Гипотермия, замедляя сближение молекул, снижает число эффективных столкновений. Сдвиги рН провоцируют изменения степени ионизации группировок активного центра, изменяя активность фермента. Существуют несколько видовспецифичности энзимов. Стереохимическая специфичность. Фермент катализирует превращение только одного из возможных стереоизомеров субстрата. Имея абсолютно субстрастную спецефичность, биокатализатор работает лишь с одним веществом, а при групповой катализирует превращение группы субстратов, сходных по строению. Аргиназа разрушает связи только в аргинине. Относительная (групповая) специфичность свидетельствует о том, что фермент может повреждать связи в различных субстратах. Цитохром Р может гидроксилировать около 7000 соединений как природных, так и ксенобиотиков. Большинство протеаз, осуществляющих гидролиз белков как животного, так и растительного происхождения, расщепляет пептидные связи. Панкреатическая липаза гидролизует молекулу любого жира. Термин «кофермент» был предложен Г. Бертраном в 1897 г. для обозначения функции солей марганца, которые он считал специфическим кофактором фенол азы (лакказы); однако теперь неорганические компоненты ферментных систем не принято относить к числу К. Существование истинного (органического) К. впервые установили англ. биохимики Харден (A. Harden) и Янг (W. Young) в 1904 г., показавшие, что из ферментных экстрактов дрожжевых клеток при диализе удаляется термостабильное органическое вещество, необходимое для действия ферментного комплекса, катализирующего спиртовое брожение (см.). Этот вспомогательный катализатор брожения Харден и Янг назвали козимазой; его строение было установлено в 1936 г. в лабораториях X. Эйлер- Xeльпина и О. Варбурга почти одновременно. КОФЕРМЕНТЫ (син. коэнзимы) — низкомолекулярные органические соединения биологического происхождения, необходимые в качестве дополнительных специфических компонентов (кофакторов) для осуществления каталитического действия ряда ферментов. Многие К. представляют собой производные витаминов. Биол, эффект значительной группы витаминов (группы В) определяется их превращением в К. и ферменты в клетках организма. Были сделаны попытки (и небезуспешные) прямого использования некоторых К. с леч. целями. Трудности, которые при этом возникают, состоят в том, что не всегда производятся количественные определения содержания К. в крови и органах и еще реже определяется активность ферментов, синтезирующих или разрушающих исследуемые К., в норме и патологии. Обнаруженный при каком-либо заболевании недостаток того или иного К. обычно пытаются устранить, вводя в организм соответствующий витамин. Но если нарушены системы синтеза недостающего К., что нередко имеет место, то введение такого витамина теряет смысл: терапевтический эффект можно получить только введением недостающего кофермента. С леч. целями применяют кокарбоксилазу (Тимии), ФАД, коферментные формы витамина В12 (см. цианоЦианокобаламин) и некоторые другие К. В леч. целях К. вводят парентерально, но и при этом условии не всегда имеется уверенность, что они могут без расщепления проникнуть к месту своего действия (во внутриклеточную среду). Обладая небольшим мол. весом, К., в отличие от биокатализаторов белковой природы (ферментов), характеризуются термостабильностью и доступностью диализу. Дыхательные хромогены растений (полифенолы), глутаминовую к-ту, орнитин, бисфосфаты (дифосфаты) глюкозы и глицериновой к-ты и другие метаболиты, действующие при определенных обстоятельствах как кофакторы ферментативных процессов переноса, нередко обозначают как К. соответствующих процессов. Правильнее применять термин «кофермент» только к соединениям, биол, функция которых сводится целиком или преимущественно к их специфическому участию в действии ферментов 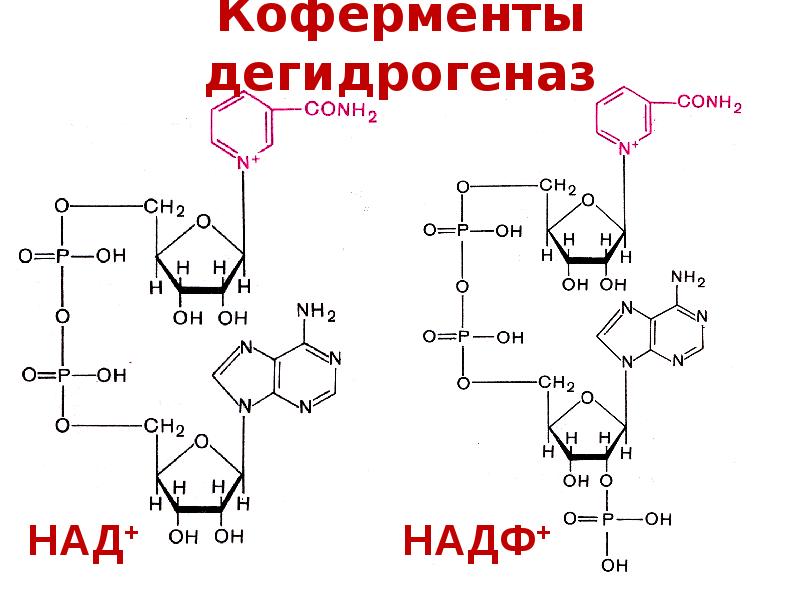 Коферменты нуклеотидной природы. Адениловые рибонуклеотиды (аденозин-5'-моно-, ди- и трифосфорные к-ты) участвуют в многочисленных реакциях активирования и переноса орто- и пирофосфатных остатков, остатков аминокислот (аминоацилов), угольной и серной к-т, а также в ряде других ферментативных превращений. Аналогичные функции в определенных случаях выполняют производные инозин-5'-фосфорной и гуанозин-5'-фосфорной к-т. Гуаниловые рибоиуклеотиды (гуанозин-5'-моно-, ди- и трифосфорные к-ты) играют роль К. при реакциях переноса остатка янтарной к-ты (сукцинила), биосинтезе рибонуклеопротеидов в микросомах, биосинтезе адениловой к-ты из инозиновой и, возможно, при переносе остатков маннозы. Цитидиловые рибонуклеотиды (цитидин-5'-фосфорные к-ты) при биосинтезе фосфатидов играют роль К. переноса остатков О-фосфоэтанол холина, О-фосфоэтаноламина и т. д. Уридиловые рибонуклеотиды (уридин-5'-фосфорные к-ты) выполняют функции К. в процессах трансгликозилирования, т. е. переноса остатков моноз (глюкозы, галактозы и др.) и их производных (остатков гексозаминов, глюкуроновой к-ты и т. п.) при биосинтезе ди- и полисахаридов, глюкуронозидов, гексозаминидов (мукополисахаридов), а также при активировании остатков сахаров и их производных в некоторых других ферментативных процессах (напр., взаимопревращении глюкозы и галактозы и др.). Никотинамидадениндинуклеотид (НАД) участвует в важнейших для клеточного обмена реакциях переноса водорода в качестве специфического К. многочисленных дегидрогеназ (см.). Никотинамидадениндинуклеотидфосфат (НАДФ) участвует в важнейших для клеточного обмена реакциях переноса водорода в качестве специфического К. некоторых дегидрогеназ. Флавинмононуклеотид (ФМН) участвует в биол, переносе водорода как К. (простетическая группа) некоторых флавиновых («желтых») окислительных ферментов. Флавинадениндинуклеотид (ФАД) участвует в биол, переносе водорода как К. (простетическая группа) большинства флавиновых («желтых») окислительных ферментов. Коферменты пептидной природы. Кофермент формилирования. Восстановленная фолиевая к-та и ее производные, содержащие три или семь остатков глутаминовой к-ты, соединенных гамма-пептидными связями, играют роль К. в промежуточном обмене так наз. одноуглеродных, или «C1», остатков (формила, оксиметила и метила), участвуя как в реакциях переноса этих остатков, так и в их окислительно-восстановительных взаимопревращениях. Формильные и оксиметильные производные Н4-фолиевой к-ты являются «активными формами» муравьиной к-ты и формальдегида в процессах биосинтеза и окисления метильных групп, в обмене серина, глицина, гистидина, метионина, пуриновых оснований и т. д. Глутатион. Восстановленный глутатион (Г-SH) действует по типу К. при превращении метилглиоксаля в молочную к-ту под влиянием глиоксалазы, при ферментативной дегидрогенизации формальдегида, в определенных стадиях биол, окисления тирозина и т. д. Кроме того, глутатион (см.) играет большую роль в защите различных тиоловых (сульфгидрильных) ферментов от инактивирования в результате окисления SH-групп или связывания их тяжелыми металлами и другими SH-ядами. Выводы Итак, комплекс кофермента и апофермента образует целостную, биологически активную молекулу фермента, называемую холоферментом. Роль коферментов нередко играют витамины или их метаболиты Коферменты необходимы в качестве дополнительных специфических компонентов (кофакторов) для осуществления каталитического действия ряда ферментов Список реферируемой литературы Библиография: Болдуин Э. Основы динамической биохимии, пер. с англ., с. 55 и др., М., 1949; Витамины, под ред. М. И. Смирнова, М., 1974; Д и к с о н М. и У э б б Э. Ферменты, пер. с англ., М., 1966; Коферменты, под ред. В. А. Яковлева, М., 1973; Кочетов Г. А. Тиамино-вые ферменты, М., 1978, библиогр.; Ферменты, под ред. А. Е. Браунштейна, с. 147, М., 1964, библиогр. |
