Элементы 2(A) группы. Элементы 2 группы. Атомы элементов 2(IIa) группы
 Скачать 132 Kb. Скачать 132 Kb.
|
|
Атомы элементов 2(IIa) группы Во 2 группу (IIa группу по старой классификации) периодической таблицы химических элементов Д. И. Менделеева входят 6 металлов: бериллий, магний, кальций, стронций, барий, радий (см. таблицу выше). Последние четыре - Ca, Sr, Ba, Ra называют щелочноземельными металлами, поскольку гидроксиды этих металлов обладают щелочными свойствами, а их оксиды по своей тугоплавкости похожи на оксиды тяжелых металлов, называемых ранее "землями". Самым распространенным в земной коре элементом 2(IIa) группы является кальций (4,1% по массе), далее идут: магний (2,3%), барий (0,05%), стронций (0,037%), бериллий (0,00026%), радий (6·10-11). Наиболее важным элементом подгруппы берилия является кальций, который входит в состав костей всех животных и человека, определяя их прочность. Концентрация ионов кальция и магния в воде определяет ее жесткость. Элементы 2(IIa) группы в свободном виде в природе не встречаются, но входят в состав многих соединений: Be: 3BeO·Al2O3·SiO2 - минерал берилл; берилл с примесью Cr2O3 - изумруд; берилл с примесью Fe - аквамарин; (BeAl2)O4 - хризоберилл; (BeAl2)O4 с примесью Cr - александрит. Mg: MgCO3·CaCO3 - доломит; MgCO3 - магнезит; MgO·Al2O3 - шпинель; 2MgO·SiO3 - оливин; магний содержится в морской воде, а также входит в состав хлорофилла - важнейшей части фотосинтезирующего аппарата растений. Ca: CaCO3 - кальцит; CaSO4·2H2O - гипс; CaF2 - флюорит; Ca5(PO4)3F - фторапатит; Ca3(PO4)2 - фосфат кальция. Sr и Ba встречаются в виде карбонатов и сульфатов. Физические свойства: металлы II группы имеют серебристо-белый цвет; низкую плотность (плотность увеличивается в подгруппе сверху-вниз); низкую температуру плавления (температуры плавления уменьшаются в подгруппе сверху-вниз); обладают высокой пластичностью; высокой электро- и теплопроводностью. Все атомы элементов 2(IIa) группы на внешнем энергетическом уровне имеют по два валентных s-электрона (см. Электронная конфигурация атомов), с которыми в химических соединениях достаточно легко "расстаются", завершая, таким образом, свой внешний энергетический уровень, который становится устойчивым, по аналогии с завершенным энергетическим уровнем инертных газов. 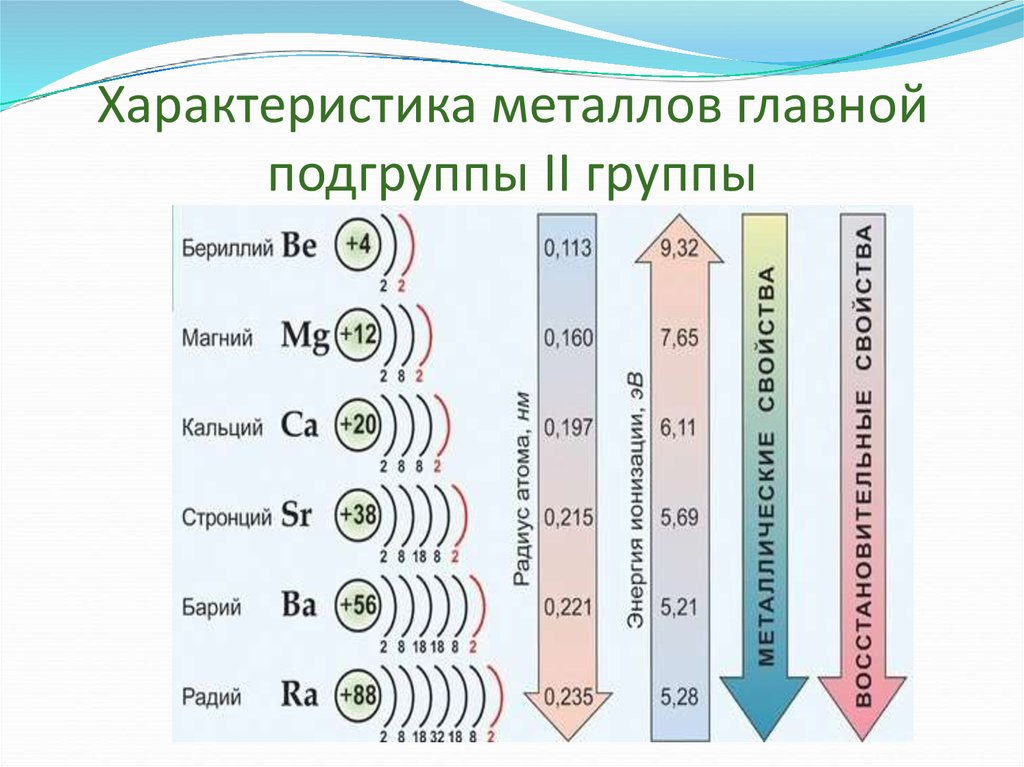 |
