Ответы на билеты биохимия 2012. Белок это последовательность ак, связанных друг с другом пептидными связями
 Скачать 5.15 Mb. Скачать 5.15 Mb.
|
|
4. применение ингибиторов ферментов (Весьма широко применяются в настоящее время ингибиторы протеаз (контрикал, гордокс) при панкреатитах – состояниях, когда происходит активирование пищеварительных ферментов в протоках и клетках поджелудочной железы. Ингибиторы холинэстеразы (физостигмин, прозерин) приводят к накоплению нейромедиатора ацетилхолина в синапсах и показаны при миастении, двигательных и чувствительных нарушениях при невритах, радикулитах, психогенной импотенции. Препараты, содержащие ингибиторы моноаминоксидазы (наком, мадопар), повышают выработку нейромедиаторов катехоламинов в ЦНС при лечении паркинсонизма. Подавление активности моноаминооксидазы (разрушающей катехоламины) сохраняет нормальную передачу сигналов в нервной системе. Ингибиторы ангиотензинпревращающего фермента (каптоприл, эналаприл и т.п.) используются как антигипертензивное средство и вызывают расширение периферических сосудов, уменьшение нагрузки на миокард, снижение артериального давления. Аллопуринол – ингибитор ксантиноксидазы, фермента катаболизма пуринов, требуется для снижения образования мочевой кислоты и подавления развития гиперурикемии и подагры. Ингибиторы гидроксиметилглутарил-SКоА-редуктазы (ловастатин, флувастатин, аторвастатин) применяются для снижения синтеза холестерола при атеросклерозе, заболеваниях сердечно-сосудистой системы, дислипопротеинемиях. Ингибитор карбоангидразы (ацетазоламид) используется как мочегонное средство при лечении глаукомы, отеков, эпилепсии, алкалозах и горной болезни). 8. Понятие о катаболизме и анаболизме и их взаимосвязи. Эндергонические и экзергонические реакции в метаболизме. Способы передачи электронов. Особенности протекания окислительных реакций в организме. Этапы расщепления веществ и освобождения энергии (этапы катаболизма). Метаболизм представляет собой высоко координированную и целенаправленную клеточную активность, обеспеченную участием многих взаимосвязанных ферментативных систем, и включает два неразрывных процесса анаболизм и катаболизм. Он выполняет три специализированные функции: 1. Энергетическая – снабжение клетки химической энергией, 2. Пластическая – синтез макромолекул как строительных блоков, 3. Специфическая – синтез и распад биомолекул, необходимых для выполнения специфических клеточных функций. Анаболизм – это биосинтез белков, полисахаридов, липидов, нуклеиновых кислот и других макромолекул из малых молекул-предшественников. Поскольку он сопровождается усложнением структуры, то требует затрат энергии (эндергонические реакции). Источником такой энергии является энергия АТФ. Также для биосинтеза некоторых веществ (жирные кислоты, холестерол) требуются богатые энергией атомы водорода – их источником является НАДФН. Молекулы НАДФН образуются в реакциях окисления глюкозо-6-фосфата в пентозном пути и оксалоацетата малик-ферментом. В реакциях анаболизма НАДФН передает свои атомы Н2 на синтетические реакции и окисляется до НАДФ. Так формируется НАДФ-НАДФН-цикл. Катаболизм – расщепление и окисление сложных органических молекул до более простых конечных продуктов. Оно сопровождается высвобождением энергии, заключенной в сложной структуре веществ (экзергонические реакции). Большая часть высвобожденной энергии рассеивается в виде тепла. Меньшая часть этой Е "перехватывается" коферментами окислительных реакций НАД и ФАД, некоторая часть сразу используется для синтеза АТФ. Следует заметить, что атомы водорода, высвобождаемые в реакциях окисления веществ, могут использоваться клеткой только по двум направлениям: 1)на анаболические реакции в составе НАДФН; 2)на образование АТФ в митохондриях при окислении НАДН и ФАДН2 . Весь катаболизм условно подразделяется на три этапа: I этап. Специфический. Происходит в кишечнике (переваривание пищи) или в лизосомах при расщеплении уже ненужных молекул. При этом освобождается около 1% энергии, заключенной в молекуле. Она рассеивается в виде тепла. II этап. Специфический. Вещества, образованные при внутриклеточном гидролизе или проникающие в клетку из крови, на втором этапе обычно превращаются в пировиноградную кислоту, ацетильную группу (в составе ацетил-S-КоА) и в некоторые другие мелкие органические молекулы. Локализация второго этапа – цитозоль и митохондрии. Часть энергии рассеивается в виде тепла и примерно 13% энергии вещества усваивается, т.е. запасается в виде макроэргических связей АТФ. III этап. Общий, неспецефический. Все реакции этого этапа идут в митохондриях. Ацетил-SКоА включается в реакции цикла трикарбоновых кислот и окисляется до углекислого газа. Выделенные атомы водорода соединяются с НАД и ФАД и восстанавливают их. После этого НАДН и ФАДН2 переносят водород в цепь дыхательных ферментов, расположенную на внутренней мембране митохондрий. Здесь в результате процесса под названием "окислительное фосфорилирование" образуется вода и главный продукт биологического окисления – АТФ. Часть выделенной на этом этапе энергии молекулы рассеивается в виде тепла и около 46% энергии исходного вещества усваивается, т.е. запасается в связях АТФ и ГТФ. Окислительно-восстановительными называются такие реакции, в процессе которых происходит перенос электронов от восстановителя к окислителю. Существует четыре способа передачи электронов от одной молекулы к другой: 1. Прямой перенос электронов.2. Перенос электрона в составе атома водорода.3. Перенос двух электронов в составе гидрид-иона.4. Перенос электронов на О2 путем присоединения оного к молекуле-восстановителю. Процессы катаболизма в клетках животных сопровождаются потреблением кислорода, который необходим для реакций окисления. В результате этих реакций происходит освобождение энергии, которая необходима организмам в процессах жизнедеятельности для осуществления различных видов работы. Небиологические системы могут совершать работу за счёт тепловой энергии, биологические системы функционируют в изотермическом режиме и для осуществления процессов жизнедеятельности используют химическую энергию. Под окислением понимают отщепление электронов, а под восстановлением - присоединение электронов. Окисление донора электронов всегда сопровождается восстановлением акцептора электронов. Этот принцип окислительно-восстановительных процессов применим и к биохимическим системам. В любой окислительно-восстановительной реакции участвует акцептор электронов (окислитель) и донор электронов (восстановитель). В каждой из них участвует окисленная и восстановленная форма одного соединения; их называют сопряжённой парой, или редокспарой. Способность восстановителя отдавать электрон окислителю выражают стандартным окислительно-восстановительным потенциалом (Е0). Величину окислительно- восстановительного потенциала (в вольтах) конкретной окислительно-восстановительной пары определяют путем сравнения со стандартом. Чем выше величина стандартного окислительно-восстановительного потенциала некоторой окислительно-восстановительной пары, тем выше способность этой пары принимать электроны. Поток электронов всегда направлен таким образом, чтобы в результате свободная энергия системы уменьшалась. Е, высвобождаемая в реакциях катаболизма, запасается в виде связей, называемых макроэргическими. Основной и универсальной молекулой, которая запасает энергию и при необходимости отдает ее, является АТФ. Все молекулы АТФ в клетке непрерывно участвуют в каких-либо реакциях, постоянно расщепляются до АДФ и вновь регенерируют. Существует три основных способа использования АТФ:1)биосинтез веществ, 2)транспорт веществ через мембраны, 3)изменение формы клетки и ее движение. Эти процессы вкупе с процессом образования АТФ получили название АТФ-цикл. 9. Оксидоредуктазы. Классификация. Характеристика подклассов. НАД-зависимые дегидрогеназы. Строение окисленной и восстановленной форм. Важнейшие субстраты НАД-зависимых дегидрогеназ. ФАД-зависимые дегидрогеназы: сукцинатдегидрогеназа и ацилКоА-дегидрогеназа. Ферменты этого класса катализируют окислительно-восстановительные реакции, лежащие в основе биологического окисления. Класс насчитывает 22 подкласса. Коферментами этого класса являются НАД, НАДФ, ФАД, ФМН, убихинон, глутатион, липоевая кислота. Примером подклассов могут служить ферменты, действующие на СН-ОН-группу доноров, на СH-СН-группу доноров, на СН-NН2-группу доноров, на гемсодержащие доноры. Наиболее распространены следующие рабочие названия оксидоредуктаз: 1. Дегидрогеназы – оксидоредуктазы, катализирующие дегидрирование субстрата с использованием в качестве акцептора водорода любых молекул, кроме кислорода. 2. Если перенос водорода от молекулы донора трудно доказуем, то такие оксидоредуктазы называют редуктазами. 3. Оксидазы – оксидоредуктазы, катализирующие окисление субстратов с молекулярным кислородом в качестве акцептора электронов без включения кислорода в молекулу субстрата. 4. Монооксигеназы – оксидоредуктазы, катализирующие внедрение одного атома кислорода в молекулу субстрата с молекулярным кислородом в качестве донора кислорода. 5. Диоксигеназы – оксидоредуктазы, катализирующие внедрение 2 атомов кислорода в молекулу субстрата с молекулярным кислородом в качестве донора кислорода. 6. Пероксидазы – оксидоредуктазы, катализирующие реакции с пероксидом водорода в качестве акцептора электронов. Систематическое название образуется: Донор электронов : акцептор электронов – оксидоредуктаза. Первичные акцепторы водорода окислительно-восстановительных реакций относят к 2 типам дегидрогеназ: никотинамвдзависимым, содержащим в качестве коферментов производные никотиновой кислоты, и флавинзависимым, содержащим производные рибофлавина. Как уже было сказано, для проявления каталитической активности большинству ферментов необходимо наличие кофермента. Кофермент, локализуясь в каталитическом участке активного центра, принимает непосредственное участие в химической реакции, выступая в качестве акцептора и донора химических группировок, атомов, электронов. Кофермент может быть связан с белковой частью молекулы ковалентными и нековалентными связями. В первом случае он называется простетической группой (пр: FAD, FMN, биотин). Во втором случае кофермент взаимодействует с ферментом только на время химической реакции и может рассматриваться в качестве второго субстрата. Примеры - NAD+, NADP+. Н 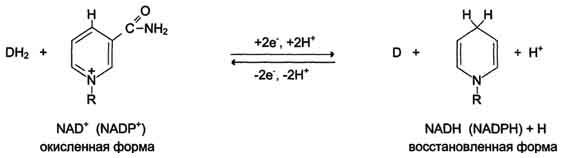 икотинамидзависимые дегидрогеназы содержат в качестве коферментов NAD+ или NADP+, NAD+ и NADP+ - производные витамина PP. Эти коферменты входят в состав активных центров дегидрогеназ, но могут обратимо диссоциировать из комплекса с апоферментами и включаются в состав фермента в ходе реакции. Субстраты NAD- и NADP-зависимых дегидрогеназ находятся в матриксе митохондрий и в цитозоле. Рабочей частью никотинамидных коферментов служит никотинамид . Большинство дегидрогеназ, поставляющих электроны в ЦПЭ, содержат NAD+. Они катализируют реакции типа: R-CHOH-R1 + NAD+↔ R-CO-R1 + NADH + Н+. икотинамидзависимые дегидрогеназы содержат в качестве коферментов NAD+ или NADP+, NAD+ и NADP+ - производные витамина PP. Эти коферменты входят в состав активных центров дегидрогеназ, но могут обратимо диссоциировать из комплекса с апоферментами и включаются в состав фермента в ходе реакции. Субстраты NAD- и NADP-зависимых дегидрогеназ находятся в матриксе митохондрий и в цитозоле. Рабочей частью никотинамидных коферментов служит никотинамид . Большинство дегидрогеназ, поставляющих электроны в ЦПЭ, содержат NAD+. Они катализируют реакции типа: R-CHOH-R1 + NAD+↔ R-CO-R1 + NADH + Н+. Т.о. NAD+, присоединяя протоны и электроны от различных субстратов, служит главным коллектором энергии окисляемых веществ и главным источником электронов, обладающих высоким энергетическим потенциалом, для ЦПЭ. NADPH не является непосредственным донором электронов в ЦПЭ, а используется почти исключительно в восстановительных биосинтезах. Однако возможно включение электронов с NADPH в ЦПЭ благодаря действию пиридиннуклеотид трансгидрогеназы, катализирующей р-ию: NADPH + NAD+ ↔ NADP+ + NADH. Флавиновые дегидрогеназы содержат в качестве коферментов FAD или FMN. Эти коферменты образуются в организме человека из витамина В2. Флавиновые коферменты прочно связаны с апоферментами. Рабочей частью FAD и FMN служит изоаллоксазиновая сопряжённая циклическая система. FAD служит акцептором электронов от многих субстратов в реакциях типа: R-CH2-CH2-R1 + Е (FAD) ↔ R-CH=CH-R1 + Е (FADH2), где Е - белковая часть фермента. Б  ольшинство FAD-зависимых дегидрогеназ - растворимые белки, локализованные в матриксе митохондрий. Исключение составляет сукцинат-дегидрогеназа, находящаяся во внутренней мембране митохондрий. К FMN-содержащим ферментам принадлежит NADH-дегидрогеназа, которая также локализована во внутренней мембране митохондрий; она окисляет NADH, образующийся в митохондриальном матриксе. ольшинство FAD-зависимых дегидрогеназ - растворимые белки, локализованные в матриксе митохондрий. Исключение составляет сукцинат-дегидрогеназа, находящаяся во внутренней мембране митохондрий. К FMN-содержащим ферментам принадлежит NADH-дегидрогеназа, которая также локализована во внутренней мембране митохондрий; она окисляет NADH, образующийся в митохондриальном матриксе.10. Окислительное декарбоксилирование пирувата и цикл Кребса: последовательность реакций, связь с дыхательной цепью, регуляция, значение. Окислительное декарбоксилирование пирувата происходит в матриксе митохондрий. Пировиноградная кислота (ПВК, пируват) является продуктом окисления глюкозы и некоторых аминокислот. Ее судьба различна в зависимости от доступности кислорода в клетке. В анаэробных условиях она восстанавливается до молочной кислоты. В аэробных условиях пируват симпортом с ионами Н+, движущимися по протонному градиенту, проникает в митохондрии. Здесь происходит его превращение до уксусной кислоты, переносчиком которой служит коэнзим А. Превращение пирувата в ацетил-КоА описывают следующим суммарным уравнением: СН3-СО-СООН + NAD+ + HSKoA → CH3-CO ∼SKoA + NADH + H+ + CO2 Превращение состоит из пяти последовательных реакций, осуществляется мультиферментным комплексом, прикрепленным к внутренней митохондриальной мембране со стороны матрикса. В составе комплекса насчитывают 3 фермента и 5 коферментов: 1) Пируватдегидрогеназа (Е1, ПВК-дегидрогеназа), ее коферментом является тиаминдифосфат (ТДФ), катализирует 1-ю реакцию. 2)Дигидролипоат-ацетилтрансфераза (Е2), ее коферментом является липоевая кислота, катализирует 2-ю и 3-ю реакции. 3)Дигидролипоат-дегидрогеназа (Е3), кофермент – ФАД, катализирует 4-ю и 5-ю реакции. Помимо указанных коферментов, которые прочно связаны с соответствующими ферментами, в работе комплекса принимают участие коэнзим А и НАД. Суть первых трех реакций сводится к декарбоксилированию пирувата (катализируется пируватдегидрогеназой, Е1), окислению пирувата до ацетила и переносу ацетила на коэнзим А (катализируется дигидролипоамид-ацетилтрансферазой, Е2). О 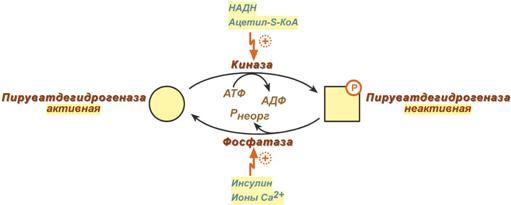 ставшиеся 2 реакции необходимы для возвращения липоевой кислоты и ФАД в окисленное состояние (катализируются дигидролипоат-дегидрогеназой, Е3). При этом образуется НАДН. ставшиеся 2 реакции необходимы для возвращения липоевой кислоты и ФАД в окисленное состояние (катализируются дигидролипоат-дегидрогеназой, Е3). При этом образуется НАДН.Регулируемым ферментом ПВК-дегидрогеназного комплекса является первый фермент – пируватдегидрогеназа (Е1). Два вспомогательных фермента – киназа и фосфатаза обеспечивают регуляцию активности пируватдегидрогеназы путем ее фосфорилирования и дефосфорилирования. Вспомогательный фермент киназа активируется при избытке конечного продукта биологического окисления АТФ и продуктов ПВК-дегидрогеназного комплекса – НАДН и ацетил-S-КоА. Активная киназа фосфорилирует пируватдегидрогеназу, инактивируя ее, в результате первая реакция процесса останавливается. Фермент фосфатаза, активируясь ионами кальция или инсулином, отщепляет фосфат и активирует пируватдегидрогеназу. Таким образом, работа пируватдегидрогеназы подавляется при избытке в митохондрии (в клетке) АТФ и НАДН, что позволяет снизить окисление пирувата и, следовательно, глюкозы в случае когда энергии достаточно. Если АТФ мало или имеется влияние инсулина, то образуется ацетил-SКоА. Последний в зависимости от условий будет направляться либо в цикл трикарбоновых кислот с образованием энергии АТФ, либо на синтез холестерина и жирных кислот. Образующийся в ПВК-дегидрогеназной реакции ацетил-SКоА далее вступает в цикл трикарбоновых кислот (ЦТК, цикл лимонной кислоты, цикл Кребса). Кроме пирувата, в цикл вовлекаются кетокислоты, поступающие из катаболизма аминокислот или каких-либо иных веществ. Цикл Кребса протекает в матриксе митохондрий и представляет собой восемь последовательных реакций: связывание ацетила и оксалоацетата (щавелевоуксусной кислоты) с образованием лимонной кислоты, изомеризация лимонной кислоты и последующие реакции окисления с сопутствующим выделением СО2. После восьми реакций цикла вновь образуется оксалоацетат. Основная роль ЦТК заключается в генерации атомов водорода для работы дыхательной цепи, а именно трех молекул НАДН и одной молекулы ФАДН2. Кроме этого, в ЦТК образуется одна молекула АТФ, сукцинил-SКоА, участвующий в синтезе гема, кетокислоты, являющиеся аналогами АК – α-кетоглутарат для глутаминовой кислоты, оксалоацетат для аспарагиновой. Главным и основным регулятором ЦТК является оксалоацетат, а точнее его доступность. Наличие оксалоацетата вовлекает в ЦТК ацетил-SКоА и запускает процесс. Обычно в клетке имеется баланс между образованием ацетил-SКоА (из глюкозы, жирных кислот или аминокислот) и количеством оксалоацетата. Источником оксалоацетата является глюкоза (синтез из пирувата в анаплеротической реакции), поступление из фруктовых кислот самого цикла (яблочной, лимонной), образование из аспарагиновой кислоты в результате трансаминирования. Примером существенной роли оксалоацетата служит активация синтеза кетоновых тел и кетоацидоз плазмы крови при недостаточном количестве оксалоацетата в печени. Такое состояние наблюдается при инсулинзависимом сахарном диабете, при голодании, алкогольном отравлении или длительной физической нагрузке. Также некоторые ферменты ЦТК являются чувствительными к аллостерической регуляции метаболитами: Ингибиторы Активаторы Цитратсинтаза АТФ, цитрат, НАДН, ацил-S-КоА Изоцитрат-дегидрогеназа АТФ, НАДН АМФ, АДФ α-Кетоглутарат-дегидрогеназа Сукцинил-S-КоА, НАДН цАМФ Ацетил-СоА является ключевым промежуточным соединением в превращении всех основных питательных веществ. В аэробных условиях он образуется изсахаров при окислительном декарбоксилировании пировиноградной кислоты, липидов при β-окислении жирных кислот и при гликолитическом распаде глицерина, АК путем образования пирувата (Gly, Ser, Val, Ala, Leu, Ile, Cys), промежуточных соединений цикла лимонной кислоты (Asp, Asn, Glu, Gln, Pro) или др промежуточных соединений (Leu, Ilе, Trp). Внутренняя мембрана митохондрий непроницаема для ацетил-СоА. Поэтому вначале АсСоА конденсируется с оксалоацетатом с образованием цитрата, легко проникающего в цитоплазму. В цитоплазме цитрат распадается под действием цитрат-омыляюшего фермента на оксалоацетат и исходный ацетил-СоА, который используется в синтетических реакциях (синтезе жирных кислот, синтезестероидов и т.д.). Фрагмент молекулы ацетил-СоА, содержащий 2С, вступает в реакцию конденсации с оксалоацетатом (4С), что приводит к образованию цитрата (6С), который в процессе шести последовательных реакций опять превращается в оксалоацетат. Два атома углерода постепенно отщепляются в виде молекул СО2 (одна молекула от ацетил-СоА, другая – от оксалоацетата), а восемь атомов водорода (4 х 2) отщепляются дегидрогеназами, при этом они оказываются связанными с коферментами соответствующих дегидрогеназ. Цикл лимонной кислоты протекает в тесной связи с дыхательной цепью, где большая часть энергии выделяется при окислении восстановленных коферментов. Реакции цикла лимонной кислоты протекают внутри митохондрий, в так называемом матриксе. Ферменты, способные катализировать эти реакции, не связаны с какой-либо биологической структурой. Практически это приводит к тому, что любая отдельная реакция цикла может служить исходным пунктом для дальнейших катаболических или анаболических процессов. Таким образом, цикл лимонной кислоты является одним из нескольких возможных путей превращения ацетил-СоА в организме, направленных на получение наибольшей энергии. Соединения, участвующие в цикле лимонной кислоты, образуют пул промежуточных веществ, дающих начало обратимым процессам в организме. Эти процессы метаболизма связывают в единое целое различные реакции распада и синтеза. С этой точки зрения отдельные реакции цикла лимонной кислоты занимают центральное место в метаболизме. α-Кетоглутарат является самым важным акцептором аминогрупп в реакциях переаминирования. Этот процесс приводит к получению глутамата, из которого могут образоваться глутамин или γ-аминомасляная кислота (последняя может превратиться в полуальдегид яблочной кислоты, который далее окисляется в яблочную кислоту). Глутамин также может выступать в качестве предшественника в синтезе пролина, орнитина, цитруллина, аргинина и других метаболитов. |
