|
|
биохимия соед,кост,зуб. Биохимия соединительной ткани|
Биохимия соединительной ткани
Соединительная ткань составляет до 50% массы человеческого организма. Это связующее звено между всеми тканями организма. Различают 3 вида соединительной ткани:
- собственно соединительная ткань;
- хрящевая соединительная ткань;
- костная соединительная ткань
Соединительная ткань может выполнять как самостоятельные функции, так и входить в качестве прослоек в другие ткани.
Функции соединительной ткани
1. Структурная
2. Обеспечение постоянства тканевой проницаемости
3. Обеспечение водно-солевого равновесия
4. Участие в иммунной защите организма
Состав и строение соединительной ткани
В соединительной ткани различают: межклеточное (основное) вещество, клеточные элементы, волокнистые структуры (коллагеновые волокна). Особенность: межклеточного вещества гораздо больше, чем клеточных элементов.
Межклеточное (основное) вещество (рис 1)
В интерстициальном внутритканевом пространстве между животными клетками находится сложное межклеточное вещество, экстрацеллюлярный матрикс. У многих тканей, например в мышцах и печени, матрикс заполняет только тонкие промежутки между клетками, тогда как в других тканях, таких, как соединительная, хрящевая и костная ткани, на межклеточный матрикс приходится большой объем и именно он выполняет основные функции. На рисунке в упрощенном виде представлены три главных компонента межклеточного матрикса: прочные коллагены, сетчатые адгезивные белки и основное вещество, протеогликаны.
Межклеточный матрикс выполняет разнообразные функции. Он обеспечивает механические контакты между клетками, образует механически прочные структуры, такие, как кости, хрящ, сухожилия и суставы, составляет основу фильтрующих мембран (например, в почках), изолирует клетки и ткани друг от друга (например, обеспечивает скольжение в суставах и движение клеток), формирует пути миграции клеток, вдоль которых они могут перемещаться, например при эмбриональном развитии. Таким образом, межклеточный матрикс чрезвычайно вариабелен как по химическому составу, так и по выполняемым функциям.
Коллагены образуют нити, фибриллы, сетки и связки. Характерные свойства коллагенов — прочность на разрыв и гибкость. Эластичным белком с аналогичными свойствами является эластин.
Адгезивные белки связывают различные составные компоненты межклеточного матрикса. Наиболее важными представителями являются ламинин и фибронектин. Эти полифункциональные белки характеризуются свойством связывать ряд других компонентов матрикса. Адгезивные белки обеспечивают фиксацию клеток в межклеточном матриксе за счет взаимодействия с мембранными рецепторами.
Молекулы фибронектинов представляют собой димеры сходных между собой полипептидных цепей (250 кДа), связанных дисульфидными связями. Субъединицы подразделяются на ряд различных доменов способных связываться с клеточными рецепторами, коллагенами, фибрином и протеогликанами. Такая особенность строения фибронектинов придает им свойство «молекулярного клея» (рис.2).
Рисунок 1
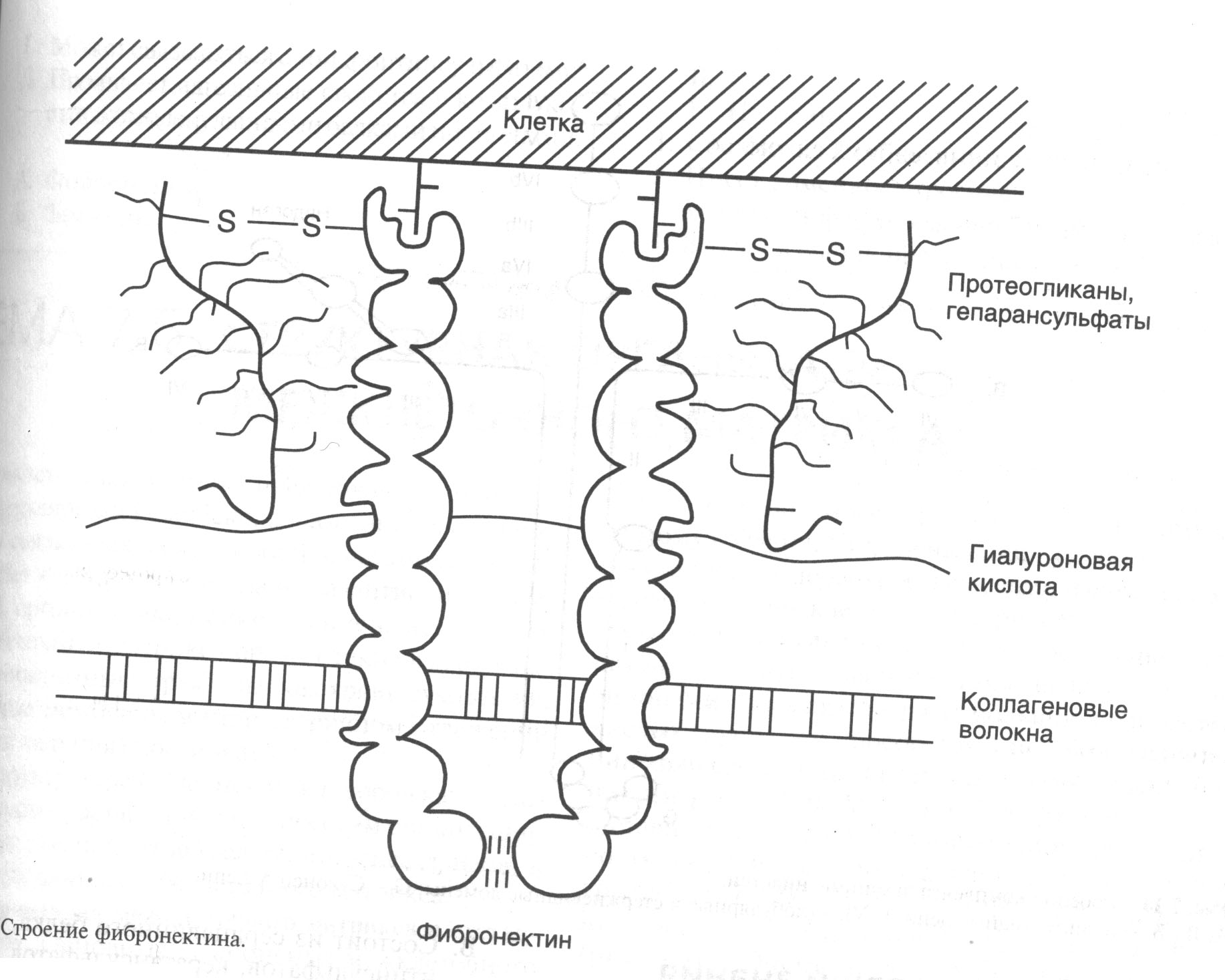
Рисунок 2
Протеогликаны выполняют функцию наполнителя (основного вещества). Благодаря полярной природе и сильному отрицательному заряду, они связывают катионы и основную часть воды.
Протеогликаны — одни из наиболее крупных молекул (М > 2•106 Да); они включают белковую (5%) и углеводную (95%) составляющие и по форме напоминают ершик для мытья бутылок. Полисахариды, обнаруженные в протеогликанах, обычно содержат ацетилированные аминосахара и, следовательно, относятся к гликозаминогликанам (ГАГ).
В клетке протеогликаны связаны с гиалуроновой кислотой. Образуется сложный надмолекулярный комплекс. В его составе: гиалуроновая кислота, особые связующие белки, а также протеогликаны. Упругие цепи ГАГ в составе протеогликанов образуют образуют макромолекулярные сетчатые структуры. Такое химическое строение обеспечивает выполнение функции молекулярного сита с определенными размерами пор при транспорте различных веществ и метаболитов. Размер пор определяется типом ГАГ, преобладающим в данной конкретной ткани. Например, соединительнотканая капсула почечного клубочка обеспечивает селективный транспорт веществ в процессе ультрафильтрации. За счет множества сульфо- и карбоксильных групп сетчатые структуры являются полианионами, способными депонировать воду, некоторые катионы (К+, Na+, Ca+2, Mg+2).
Больше всего протеогликанов содержится в межклеточном веществе хрящей, межпозвоночных дисков, сухожилий, связок, менисков, кожи, т.е. в тех анатомических структурах, которые подвергаются выраженной механической нагрузке и деформации. В хрящах суставных поверхностей протеогликаны выполняют роль рессор, так как смягчают и гасят резкие перемены нагрузки.
Гликозаминогликаны
Гликозаминогликаны (ГАГ) - это гетерополисахариды построены из дисахаридных единиц, которые и являются их мономерами.
По строению мономеров различают 7 типов гликозаминогликанов.
1. Гиалуроновая кислота
2. Хондроитин-4-сульфат
3. Хондроитин-6-сульфат
4. Дерматансульфат
5. Кератансульфат
6. Гепарансульфат
7. Гепарин
Гиалуроновая кислота Гиалуроновая кислота – самый большой гликозамингликан межклеточного вещества, его молекулярная масса достигает 105 – 107 Д. Гиалуроновая кислота построена из глюкуроновой кислоты и N- ацетилглюкозамина. В каждом дисахариде имеется отрицательно заряженная карбоксильная группа, а так как таких мономеров в молекуле гиалуроновой кислоты очень много, то она является полианионом. Благодаря своим полианионным свойствам гиалуроновая кислота связывает большие количества воды, в результате чего межклеточное вещество приобретает характер желеобразного матрикса. Гиалуроновая кислота (как и все гликозаминогликаны) способна связывать ионы Na+ и Са2+, что определяет участие межклеточного вещества в регуляции водно-солевого обмена.
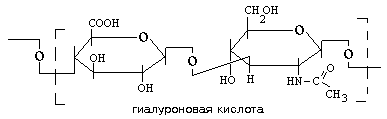
Гиалуроновая кислота может находиться и в свободном виде, и в составе сложных агрегатов. Это единственный представитель ГАГ, который не сульфатирован.
Хондроитин-сульфаты встречаются в связках суставов и в ткани зуба, дерматансульфат является одним из структурных компонентов хрящевой ткани.
Длинные полисахаридные цепи складываются в глобулы. Однако эти глобулы рыхлые (не имеют компактной укладки) и занимают сравнительно большой объем. ГАГ являются гидрофильными соединениями, содержат много гидроксильных групп, имеют значительный отрицательный заряд (много карбоксильных и сульфогрупп). Значительный отрицательный заряд способствует присоединению к ним положительно заряженных катионов калия, натрия, кальция, магния. Это еще более увеличивает способность удерживать воду, а также способствует диссоциации молекул этих веществ в соединительной ткани.
Катаболизм компонентов основного вещества
Идет под действием некоторых гидролаз.
Например, НЕЙРАМИНИДАЗА отщепляет от гликопротеинов N-ацетилнейраминовую (сиаловую) кислоту, и уже дестабилизированный гликопротеин поглощается макрофагами. Поэтому концентрация сиаловых кислот в крови - характеристика состояния соединительной ткани. При воспалительных процессах эта концентрация намного возрастает.
При недостаточности ферментов катаболизма основного вещества развиваются заболевания - мукополисахаридозы, при которых в тканях происходит накопление тех или иных ГАГ.
ВОЛОКНА СОЕДИНИТЕЛЬНОЙ ТКАНИ
В межклеточном матриксе находятся 2 типа волокнистых структур: КОЛЛАГЕНОВЫЕ и ЭЛАСТИНОВЫЕ ВОЛОКНА. Основным их компонентом является нерастворимый белок КОЛЛАГЕН.
КОЛЛАГЕН
Коллаген является основным структурным белком межклеточного матрикса. Это фибриллярный белок, отличающийся от других белков рядом особенностей своего состава и структуры.
Типичная молекула коллагена состоит из трех полипептидных целей разных типов (α-спиралей), скрученных в виде правой тройной спирали. В свою очередь полипептидные цепи построены из часто повторяющихся фрагментов, имеющих характерную последовательность -Gly-X-Y-. Каждым третьим аминокислотным остатком является глицин. Пролин (Pro) часто встречается в положениях X, положение Υ может быть занято как пролином, так и 4-гидроксипролином (4Нур). Кроме того, молекула коллагена содержит остатки З-гидроксипролина (ЗНур) и 5-гидроксилизина (5Нуl).
Присутствие в полипептидной цепи остатков гидроксиаминокислот является характерной особенностью коллагена. Остатки пролина и лизина гидроксилируются посттрансляционно, т. е. после включения в полипептидную цепь. На одном из концов молекула коллагена сшита поперечными связями, образованными боковыми цепями остатков лизина. Количество поперечных связей возрастает по мере старения организма.
При формировании вторичной структуры полипептидная цепь коллагена укладывается в более развернутую левозакрученную -спираль (на один виток приходится 3 аминокислотных остатка);
Третичная структура коллагена — это правозакрученная суперспираль из 3 -цепей, при формировании которой остаток глицина оказывается в ее центре, что способствует образованию линейной молекулы тропоколлагена с последующим включением ее в волокно.
Типы коллагена. Известно 19 типов коллагена, которые отличаются друг от друга по первичной структуре пептидных цепей, функциям и локализации в организме. Коллагены входят в состав фибрилл (фибриллообразующие коллагены- I, II, III, V и XI типы), миофибрилл (коллаген VI типа), являются структурным компонентом базальных мембран (коллаген IV типа) и т.д.
Фибриллообразующие коллагены (I, II, III, V и XI типы). Основа фибрилл — ступенчато расположенные параллельные ряды молекул тропоколлагена, которые сдвинуты на 1/4 относительно друг друга.
Фибриллогенезу предшествует еще одна модификация лизина. Внеклеточный медьсодержащий фермент лизилоксидаза осуществляет окислительное дезаминирование лизина и гидроксилизина с образованием реактивных альдегидов. Для этих реакций необходимо присутствие витаминов РР и В6. Эти группы принимают участие в формировании поперечных ковалентных связей между молекулами тропоколлагена.
Преимущественное распределение этих типов коллагена по тканям следующее: I тип — кости, дентин, роговица, сухожилия; II тип — хрящи, межпозвоночные диски, стекловидное тело; III тип — почки, печень, сосуды, лимфатические узлы. Коллагены V и XI типов в разных количествах присутствуют в межклеточном веществе всех тканей, они определяют диаметр коллагеновых фибрилл.
Синтез и созревание коллагена (рис.3,4)
Синтез и созревание коллагена представляют собой сложный многоэтапный процесс, который начинается в клетке, а завершается во внеклеточном пространстве. Он включает в себя ряд пострансляционных изменений: гидроксилирование пролина и лизина, гликозилирование гидроксилизина, отщепление N- и С-концевых пептидов. Благодаря этим изменениям появляются дополнительные возможности для стабилизации цепей в молекуле тропоколлагена; в образовании водородных связей участвуют не только NH- и СО-группы пептидного остова но и ОН-группы гидроксипролина; гидроксипролин и пролин, являясь «жесткими» молекулами, ограничивают вращение полипептидного стержня.
Определенную роль в синтезе коллагена играют белки - шапероны, которые обеспечивают «контроль качества» коллагена: они способствуют правильному синтезу молекул коллагена и их транспорту по секреторным путям, а также «отслеживают» неправильно собранные молекулы коллагена, которые затем разрушаются.
СИНТЕЗ КОЛЛАГЕНА
Существуют 8 этапов биосинтеза коллагена: 5 внутриклеточных и 3 внеклеточных.
1-Й ЭТАП
Протекает на рибосомах, синтезируется молекула-предшественник: препроколлаген.
2-Й ЭТАП
С помощью сигнального пептида “пре” транспорт молекулы в канальцы эндоплазматической сети. Здесь отщепляется “пре” - образуется “проколлаген”.
3- Й ЭТАП
Аминокислотные остатки лизина и пролина в составе молекулы коллагена подвергаются окислению под действием ферментов пролилгидроксилазы и лизилгидроксилазы..
При недостатке витамина “С” - аскорбиновой кислоты наблюдается цинга, - заболевание, вызванное синтезом дефектного коллагена с пониженной механической прочностью, что вызывает, в частности, разрыхление сосудистой стенки и другие неблагоприятные явления.
4-Й ЭТАП
Посттрасляционная модификация - гликозилирование проколлагена под действием фермента гликозилтрансферазы. Этот фермент переносит глюкозу или галактозу на гидроксильные группы оксилизина.
5-Й ЭТАП
Заключительный внутриклеточный этап - идет формирование тройной спирали - тропоколлагена (растворимый коллаген). В составе про-последовательности - аминокислота цистеин, который образует дисульфидные связи между цепями. Идет процесс спирализации.
6-Й ЭТАП
Секретируется тропоколлаген во внеклеточную среду, где амино- и карбоксипротеиназы отщепляют (про-)-последовательность.
7-Й ЭТАП
Ковалентное “сшивание” молекулы тропоколлагена по принципу “конец-в-конец” с образованием нерастворимого коллагена. В этом процессе принимает участие фермент лизилоксидаза (флавометаллопротеин, содержит ФАД и Cu). Происходит окисление и дезаминирование радикала лизина с образованием альдегидной группы. Затем между двумя радикалами лизина возникает альдегидная связь.
Лизилоксидаза является Cu-зависимым ферментом, поэтому при недостатке меди в организме происходит уменьшение прочности соединительной ткани из-за значительного повышения количества растворимого коллагена (тропоколлагена).
8-Й ЭТАП
Ассоциация молекул нерастворимого коллагена по принципу “бок-в-бок”. Ассоциация фибрилл происходит таким образом, что каждая последующая цепочка сдвинута на 1/4 своей длины относительно предыдущей цепи.
Только после многократного сшивания фибрилл коллаген приобретает свою уникальную прочность, становится нерастяжимым волокном.

Рисунок 3 Катаболизм коллагена
Нативный коллаген не гидролизуется обычными пептидгидролазами, основной фермент катаболизма коллагена — коллагеназа. Коллаген — медленно обменивающийся белок, о скорости его обмена судят по содержанию оксипролина в крови и моче. Катаболизм коллагена более активен в молодом возрасте (до 20 лет) и при некоторых
Рисунок 4
заболеваниях (коллагенозы, гиперпаратиреоидизм, некоторые инфекционные заболевания).
Эластические волокна
2-й вид волокон - эластические. В основе строения - белок эластин. Эластин еще более гидрофобен, чем коллаген. В нем до 90% гидрофобных аминокислот.
Эластин - это основной структурный компонент эластических волокон, которые содержатся в тканях, обладающих значительной эластичностью (кровеносные сосуды, связки, легкие). Свойства эластичности проявляются высокой растяжимостью этих тканей и быстрым восстановлением исходной формы и размера после снятия нагрузки. Эластин — гликопротеин с молекулярной массой 70 кД, который содержит много гидрофобных аминокислот (Гли, Вал, Ала, Лей, Про). В отличие от большинства белков пептидные цепи эластина не приобретают характерную третичную структуру, а сохраняют гибкую случайную конформацию (рис.5).
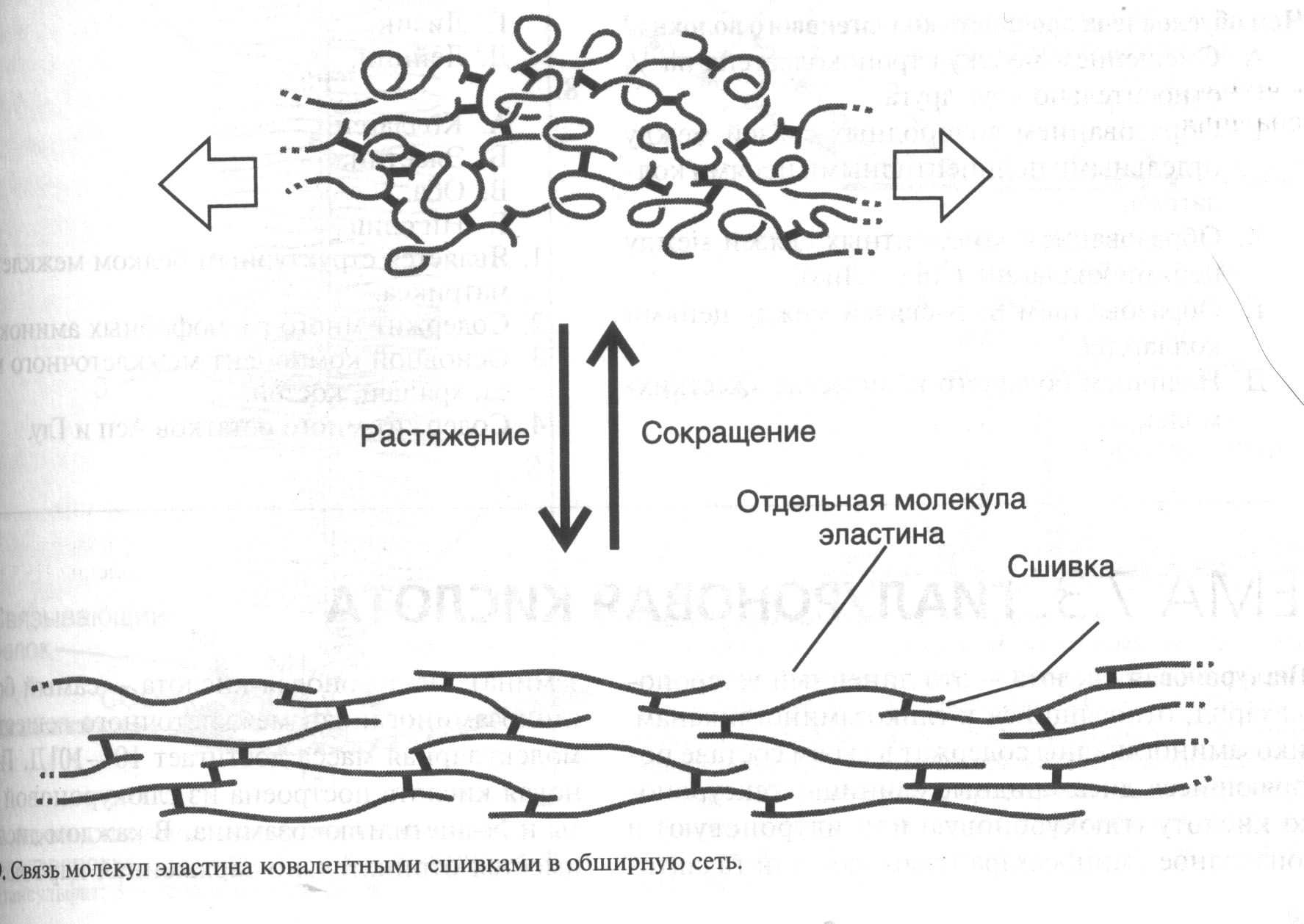
Рисунок 5
В межклеточном матриксе молекулы эластина образуют волокна, сети, слои, в которых отдельные молекулы связаны множеством сшивок.
Наличие гибкой случайной конформации молекул эластина и большого количества поперечных сшивок позволяет эластическим волокнам проявлять свои резиновоподобные свойства.
Клеточные элементы соединительной ткани
Это фиброблсты, тучные клетки, макрофаги. В них происходят процессы синтеза структурных компонентов, а также процесс распада соединительной ткани. Коллаген обновляется на 50% за 10 лет. В фибробластах идут синтетические процессы: синтез коллагена, эластина.
Биохимия костной ткани и зуба
Кости — очень плотная, специализированная форма соединительной ткани. Основные особенности кости - твердость, упругость, механическая прочность.
Наряду с выполнением опорных функций кости служат местом депонирования кальция и неорганического фосфата, а в костном мозге образуются клетки кроветворной системы и созревают клетки иммунной системы.
Наиболее важной минеральной составляющейкостной ткани является нерастворимый фосфат кальция в виде гидроксилапатита или карбонатапатита (Ca10(PO4)6(OH)2 и Ca10(PO4)6СО3 соответственно). В костях присутствуют также карбонаты других щелочноземельных элементов. Апатит — это крупный комплексный катион Ca[Ca3(PO4)2]32+, который окружают противоионы ОН-, СО32-, HPO42- или F-.
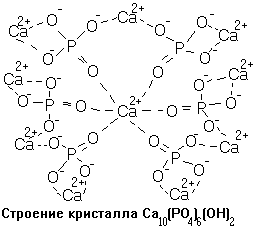
В компактном веществе кости большая часть минеральных веществ представлена гидроксилапатитом (смотрите рисунок) и аморфным фосфатом кальция. Кроме них встречаются карбонаты, фториды, гидроксиды и значительное количество цитрата. Химический состав костной ткани (в%%): 20% - органический компонент, 70% - минеральные вещества, 10% - вода. Губчатое вещество: 35-40% - минеральных веществ, до 50% - органические соединения, содержание воды - 10%.
Особенность минерального компонента в том, что фактическое соотношение кальций/фосфор равно 1,5, хотя расчетное соотношение должно быть 1,67. Это позволяет кости легко связывать или отдавать ионы фосфата, поэтому кость - это депо для минералов, особенно для кальция.
Органический матрикс кости.
Важный компонент органического матрикса - кальций-связывающий белок. Он состоит из 49 аминокислот, содержит 3 остатка гамма-карбоксиглутаминовой кислоты. Функция кальций-связывающего белка - регуляция связывания кальция в костях и зубах.
Основной белок костной ткани - коллаген, который содержится в количестве 15% - в компактном веществе, 24% - в губчатом веществе. Количество неколлагеновых белков составляет от 5 до 8%. В основном это белки- гликопротеины и белково-углеводные комплексы - протеогликаны.
Костный коллаген - коллаген типа 1 - в нем больше, чем в других видах коллагена, содержится оксипролина, лизина и оксилизина, отрицательно заряженных аминокислот, с остатками серина связано много фосфата, поэтому костный коллаген - это фосфопротеин. Благодаря своим особенностям костный коллаген принимает активное участие в минерализации костной ткани.
В зрелом организме процессы минерализации и резорбция кости находятся в состоянии динамического равновесия. Минерализация - это формирование кристаллических структур минеральных солей костной ткани. Активное участие в минерализации принимают остеобласты. Для минерализации требуется много энергии ( в форме АТФ ).
Можно выделить два основных этапа минерализации.
Этапы минерализации костной ткани
Этап 1.Остеобласты синтезируют коллаген первого типа, снабжены рецепторами паратгормона, их основная функция – формирование органического остеоида и его минерализацию. В процессе минерализации также участвуют неколлагеновые кальций – связывающие белки остеобластов. К ним относятся остеокальцин и матриксный карбоксиглютамил-содержащий белок. Карбоксиглютаминирование обоих белков зависит от витамина К. Остеокальцин уникален для костей и зубов и его уровень в крови отражает скорость остеогенеза. Параллельно, через тромбоспондин, остеонектин и остеопонтин, эти фиксаторы кальция (и магния) закрепляются на коллагеновой матрице.
Этап 2 - в зоне минерализации усиливаются окислительные процессы, распадается гликоген, синтезируется необходимое количество АТФ. Кроме того, в остеобластах увеличивается количество цитрата, необходимого для синтеза аморфного фосфата кальция. Одновременно из лизосом остеобластов выделяются кислые гидролазы, которые взаимодействуют с белками органического компонента и приводят к образованию ионов аммония и гидроксид-ионов, которые соединены с фосфатом. Так формируются ядра кристаллизации. Ионы кальция и фосфора, которые были связаны с белково-углеводным комплексом, переходят в растворимое состояние и формируют кристаллы гидроксилапатита. По мере роста кристаллы гидроксилапатита вытесняют протеогликаны и даже воду до такой степени, что плотная ткань становится практически обезвоженной. Окружая себя минерализованным остеоидом, остеобласты превращаются в остеоциты, цитоплазма которых образует отростки, связанные с соседними остеоцитами.
Основную остеолитическую функцию в единицах ремоделирования кости выполняют остеокласты. Остеокласты перемещаются и образуют в участках резорбируемой кости активный слой, прикрепляясь через специальный адаптер —интегрин — к остеопонтину. Они выделяют на своей активной гофрированной каёмке коллагеназу и маркерный фермент — кислую фосфатазу, лизируя минерализованный остеоид и растворяя кристаллы гидроксиапатита. Для этого, с помощью специальных протонного АТФазного насоса и карбоангидразы II типа, ими локально создается зона кислого рН=4.
При нарушении процессов минерализации - например, при заболевании оссифицирующим миозитом - кристаллы гидроксиапатита могут появлятся в сухожилиях, связках, стенках сосудов. Вместо кальция в костную ткань могут включаться другие элементы - стронций, магний, железо, уран и т.д. После формирования гидроксилапатита такое включение уже не происходит. На поверхности кристаллов может накапливаться много натрия в форме цитрата натрия.
Кость выполняет функции лабильного (изменчивого) депо натрия, который выделяется из кости при ацидозе и, наоборот, при избытке поступления натрия с пищей, чтобы предотвратить алкалоз - натрий депонируется в кости. В ходе роста и развития организма количество аморфного фосфата кальция уменьшается, потому что кальций связывается с гидроксилапатитом.
Щелочная фосфатаза находится в остеобластах, кислая фосфатаза локализована в остеокластах. Оба фермента служат маркерами клеток костной ткани.
Костная ткань находится под контролем многих гормонов. Так, СТГ, пролактин, инсулин и андрогены способствуют синтезу остеоида. Глюкокортикоиды снижают в костях синтез коллагена, а также, препятствуя действию кальцитриола в кишечнике и уменьшая почечную реабсорбцию кальция, способствуют потере этого иона и остеопорозу. Эстрогены способствуют синтезу остеоида и отложению кальция в костях, как опосредованно через главные регуляторы кальциевого обмена, так и непосредственно
Но решающей остаётся регуляция с помощью кальцитонина, кальцитриола и паратгормона.
Обмен кальция и фосфора
В организме взрослого человека содержится около1,5 кг кальция и более 1 кг фосфора. Это 2 его главных минеральных компонента. Из данного количества 98% кальция и 85% фосфора связано в костях и зубах. Другой фонд - ионы кальция, растворенные в жидкостях или соединенные с белками жидкостей и тканей. Концентрация кальция внутри клеток зависит от его концентрации во внеклеточной жиидкости.
Пределы колебаний концентрации Са2+ в крови здоровых людей 2,12—2,6 ммоль/л (9—11 мг/дл). Многие процессы в организме регулируются кальцием, при участии специфически распознающих его белков (кальмодулина, кальэлектринов, кальпаинов и т.д.). От кальция зависит генерация потенциалов действия и электромеханическое сопряжение, передача гормонального сигнала и клеточная локомоция. Кальций регулирует и скорость жизненно важных внеклеточных процессов — например, свёртывания крови. Избыток кальция может вызывать нарушение этих процессов, апоптоз или гибель клеток.
С пищей поступает от 0.6 до 1 г кальция (норма – не менее 0.6 г). Кальций плохо всасывается в ЖКТ, выводится почками (до 0.3 г в сутки) и потовыми железами (до 0.1 г в сутки). В плазме 40% кальция связано с альбумином (связанная форма), 15% - с кислыми органическими анионами. Остальное количество – свободная форма.
Уровень ионизированного кальция в плазме регулируется взаимодействующими гормонами паратиреокринином и кальцитонином, а также витамином D. Под их контролем, приблизительно 0,5 г кальция в сутки у взрослого индивида обменивается между скелетом и плазмой крови.
Метаболизм кальция в организме тесно переплетён с обменом фосфатов, связывающих большую часть внеклеточного кальция в виде кристаллов гидроксиапатита в композитных минерализованных структурах — костях.
Фосфор абсорбируется в ЖКТ очень активно. С пищей, в среднем, в день поступает около 1,2 г фосфора. Для диагностики нарушений фосфорно-кальциевого обмена, концентрации фосфора в крови, следует определять натощак, так как, в отличие от уровня кальция, они растут после еды.
В тощей кишке всасывается до 90% суточного потребления фосфатов. Почки экскретируют 15% фильтрующихся фосфатов с мочой, в равновесном с поступлением этих ионов режиме. Фосфат может активно секретироваться в канальцах. Реабсорбция фосфата происходит на 9/10 — в проксимальных канальцах, а на 1/10 — в более дистальных частях нефрона.
В дополнение к 85% фосфора, депонированным в костях и зубах, мягкие ткани содержат существенную часть связанного фосфора и фосфат-аниона (до 14%). Всего 1% фосфора находится во внеклеточной жидкости. Макроэргические фосфатные соединения и фосфорилированные активные метаболиты в норме не могут свободно покидать клетки. Поэтому, только 12% фосфатов плазмы связано с белками, остальные представлены свободными фосфат-анионами. Уровень фосфора в плазме зависит от факторов, регулирующих обмен кальция.
Процессы депонирования кальция и фосфора в костях и их абсорбции/экскреции в кишечнике и почках взаимно сбалансированы так, что концентрация этих ионов в крови изменяется в весьма узких пределах. 1
Концентрация Са2+ в плазме регулируется с высокой точностью; изменение ее всего на 1% приводит в действие гомеостатические механизмы, восстанавливающие равновесие. Основными регуляторами обмена Са2+ в крови являются паратгормон, кальцитриол и кальцитонин (рис.6,7,8).
Паратгормон (ПТГ) синтезируется в виде предшественника — препрогормона, содержащего 115 аминокислотных остатков. Во время переноса в секреторные пузырьки (везикулы) препрогормон превращается в зрелый гормон, включающий 84 аминокислотных остатка. Интактный ПТГ может расщепляться на короткие пептиды. N-концевые пептиды, содержащие 34 аминокислотных остатка, обладают полной биологической активностью и секретируются железами наряду со зрелым ПТГ. Скорость распада гормона уменьшается при низкой концентрации ионов кальция и увеличивается, если концентрация ионов кальция высока.

Рисунок 6
Секреция ПТГ регулируется уровнем ионов кальция в плазме: гормон секретируется в ответ на снижение концентрации кальция в крови.
Органами-мишенями для ПТГ являются кости и почки, а также кишечник (опосредованное действие). В клетках почек и кости локализованы специфические рецепторы, которые взаимодействуют с паратгормоном, в результате чего инициируется каскад событий, связанный с аденилатциклазой.
ПТГ восстанавливает нормальный уровень ионов кальция во внеклеточной жидкости путем как прямого воздействия на кости (активация аденилатциклазы стимулирует метаболическую активность остеокластов, в результате чего происходит мобилизация Са2+ из кости (рис. 1) и поступление фосфатов в кровь и почки (стимулирует реабсорбцию Са2+ дистальными канальцами почек;, так и опосредованного (через стимуляцию синтеза кальцитриола) воздействия на слизистую оболочку кишечника, увеличивая в этом случае эффективность всасывания Са2+ в кишечнике. В почках ПТГ также уменьшает реабсорбцию фосфатов.
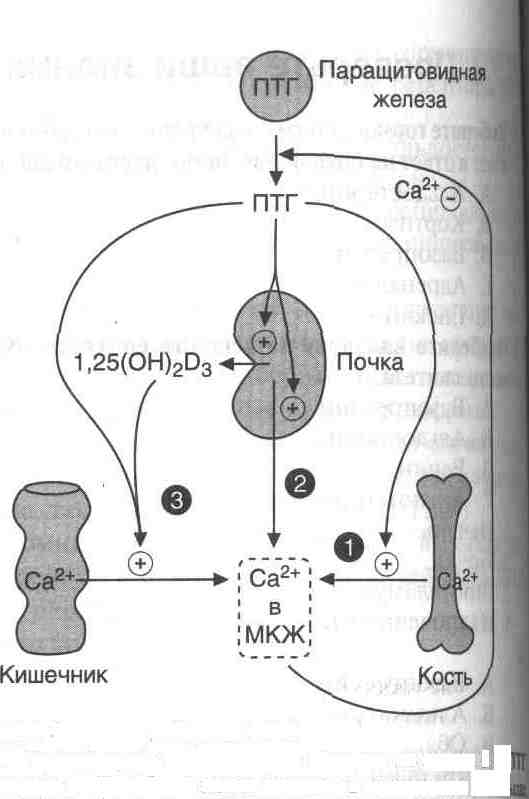
Рисунок 7
Эффекты действия ПТГ. 1 — ПТГ стимулирует мобилизацию кальция из кости; 2 -| стимулирует реабсорбцию ионов кальция в дистальных канальцах почек; 3 — ПТГ активирует образование 1,25(ОН) 2 D3 в почках, что приводит к стимуляции всасывания Са2+ в кишечнике МКЖ — межклеточная жидкость.
Кальцитриол, как и другие стероидные гормоны, синтезируется из холестерина. Непосредственным предшественником кальциферола является холекальциферол (витамин D3). Небольшое количество витамина D3 содержится в продуктах питания, но большая часть витамина, используемого в синтезе кальцитриола, образуется в коже из 7-дегидрохолестерола в ходе неферментативной реакции под действием ультрафиолетового света. Образование кальцитриола начинается в печени и заканчивается в почках (рис. 7).
В печени холекальциферол гидроксилируется по 25 -му атому углерода с образованием 25-гидроксихолекальциферола.
Гидроксилирование, протекающее в почках, является скорость лимитирующей стадией. Именно 1,25(ОН) 2 D3 представляет собой активную форму витамина D3. Эта реакция стимулируется низкой концентрацией ионов Са2+ в крови и паратгормоном. Повышение уровня кальцитриола тормозит 1 - гидроксилазу почек.
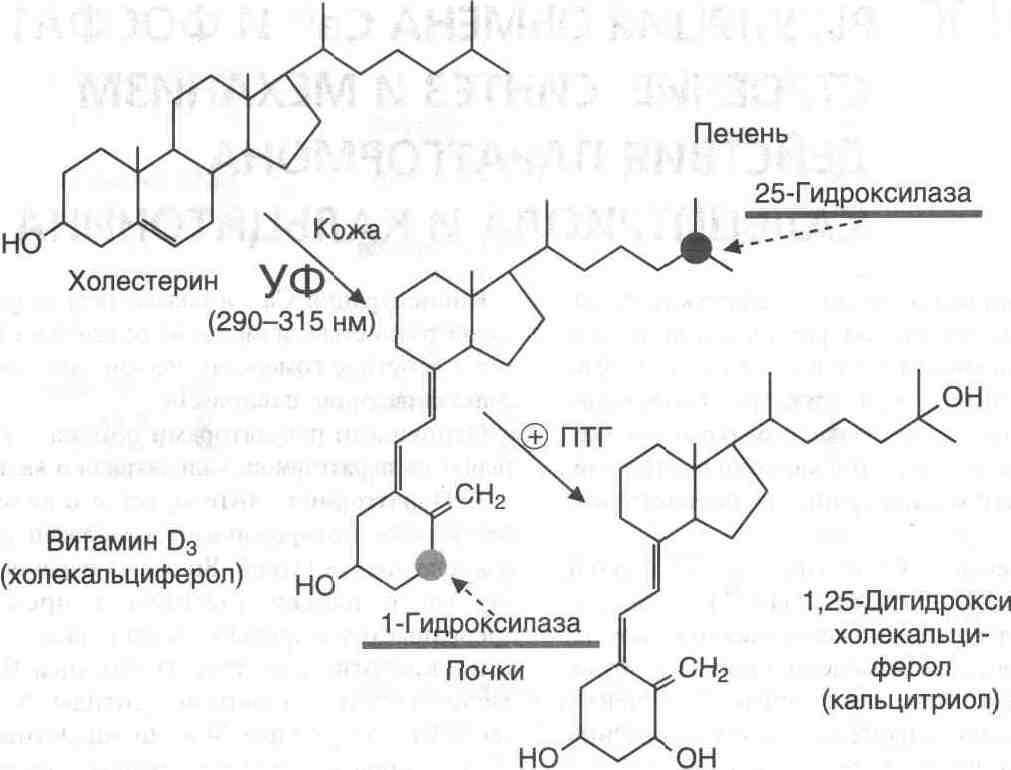
Рисунок 8
Кальцитриол, подобно другим стероидным гормонам, связываясь с внутриклеточным рецептором, взаимодействует с хроматином, изменяет скорость синтеза определенных белков. В результате стимулируются всасывание кальция и фосфатов в кишечнике и мобилизация кальция из кости.
Кальцитонин — полипептид, состоящий из 32 аминокислотных остатков с одной дисульфидной связью. Гормон секретируется парафолликулярными К-клетками щитовидной железы или С-клетками паращитовидной железы в виде высокомолекулярного белка- предшественника. Секреция кальцитонина возрастает при увеличении концентрации Са2+ и уменьшается при снижении концентрации Са2+ в крови. Кальцитонин ингибирует высвобождение Са2+ из кости и стимулирует его экскрецию почками с мочой.
Недостаток кальцитриола у детей приводит к заболеванию рахитом, а у взрослых может вызвать нарушение обмена веществ в костной ткани. Отрицательный баланс между процессами отложения и вымывания кальция, особенно в пожилом возрасте, вызывает заболевание остеопорозом.
БИОХИМИЯ ТКАНЕЙ ЗУБА
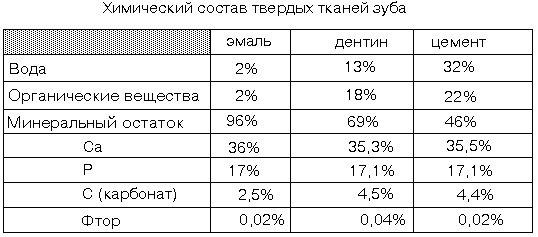
Твердые ткани зуба - к ним относят эмаль ( в коронке зуба), дентин и цемент ( на поверхности корня). В отличие от других видов костной ткани, ткани зуба еще более минерализованы. В заметных количествах в твердых тканях зуба содержатся магний, натрий, калий, хлор (их больше в цементе и в эмали).
Эмаль
Содержит гидроксилапатит, фторапатит, фторид кальция. Соотношение кальций/фосфор в эмали равно 1,75, поэтому эмаль еще более минерализирована, чем кость. С возрастом это соотношение доходит до 2,09. Органическое вещество эмали образуют в основном белки - амелогенины. Основная функция этих белков - формирование нерастворимой органической матрицы эмали, которая затем минерализируется благодаря особому кальций-связывающему белку эмали. В состав эмали также могут входить глюкозаминогликаны и цитрат. Особенности метаболизма эмали - это крайне низкая скорость обмена. Обмен ионами возможен со стороны полости рта - через слюну.
Дентин
Дентин в отличие от эмали содержит много сиалопротеинов (это неколлагеновые белки). По степени минерализации дентин аналогичен компактному веществу костной ткани. Минеральный компонент - гидроксилапатит, в котором чаще, чем в кости, обнаруживается магний. Фтористые соли также содержатся в дентине. В состав органического вещества дентина входит коллаген, богатый фосфатом, хондроитинсульфаты, гиалуроновая кислота. При развитии кариеса в поврежденном дентине и уменьшается количество оксипролина и оксилизина и растет количество глюкозаминогликанов. Клеточные элементы - одонтобласты.
Цемент
Цемент еще менее минерализован, чем дентин. Здесь больше воды и протеогликанов. Клеточные элементы - цементобласты.
Пульпа
Это особая соединительная ткань, похожая на эмбриональную соединительную ткань. Поскольку пульпа наиболее метаболически активна, в ней много ферментов. Кроме фибропластов, в пульпе есть и жировые клетки. В межклеточном веществе - гликопротеины, глюкозаминогликаны. Волокнистая структура пульпы - это тонкие коллагеновые волокна. Функция пульпы: формирование дентина и обеспечение метаболических процессов в дентине.
В кислой среде ткань зуба подвергается атаке и утрачивает твердость. Такое распространенное заболевание, как кариес, вызывается микроорганизмами, живущими на поверхности зубов и выделяющими в качестве продукта анаэробного гликолиза органические кислоты, вымывающие из эмали ионы Са2+. Другие продукты бактериального метаболизма сахаров — внеклеточные декстраны, нерастворимые полисахариды; они играют роль защитного фактора для бактерий. Бактерии и декстраны составляют основную массу зубного камня(зубных бляшек), образующегося на плохо чищеных зубах. Профилактические меры защиты от кариеса включают регулярную чистку зубов (с целью удаления зубного налета), использование воды, обогащенной фтором (с целью насыщения зубной эмали ионами фтора) и т.д. |
|
|
 Скачать 1.33 Mb.
Скачать 1.33 Mb.








